颅咽管瘤患儿血清IL-6、IL-8、MIP-1α含量变化及其意义探讨①
2012-07-30刘志忠丁秀荣袁宝军康熙雄
刘志忠 丁秀荣 袁宝军 石 峻 康熙雄
(首都医科大学附属北京天坛医院实验诊断中心,北京100050)
儿童颅咽管瘤是常见的先天性颅内肿瘤,占儿童脑肿瘤的10%,占儿童鞍区肿瘤的54%,几乎全部是牙釉质型,绝大多数病例有囊变和钙化,及与视神经、视交叉、垂体柄等结构粘连,一些颅咽管瘤还具有侵袭性生长及易复发的特点,故张玉琪等[1]认为儿童颅咽管瘤应属恶性肿瘤。儿童颅咽管瘤的病因至今不详。炎症与肿瘤的关联已得到广泛的关注,在肿瘤微环境中,炎症细胞和分子几乎影响到肿瘤进展的每一方面[2]。本实验采用高通量液体芯片技术检测了颅咽管瘤患儿外周血清中IL-6、IL-8和MIP-1α三种炎症因子的含量,旨在探讨它们在儿童颅咽管瘤患者血清中的表达情况,现报道如下。
1 对象与方法
1.1 对象 39例颅咽管瘤患儿,均选自2010年2月至2011年2月期间在首都医科大学附属北京天坛医院住院的患者,年龄5~15岁,平均年龄(10.65±4.38)岁,根据颅咽管瘤组有无术后复发分为初发组(21例),复发组(18例),术后复发时间20~35个月。所有病例均排除合并全身感染、心、肝、肾、肺疾病、糖尿病及其他肿瘤。健康对照组:为2010年间在河北联合大学附属医院健康体检儿童,共54例,其中男34例,女20例,年龄5~15岁,平均年龄(10.14 ±3.28)岁,与肿瘤组比较,年龄、性别比例均无统计学差异(P>0.05)。入选者均无高血压、心脏病、糖尿病、肝病、肾病和其他全身系统性疾病。
1.2 方法
1.2.1 标本的收集和保存 收集入选患者入院次晨空腹静脉血3 ml于黄帽真空采血管中,室温下静置半小时,3 000 r/min离心5分钟,提取血清,置于-80℃冰箱保存,待检。健康对照儿童在体检当日空腹抽取静脉血3 ml,处理保存方式同病例组。
1.2.2 血清IL-6、IL-8、MIP-1α 含量检测 血清 IL-6、IL-8、MIP-1α含量检测采用美国Luminex公司生产的Luminex 200多功能液相芯片分析仪检测。试剂为高通量液体芯片检测试剂盒(Milliplex Human Cytokine/Chemokine Immunoassay),产自美国Millipore公司。操作过程严格按照试剂盒操作说明进行。
1.3 统计方法 采用SPSS11.5统计软件包进行数据分析。计量资料进行正态性检验,符合正态分布的计量资料采用±s表示,两组均数之间差别的比较采用t检验;非正态分布的计量资料用中位数M和四分位数间距(Q25-Q75)表示,组间比较采用秩和检验。计数资料采用χ2检验。两变量相关性采用Spearman相关分析。以P<0.05表示差异有统计学意义。
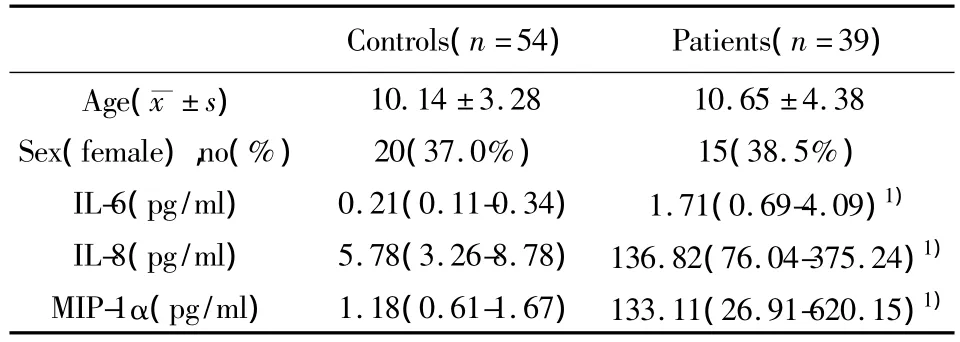
表1 病例组和对照组人口学数据及血清IL-6和IL-8、MIP-1α浓度Tab.1 The levels of the serum IL-6,IL-8 and MIP-1α in patients and healthy controls
2 结果
2.1 颅咽管瘤患儿血清IL-6、IL-8、MIP-1α 浓度变化 颅咽管瘤组和健康对照组IL-6、IL-8、MIP-1α浓度变化如表1所示。肿瘤组三种炎症因子浓度与对照组比较,差异均有统计学意义,P值均<0.01。其中MIP-1α浓度变化最为显著,肿瘤组的浓度是健康对照组浓度的112.81倍,而IL-8、IL-6浓度分别是对照组的23.67倍和8.14倍。
2.2 颅咽管瘤血清IL-6、IL-8、MIP-1α 浓度与肿瘤复发的关系 研究发现,颅咽管瘤复发患儿MIP-1a血清浓度为 355.2(97.45 ~1 028.78)pg/ml,初发颅咽管瘤患儿MIP-1α血清浓度为105.5(21.58~278.0)pg/ml,二者比较差异有统计学意义(P<0.05)。其他两种炎症因子两组间比较则未发现统计学差异(均P>0.05)。如表2所示。
2.3 颅咽管瘤患儿血清IL-6、IL-8、MIP-1α 浓度相关性 Spearman等级相关分析发现,血清IL-6和IL-8 呈正相关关系,rs=0.668,P <0.01;血清 IL-6和 MIP-1α 呈正相关关系,rs=0.734,P <0.01;血清IL-8 和 MIP-1α 呈正相关关系,rs=0.926,P <0.01。其中,血清IL-8和MIP-1α浓度的相关性最好。
3 讨论
颅咽管瘤好发于学龄前儿童,并且肿瘤组织生长缓慢,多数病例等到肿瘤直径达到3 cm以上才出现明显的症状,从症状开始出现到确诊通常需1~2年的时间。大量的临床研究证实,颅咽管瘤的炎症反应是导致其与周围重要结构紧密粘连的重要原因[3,4]。黄广龙等[5]也研究证明了成釉细胞型颅咽管瘤存在严重的炎症反应,肿瘤组织及肿瘤间质中炎症细胞聚集,C-反应蛋白及 NF-κB水平明显升高,NF-κB信号通路被过度激活。
IL-6是一种具有广泛免疫调节作用的细胞因子,有学者发现脑胶质瘤细胞株、脑胶质瘤组织及肿瘤浸润巨噬细胞、淋巴细胞中都有IL-6的基因表达,并且基因的表达强弱与脑胶质瘤的恶性程度有关[6]。在本实验中,我们发现肿瘤组IL-6浓度显著高于对照组,说明在儿童颅咽管瘤中也可能存在IL-6的自分泌合成,从而导致外周血中IL-6的升高。颅咽管瘤的肿瘤组织及肿瘤间质中有炎症细胞聚集[5],如巨噬细胞、淋巴细胞等,我们推断IL-6的旁分泌途径也是儿童颅咽管瘤患儿血清IL-6浓度升高的原因之一。

表2 初发和复发颅咽管瘤患儿血清IL-6、IL-8和MIP-1α浓度Tab.2 The levels of the serum IL-6,IL-8,MIP-1α in original and recurrence brain tumor children
白细胞介素8(IL-8)属于ELR+CXC亚家族趋化因子,在适当的刺激下单核细胞、巨噬细胞、中性粒细胞、淋巴细胞及人类多种肿瘤细胞和细胞系均可合成和分泌IL-8。在本实验中,颅咽管瘤患儿血清中IL-8含量明显升高,这说明肿瘤组织可能以自分泌或旁分泌的方式大量生成了IL-8,从而导致外周血中IL-8含量的升高。IL-8作为一种促血管生长因子,通过自分泌或旁分泌方式刺激肿瘤血管形成的作用受到了广泛关注。在脑部肿瘤组织中,IL-8的这种促血管增生作用也得到了证实[7]。由于儿童颅咽管瘤具有侵袭性生长及易复发等恶性肿瘤的特点[1],故升高的IL-8可能促进了该肿瘤的血管新生,其确切作用还需组织学研究印证。
MIP-1α是趋化因子CC亚族的成员之一,单核细胞、中性粒细胞、活化T细胞等非肿瘤细胞及某些肿瘤细胞在适当的刺激下均可分泌合成MIP-1α。MIP-1α与受体结合后对靶细胞有趋化作用并促使其激活,产生TNF-α、IL-1和 IL-6等,释放活性氧、蛋白水解酶,在慢性炎症、微血管形成等方面发挥着重要的作用。国外学者在研究脑胶质瘤细胞时发现,C6胶质瘤细胞受细胞外ATP(三磷酸腺苷)刺激,细胞表达MIP-1α的量增加,同时培养上清MIP-1α浓度也增加,升高的MIP-1α能够促进肿瘤细胞迁移。在本实验中无论是颅咽管瘤初发组还是复发组血清MIP-1α浓度较对照组均有显著升高,证明MIP-1α参与的炎症反应与颅咽管瘤形成发展有关[8]。
术后易复发是颅咽管瘤最大的特点,如果手术不能全切,则术后几乎均会复发[9]。即使是有影像学证实的全切患者,术后仍有一定的复发率,从0~27.3%各家报道不等[10]。如今在临床实践中颅咽管瘤的复发日益受到人们关注,但其分子机制仍研究甚少。本实验结果表明,三种炎症因子中,只有MIP-1α浓度在初发组与复发组之间有显著差异,提示MIP-1α促进了颅咽管瘤复发过程。大量文献报道,IL-6和 IL-8是 NF-κB信号通路的重要靶分子[11],但 MIP-1α 与 NF-κB 的关系则未见权威报道。我们认为,MIP-1α与IL-6、IL-8可能受不同的信号通路调节。颅咽管瘤中与IL-6、IL-8相关的NF-κB 信号通路强烈激活[5],与 MIP-1α 相关的信号通路的表达情况,有必要深入研究。通过MIP-1α相关信号通路的研究,可能发现治疗该肿瘤复发的作用靶点。目前,术后影像学随访是监测颅咽管瘤复发的主要工具。由于CT有潜在的放射作用,患儿复查宜采用MRI检查。但MRI检查价格过高,定期多次复查会加重患者家庭的经济负担。笔者认为可将MIP-1α血清浓度检测作为颅咽管瘤复发的筛选试验,浓度升高者再进一步做影像学检查既可节约医疗资源又可减轻患者的经济负担。
总之,颅咽管瘤患儿血清IL-6、IL-8和MIP-1α三种炎症因子水平均有不同程度升高,其中MIP-1α升高最为显著,且与颅咽管瘤的复发有关。针对MIP-1α及其相关分子的研究,有可能发现有价值的诊断指标及理想的治疗靶点。
1 张玉琪.儿童颅咽管瘤的治疗策略[J].中华神经外科杂志,2009;25(5):385-386.
2 Mantovani A.Cancer:Inflaming metastasis[J].Nature,2009;457(7225):36-37.
3 Ohmori K,Collins J,Fukushima T.Craniopharyngiomas in children[J].Pediatr Neurosurg,2007;43(4):265-278.
4 Vinchon M,Dhellemmes P.Craniopharyngiomas in children:recurrence,reoperation and outcome[J].Childs Nerv Syst,2008;24(2):211-217.
5 黄广龙,漆松涛,李 佳 et al.核转录因子NF-κB在颅咽管瘤炎症中的表达[J].中国神经精神疾病杂志,2010;36(1):39-42.
6 袁玉会,于宏伟,刘云会.白细胞介素6在人脑胶质细胞瘤的表达[J].中国神经精神疾病杂志,2007;33(3):145-158.
7 Shi X,Hong T,Walter K L et al.ING2 PHD domain links histone H3 lysine 4 methylation to active gene repression[J].Nature,2006;442(7098):96-99.
8 Jantaratnotai N,Choi H B,McLarnon JG et al.ATPstimulates chemokine production via a store-operated calcium entry pathway in C6 glioma cells[J].BMC Cancer,2009;9(12):442-451.
9 魏 伟,刘 兵,张建宁et al.颅咽管瘤显微手术中下丘脑功能损害的防治[J].天津医科大学学报,2008;14(3):376-378.
10 漆松涛,潘 军,方陆雄et al.颅咽管瘤的显微手术治疗及随访[J].中华神经外科杂志,2007;23(4):246-249.
11 Allen C,Duffy S,Teknos T et al.Nuclear factor-kappaB-related serum factors as longitudinal biomarkers of response and survival in advanced oropharyngeal carcinoma[J].Clin Cancer Res,2007;13(11):3182-3190.