TLR4信号转导通路与癫痫的研究进展①
2012-07-30欧阳龙强综述梁日生杨卫忠审校福建医科大学附属协和医院神经外科研究所福州350001
欧阳龙强 综述 梁日生 杨卫忠 审校 (福建医科大学附属协和医院神经外科研究所,福州350001)
癫痫(Epilepsy,EP)是一组由大脑神经元异常放电所引起的以短暂性中枢神经系统(CNS)功能失常为特征的慢性脑部疾病。海马是中枢神经系统内对癫痫最敏感的脑区之一,癫痫发作可引起海马特定区域(如 CA1、CA3)神经细胞凋亡或坏死[1],引起学习、记忆和认知损害,给病人的生活和工作造成极大影响。我国的癫痫患者约有900万,其中约75% ~80%可用药物控制症状。但仍有20%~25%的患者无法用药物控制发作而成为难治性癫痫。临床上治疗癫痫的药物疗效并不满意,这说明需进一步研究癫痫的发病机制及治疗机理,为临床治疗提供新的思路和手段。免疫炎症反应在癫痫发生与进程中起重要作用。研究显示即使没有感染存在,受损或应激状态细胞发出的信号也能引发免疫反应[2]。Toll样受体4(Toll-like receptor 4,TLR4)是一个重要的天然免疫受体,它不仅能介导脂多糖等外源性配体引起炎症反应,还能介导受损或应激产生的内源性配体引发炎症反应。TLR4介导的信号通路能识别内源性配体参与癫痫所致炎症反应,其具体作用机制尚不完全清楚。
1 TLR家族及其功能
1.1 Toll样受体及其配体 Toll样受体(Toll-like receptors,TLRs)最早由 Medzhitov 等[3]1997 年在果蝇体内发现,因其胞外段与一种果蝇蛋白Toll同源而命名为Toll样受体,至今已发现11种人TLRs和13种小鼠TLRs[4],它们是宿主细胞识别各种微生物致病源的天然受体。
TLRs是一类跨膜模式识别受体(Pattern recognition receptors,PRRs)受体,分胞外、胞膜和胞内三部分。其胞外区是富含亮氨酸重复序列(LRR)的功能区,可通过识别不同的病原体相关分子模式(Pathogen associated molecular pattern,PAMP)引发机体固有免疫应答。胞内段结构类似IL-1受体,故称为Toll/IL-1同源结构域(TIR),是一种高度进化保守的结构域,它介导细胞应答的信号启动。TLRs主要表达于单核细胞、树突状细胞和巨噬细胞等免疫细胞。根据TLRs在细胞表达部位的不同分为两类,一类是存在于细胞膜上的 TLRl、2、4、5、6、10,其配体主要为细菌产物,其中TLR2常与TLRl或TLR6形成二聚体,识别革兰阳性菌的脂蛋白、肽聚糖和脂肽以及支原体的脂肽和真菌的酵母多糖[5,6]。TLR4则常协同MD-2和CD14识别革兰阴性菌细胞壁上的脂多糖(LPS),TLR5主要识别细菌的鞭毛蛋白分子[6]。另一类是 TLR3、7、8、9,主要表达于细胞内,其主要识别病毒和细菌核酸。其中TLR3识别病毒双链RNA(dsRNA)。TLR7和TLR8识别病毒分子中的单链RNA(ssRNA),TLR9则对细菌和某些病毒的DNA上非甲基化的CPG基序起识别作用[6,7]。
TLRs除了识别上述介绍的外源性配体外,Matzinger[8]的“危险模式”理论提出体内还可出现“内源性危险信号”,这些危险信号主要是机体细胞损伤时产生的热休克蛋白、抗菌素/防御素、氧自由基、胞外基质降解产物、神经介质、细胞因子、DNA和RNA等物质,这些危险信号主要来自损伤变性、坏死或者凋亡的细胞,它们已被证明可以作为TLR的配体,激活TLR信号通路从而引起炎症反应。即使没有感染存在,受损及应激状态细胞发出的信号也可以引发免疫应答,能识别内源性“危险信号”目前已知的有 TLR2、TLR3、TLR4 和 TLR9。
1.2 Toll样受体的功能 TLRs主要通过受体胞外段的TIR结构域与病原体的PAMP或“内源性危险信号”相结合,激活细胞内信号传导通路,最终由进入胞核内的活化NF-κB启动核内相关基因表达,促使 IL-1、IL-6、IL-8、IL-12、TNF-α 及 IFN-γ 等细胞因子合成与释放,引起免疫细胞的激活并产生炎症反应。此外,TLRs还具有促进免疫细胞膜表达相关免疫分子以及促进免疫细胞的成熟和活化等功能[9,10]。
2 TLR4
2.1 TLR4与MyD88的结构 TLR4作为细胞表面的模式识别受体,具有TLRs家族的结构特征。它通过协同CD14和MD-2识别细菌脂多糖(LPS)、鞭毛蛋白、表面活性蛋白A等外源性配体,也可以识别内源性配体,如热休克蛋白 (HSPs)、HMGB1[11,12]。TLR4介导的炎症反应通过激活基因转录编码炎症介质的释放产生[11]。MyD88(Myeloid differentiation factor 88,MyD88)本质是一种胞质可溶性蛋白,具有两个特殊的结构域,即N端特有的死亡结构域(Death domain,DD)和 C 端保守的 TIR 结构域[13]。N端的DD约有90个氨基酸组成,负责募集下游的含有DD的信号分子进入下游信号转导。C端的TIR域约有130个氨基酸组成,负责承接TLRs活化信号[6]。MyD88功能缺陷可导致信号传导中断。TLR4与相应配体结合后介导MyD88依赖和非依赖两条信号转导通路。
2.2 TLR4信号转导通路
2.2.1 TLR4介导的MyD88依赖信号通路 TLR4被LPS与内源性配体(如 HMGB1)激活后,通过TIR-TIR结构域募集MyD88样接头蛋白MAL(MyD88 adaptor-like protein,MAL)和 MyD88,MyD88通过其DD与IRAK(IL-1 receptor-associated kinase,IRAK)家族蛋白分子结合成为信号转导复合物。激活的IRAK4、IRAK1、IRAK2磷酸化而脱离MyD88/IRAK 复合体[14,15],与 TRAF6(TNF receptor-associated factor 6,TRAF6)结合,TRAF6再依赖泛素激活TAK1(Transforming growth factorβ ~activated kinase,TAK1)复合体,活化的TAK1激活IKKα/IKKβ复合体,后者使核因子 NF-κB的抑制物 IκB(Inhihitory KappaB,IκB)磷酸化之后,再泛素化降解。游离的NF-κB进入细胞核发挥转录调控作用,激活IL-1、IL-6、IL-8、IL-12、TNF-α、及 IFN-γ 等细胞因子的基因表达。同时,TAK1还可激活MAPK家族复合体,后者使AP-1活化后进入细胞核启动基因表达[6,13-15](如图1)。
2.2.2 TLR4介导的 MyD88非依赖信号通路
TLR4通过激活 TRAM(TRIF-related adaptor molecule,TRAM)与 TRIF(TIR domain containing adaptorinducing IFN-β,TIRF)结合。活化后的 TRIF募集IKKi/TBK1 复合体(复合体由 IKKi、TBK1、NAP1、TANK和两个IRF3组成),并使IRF3磷酸化进入细胞核调控 IFN ~ β 的合成[16,17]。同时,TRIF 还可结合受体作用蛋白(receptor inieraeting protein 1,RIp1)激活TRAF6和 FADD(FAS-associated death domain,FADD),从而诱导MAPK和NF-κB晚期的活化以及细胞凋亡[6,13](如图 1)。
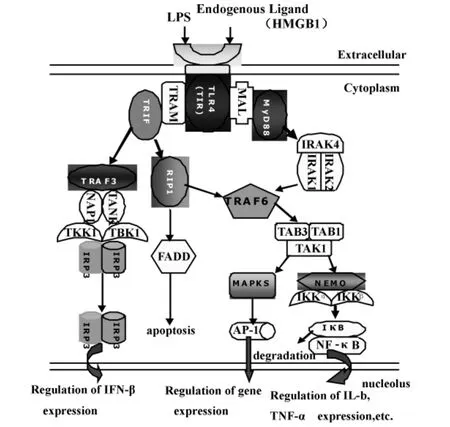
图1 TLR4信号转导通路Fig.1 TLR4 signalling pathways
3 癫痫与免疫炎症反应
3.1 癫痫引发免疫炎症反应 研究显示,癫痫发作后可激活神经细胞、神经胶质细胞以及大量炎症介质的释放,包括白细胞介素类(ILs)、干扰素类(IFNs)、肿瘤坏死因子类(TNFs),从而引发炎症反应[18]。Ravizza 等[19]在颞叶癫痫患者手术切除的海马中检测到激活的小胶质细胞、星型细胞以及IL-1b、IL-6、TNF-α等炎性指标,而在正常对照组的标本中未发现。Ferriero等[20]在海人酸诱导动物癫痫持续状态24小时后可检测到小胶质细胞和星型胶质细胞的大量活化和炎症因子的大量产生。Vezzani[21]对癫痫动物模型脑组织进行免疫组化发现,IL-1b、IL-6、TNF-α以及一些细胞因子受体最先在小胶质细胞、星型胶质细胞中表达,随后出现环加氧酶-2(COX-2)、前列腺素、补体系统等的表达上调。小胶质细胞被认为是脑内的“巨噬细胞”,在固有免疫反应过程中发挥着重要的作用[22],活化的小胶质细胞分泌、释放 IL-1b、IL-6、TNF-α、iNOS、COX-2 等促炎因子以及自由基ROS、RNS,并通过N-甲基D天冬氨酸受体信号传导通路抑制神经元的呼吸链,使神经元中ATP急剧减少最终因能量衰竭而死亡,这种损伤又反馈促进癫痫的发作及增加其敏感度和持续时间。小胶质细胞释放的促炎症因子如IL-1b、IL-6、TNF-α还可活化星型胶质细胞表达COX-2、INOS,产生氧自由基,释放促炎症细胞因子及一些神经营养因子(NGF)参与炎症反应。炎性细胞因子与TLRs在诱导先天性和获得性免疫反应中起关键作用[21]。TLRs能识别损伤或应激所致的“内源性危险信号”作为配体,激活信号通路引起炎症反应[8]。癫痫可以通过“内源性危险信号”激活TLRs,最终活化核因子-κB(Nudear factor kappaB,NF-κB),促使 IL-1、IL-6、TNF-α、COX-2、INOS 等细胞因子合成与释放。
3.2 免疫炎症反应参与癫痫的发生与发展 大脑内的免疫炎性反应可能是构成癫痫发作与发展进程中的最重要机制之一[21,23,24]。炎症反应不仅是癫痫的一个结果,还可能是癫痫发作的原因之一[18]。研究显示[21]神经免疫炎性反应不仅增加神经元兴奋性、诱导神经细胞凋亡,还可破坏血-脑屏障,使外周免疫细胞与炎性物质浸入到大脑,在高炎症因子和高兴奋性的病理情况下,谷氨酸摄取受抑制,神经生长因子可引起轴突出芽,异常突触形成,苔藓纤维出芽及海马硬化,形成颞叶癫痫样病理变化,导致癫痫形成。Friedman等[24]均报道免疫炎症介质是介导癫痫发作和发展普遍的、重要的机制之一。目前虽然存在 IL-1b、IL-6、TNF-a、TLRs、前列腺素 E2(PGE2)以及补体系统对癫痫发作的产生和加重的证据,但其作用机制尚不清楚[25]。
4 TLR4信号转导通路与癫痫
癫痫发作时,TLR4在神经细胞、星形胶质细胞、小胶质细胞中出现异常表达。Kleen等[11]发现TLR4在组织受损和应激时被激活,加剧癫痫的发作。其主要着火点是HMGB1(High-mobility group box-1 HMGB1,)—— 一种染色质成分,由病变或死亡的细胞释放[12,23]。Maroso 等[12]在海人酸或荷包牡丹碱诱导的小鼠癫痫模型中观察到,HMGB1与TLR4在海马的神经细胞、星型胶质细胞、小胶质细胞高度表达。随后出现癫痫的大幅度增强。应用HMGB1和TLR4拮抗剂后癫痫发作下降。TLR4缺陷的C3H/HJ型小鼠具有抵抗癫痫发作的功能[11,12]。Friedman 等[24]报道 TLR4、IL-1β、TNF-α在癫痫的产生和发展中发挥了重要作用,在某种程度上干预TLR4信号通路等免疫反应能成功预防癫痫发作。由此可见,脑组织中的神经细胞、星型胶质细胞、小胶质细胞表达的TLR4作为重要的炎性受体介导癫痫炎性损伤,并参与癫痫的产生和发展。癫痫发作可激活TLR4和炎性因子,活化后的TLR4、炎症因子又参与癫痫的产生和发展,炎症因子可通过TLR4信号通路介导的产生,三者之间形成一个循环通路。因此更深入地了解TLR4及其配体、相关蛋白的相互作用,将有助于开发调节TLR4信号通路的激动剂或拮抗剂,对于癫痫脑损伤的研究提供新的靶点和治疗措施。
5 研究意义与展望
癫痫的发生机制复杂,其病理生理机制还不完全清楚,免疫炎症反应是癫痫的重要损伤机制之一。TLR4及其信号途径是连接天然免疫和获得性免疫重要桥梁之一。虽然癫痫与TLR4信号通路之间的关系还处于研究的初级阶段,但对TLR4及其信号通路的深入了解将有助于我们进一步了解非病原微生物性炎症机制及其分子基础。从而更深刻的弄清癫痫的发病因素及其病理生理过程。为今后新的抗癫痫药物研制等方面提供新的切入点,并为临床治疗开辟更加广泛的途径。
1 Sutula T P,Hagen J,Pitkanen A.Do epileptic seizures damge the brain?[J].Curr Opin Neurol,2003;16(2):189-195.
2 Song Y S,Lee Y S,Chan P H.Oxidative stress transiently decreases the IKKcom(IKKalpha,beta,and gamma),an upstream component of NF-KappaB signaling,after transient focal cerebral ischemia in mice[J].J Cereb Blood Flow Metab,2005;25(10):1301-13011.
3 Medzhitov R,Preston-Hurlburt P,Janeway CA Jr.A human homologne of the Drosophila Toll protein signals activation of adaptive immtmity[J].Nature,1997;24:388(6640):394-397.
4 Rehli M.Of mice and men:species variations of Toll-like receptor expression[J].Trends Immunol,2002;23(8):375-378.
5 Triamafilou M,Garaper F G,Haston R M et al.Membrane sorting of toll-like receptor(TLR)-2/6 and TLR2/1 heterodimers at the cell surface determines heterotypic associations with CD36 and intracellu-Iar targeting[J].J Biol Chem,2006;281(41):31002-31011.
6 O'Neill L A,Bowie A G.The family of five:TIR-domain-containing adaptors in Toll-like receptor signaling[J].Nat Rev Immunol,2007;7(5):353-364.
7 Sandor F,Buc M.Toll-like receptors.II.Distribution and pathways involved in TLR signaling[J].Folia Biol(Praha),2005;51(6):188-197.
8 Matzinger P.The danger model:a renewed sense of self[J].Science,2002;12:296(5566):301-305.
9 Mishra B B,Mishra P K,Teale J M.Expression and distribution of Toll-like receptors in the brain during murine neurocysticercosis[J].JNeuroimmu,2006;181(1-2):46-56.
10 van Kooyk Y,Geijtenbeek T B.Toll-like Receptors keep aneigen sorting on the right track [J].Immunity,2006;27(4):525-527.
11 Kleen J K,Holmes G L.Taming TLR4 may ease seizures[J].Nat Med,2010;16(4):369-370.
12 Maroso M,Balosso S,Ravizza T et al.Toll-like receptor 4 and highmobility group box-1 are involved in ictogenesis and can be targeted to reduce seizures[J].Nat Med,2010;16(4):413-419.
13 Ulrichts P,Tavernier J.MAPPIT analysis of early Toll-like receptor signalling events[J].Immunol Lett,2008;116(2):141-148.
14 McGettrick A F,O'Neill L A.Regulators of TLR4 signaling by endotoxins[J].Subcell Biochem,2010;53:153-171.
15 An H,Qian C,Cao X.Regulation of Toll-like receptor signaling in the innateimmunity[J].Sci China Life Sci,2010;53(1):34-43.
16 Buchanan M M,Hutchinson M,Watkins L R et al.Toll-like receptor 4 in CNSpathologies[J].J Neurochem,2010;114(1):13-27.
17 Yang Q W,Xiang J,Zhou Y et al.Targeting HMGB1/TLR4 signaling as a novel approach to treatment of cerebral ischemia[J].Front Biosci(Schol Ed),2010;2:1081-1091.
18 Vezzani A,French J,Bartfai T et al.The role of inflammation in epilepsy[J].Nat Rev Neurol,2011;7(1):31-40.
19 Ravizza T,Gagliardi B,NoéF et al.Innate and adaptive immunity during epileptogenesis and spontaneous seizures:evidence from experimental models and human temporal lobe epilepsy[J].Neurobiol Dis,2008;29(1):142-160.
20 Ferriero D M.Protecting neurons[J].Epilepsia.2005;46 Suppl 7:45-51.
21 Vezzani A,Granata T.Brain inflammation in epilepsy:experimental and clinical evidence[J].Epilepsia,2005;46(11):1724-1743.
22 Aloisi F.Immune function of microglia[J].Glia,2001;36(2):165-179.
23 Vezzani A,Maroso M,Balosso S et al.IL-1 receptor/Toll-like receptor signaling in infection,inflammation,stress and neurodegeneration couples hyperexcitability and seizures[J].Brain Behav Immun,2011;25(7):1281-1289.
24 Friedman A,Dingledine R.Molecular cascades that mediate the influence of inflammation on epilepsy[J].Epilepsia,2011;52(Suppl 3):33-39.
25 Xiong Z Q,Qian W,Suzuki K et al.Formation of complement membrane attack complex in mammalian cerebral cortex evokes seizures and neurodegeneration [J].Neurosci,2003;23(3):955-960.