annexinA2基因片段的克隆、表达、纯化及多克隆抗体的制备①
2012-07-30聂纪芹汪龚泽刘朝奇三峡大学分子生物学研究所宜昌443002
聂纪芹 汪龚泽 刘朝奇 (三峡大学分子生物学研究所,宜昌443002)
膜联蛋白A2(annexinA2)是广泛表达在多细胞生物体内的膜联蛋白多基因家族的成员之一,广泛存在于多种类型细胞中,包括骨髓细胞、神经细胞、白细胞、单核细胞-巨噬细胞和内皮细胞等[1]。它具有多种生理功能,如在生物膜结构域的建立或稳定、细胞增殖与分化、细胞膜骨架联结、胞膜物质运输、细胞间粘附、粘合素介导的细胞信号转导、抗炎及凝血等功能[2,3]。
实验证明,annexinA2与人类许多疾病的发生发展显著相关,尤其是其在心血管、肿瘤疾病及病毒感染中的作用机制的研究成为当前的研究热点[4-8]。有研究显示大多数肿瘤,包括乳腺癌、肺癌、结肠癌及恶性血液病中都观察到annexinA2过表达现象[9,10]。annexinA2 在肿瘤血管生成和浸润转移中发挥重要作用,具有促进恶性肿瘤细胞增殖的特性[11]。为了研究annexinA2的功能,本实验利用基因工程方法表达并纯化截短的annexinA2蛋白,制备其多克隆抗体,并初步鉴定其生物学活性,为进一步研究annexinA2蛋白的生物学活性提供实验基础。
1 材料与方法
1.1 材料 菌株 E.coli DH5、E.coli BL21(DE3)、质粒pET28a(+)以及宫颈癌CaSKi细胞株系由本研究所保存。限制性核酸内切酶、TaqDNA聚合酶、T4 DNA连接酶均为Fermentas公司产品;鼠源His单克隆抗体(mAb)、HRP标记的羊抗小鼠IgG、HRP标记的羊抗兔IgG、罗丹明标记的羊抗兔IgG均购自北京中杉金桥生物技术有限公司。FITC标记的羊抗兔IgG购自湖北金茂生物技术有限公司。RPMI1640、胎牛血清购于Invitrogen公司。TMB购自eBioscience公司。弗氏佐剂购于Sigma公司。其他化学试剂由Sigma等公司提供。日本大耳朵白兔(6月龄,体质量2千克,雄性)购于湖北省实验动物中心(普通级,质量合格证号00002964)。流式细胞仪由Beck-man Coulter公司提供。
1.2 方法
1.2.1 pET28a(+)-annexinA2 重组表达质粒的构建与鉴定 以人宫颈癌CaSki细胞系的cDNA为模板,扩增 annexinA2基因。上游引物:5'-GTGACCGACGAGGACTCTCTC-3'(划线处为限制性核酸内切酶NcoⅠ酶切位点);下游引物:5'-GTGAGTCATCTCCACCACACAGGTA-3'(划线处为限制性核酸内切酶XhoⅠ酶切位点)。扩增条件为:94℃ 3分钟;94℃ 30秒;55℃ 30秒;72℃ 45秒;30个循环;72℃ 5分钟。用XhoⅠ和NcoⅠ分别双酶切annexinA2 PCR产物和pET28a(+)原核表达载体。T4连接酶连接后,将连接产物转入大肠埃希菌DH5a中培养,挑取单克隆进行酶切及测序鉴定。
1.2.2 annexinA2蛋白的原核表达 将构建好的重组质粒pET28a(+)-annexinA2转化至宿主 BL21(DE3)中,30℃经1 mmol/L IPTG诱导表达过夜,收集细菌进行SDS-PAGE电泳,采用考马斯亮蓝R-250染色初步检测目的蛋白表达。同时,收集细菌进行SDS-PAGE蛋白电泳,转膜,室温封闭2小时,以抗His-Tag鼠源单克隆抗(1∶5 000)为一抗,室温孵育2小时,TBST洗涤3次,加入HRP标记的羊抗小鼠IgG(1∶5 000)室温反应50分钟,ECL显影。
1.2.3 annexinA2蛋白的纯化 重组质粒 pET28a(+)-annexinA2的阳性菌落经IPTG诱导大量表达,离心收集菌体,重悬于PBS中(NaCl 137 mmol/L,KH2PO42 mmol/L,Na2HPO410 mmol/L,KCl 2.7 mmol/L),4℃超声波破碎,离心得到包涵体。上样缓冲液溶解包涵体后,沸水煮5分钟,SDS-PAGE电泳。SDS-PAGE胶用冰冷的0.25 mol/L KCl染色5~10分钟,切下目的蛋白碾碎,加等体积的PBS,4℃放置过夜,低温离心取上清,上清即为回收纯化的目的蛋白。将蛋白用含5%的甘油的PBS透析48小时,中间换液4~6次,即得到纯化的目的蛋白。纯化蛋白的抗原性分析:以His单抗(1∶5 000稀释)为一抗,HRP标记的山羊抗小鼠IgG抗体(1∶5 000稀释)为二抗,对纯化产物进行Western blot鉴定。
1.2.4 annexinA2蛋白多克隆抗体的制备 将纯化的annexinA2蛋白与等体积弗氏完全佐剂混匀并充分乳化后,于兔脊柱两侧多点皮内注射,首次免疫剂量为500μg/只,首次免疫后2周,改为弗氏不完全佐剂混合,并进行第2次加强免疫,10天后第3次免疫,免疫剂量为100μg/只。第3次免疫1周后,颈动脉取血,分离兔血清,采用ELISA,流式和免疫荧光法测定抗体生物学活性。
1.2.5 抗体效价的测定 采用ELISA法,以纯化的重组annexinA2蛋白(1μg/孔)作为包被抗原,一抗为兔抗血清(1∶10 000~1∶640 000),二抗为HRP 标记的羊抗兔IgG,工作浓度为1∶3 000。TMB显色,用全波长酶标仪在λ=450 nm处测定光密度(A450)值。
1.2.6 流式法测定annexinA2抗体特异性 CaSki细胞以2×108L-1浓度接种至细胞培养瓶,置37℃50 ml/L CO2培养箱中培养过夜。2 mmol/L的胰蛋白酶消化对数生长期的CaSki细胞,制备活性高的细胞悬液。PBS洗1次,用PBS调整细胞密度为1×109L-1,每管100μl细胞悬液,平均分成多管,加入兔抗血清(1∶800),以加入正常兔血清作为阴性对照,室温作用30分钟;PBS洗3次,加入FITC标记的羊抗兔IgG,室温避光反应30分钟,PBS洗1次,加入0.5 ml PBS缓冲液重悬细胞,上机检测,记录、保存并软件分析结果。
1.2.7 细胞免疫荧光法测定annexinA2抗体的特异性 CaSki细胞系用RPMI1640培养基常规培养。细胞以1×108L-1接种于细胞培养瓶,待细胞长满后,将细胞传入放有无菌玻片的24孔板中,培养48小时后取出细胞玻片;用冰冷的PBS洗3次,用10 g/L多聚甲醛4℃固定15~20分钟;PBS洗3次,用150 ml/L的山羊血清室温封闭1小时;PBS洗3次,滴加适当稀释倍数的上述兔抗血清,37℃孵育1小时;PBS洗3次,用罗丹明标记的羊抗兔IgG 37℃孵育1小时;PBS洗3次,加入DAPI(5 g/L)室温染核3~5分钟,PBS洗3次后,荧光显微镜观察、拍照。
2 结果
2.1 重组质粒的构建及鉴定 以人的宫颈癌CaSki细胞的cDNA为模板,设计引物,通过PCR的方法获得截短annexinA2的基因片段,通过琼脂糖凝胶电泳获得预期约648 bp的片段(图1A),将获得的阳性质粒经双酶切鉴定后,得到预期大小的片段(图1B)。阳性质粒的测序结果与GenBank报告的基因序列完全相符,表明获得了正确的annexinA2基因序列。
2.2 重组质粒的表达、鉴定与纯化 重组质粒pET28a(+)-annexinA2转化到蛋白表达菌 BL21中,经IPTG诱导表达,进行SDS-PAGE电泳,结果显示重组质粒可在 BL21中高表达,约28 kD处出现目的蛋白条带(图2A)。通过切胶回收的方法纯化大量诱导表达的annexinA2蛋白,用His单抗作为抗体鉴定重组蛋白,结果显示在约28 kD处出现特异性条带,与预期结果一致(图2B)。
2.3 兔血清多克隆抗体制备及检测 将纯化的等体积重组蛋白加入佐剂免疫日本大耳白兔后,获得了annexinA2的兔抗血清,以正常兔血清作为阴性对照(100倍稀释OD值为0.055),通过 ELISA检测,检测结果显示annexinA2抗体滴度可达105,并具有良好的量效关系(R2=0.942),见图3。
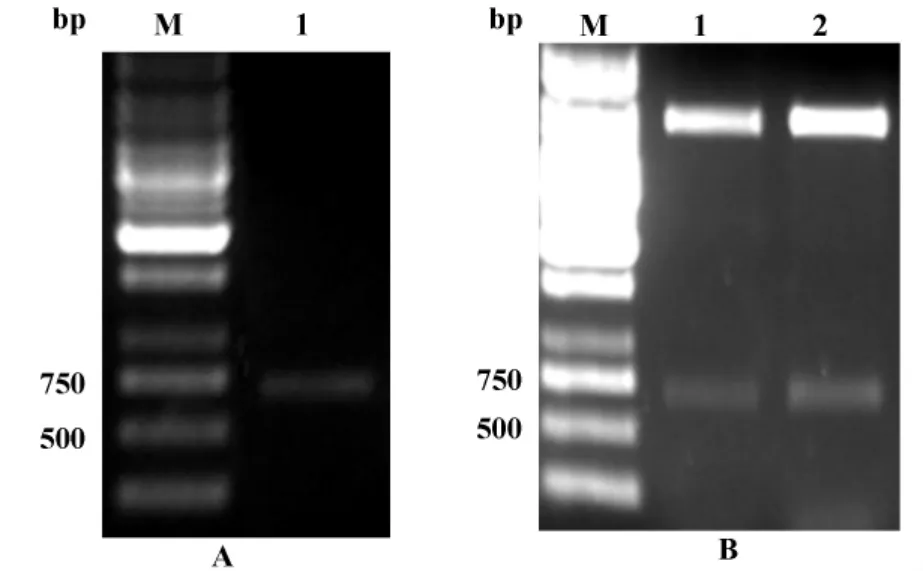
图1 annexinA2基因片段的PCR产物和重组质粒的酶切鉴定Fig.1 annexinA2 PCR product and restriction fregment of recombine plasmid
2.4 FCM测定annexinA2抗体的结合活性 流式细胞术(FCM)检测annexinA2抗体与人宫颈癌CaS-ki细胞内源性annexinA2蛋白的结合活性,正常兔血清为阴性对照,得到的阳性细胞百分率为1.76%,加入兔抗血清的阳性细胞百分率为74.9%。由图可见,annexinA2抗体可与CaSki细胞内源性annexinA2蛋白结合(图4)。
2.5 细胞免疫荧光法测定annexinA2抗体的结合活性 将培养的人的宫颈癌CaSki细胞表达内源性annexinA2蛋白作为抗原,应用细胞免疫荧光染色检测annexinA2抗体的特异性。以正常兔血清为阴性对照,加入待测兔抗血清,用罗丹明标记的羊抗兔IgG为二抗进行染色,显微镜下观察annexinA2抗体在CaSki细胞中的结合情况(图5)。免疫荧光结果表明annexinA2抗体主要定位于细胞浆中,同型对照为阴性。
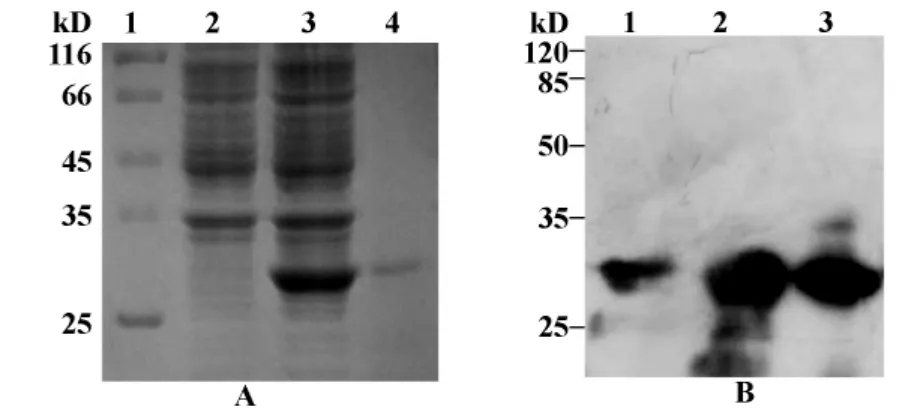
图2 SDS-PAGE和Western blot分析原核表达及纯化的annexinA2重组蛋白Fig.2 Analysis of expression and purification of annexinA2 recombinant protein by SDS-PAGE and Western blot
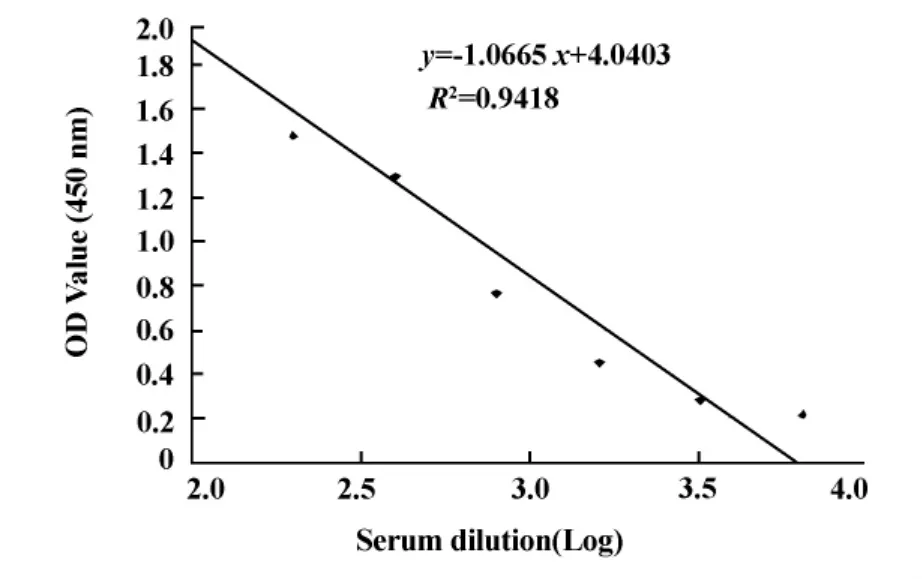
图3 annexinA2兔抗血清的ELISA检测Fig.3 annexinA2 polyclonal antibody detection by ELISA
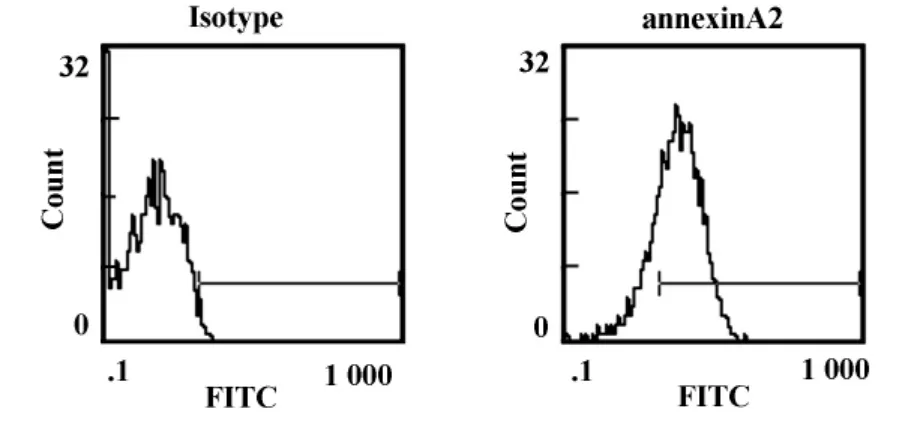
图4 FCM测定annexinA2抗体的结合活性Fig.4 annexinA2 polyclonal antibody detection by FCM
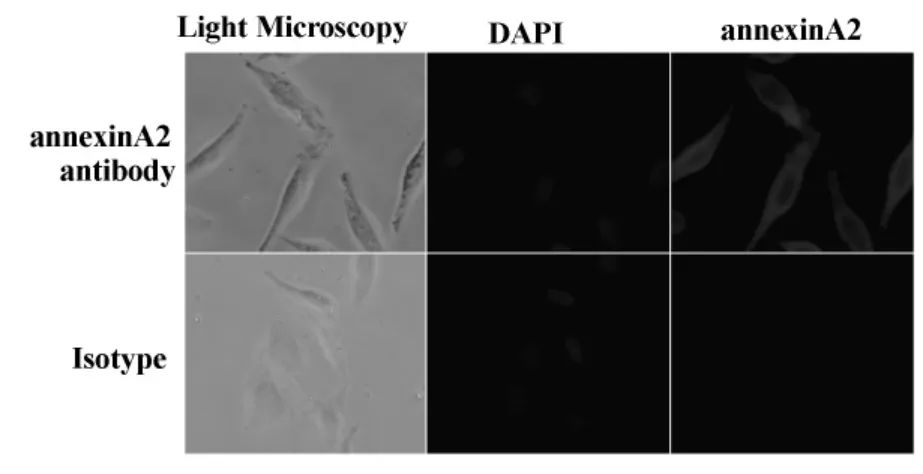
图5 细胞免疫荧光法测定annexinA2抗体的特异性结合活性Fig.5 annexinA2 polyclonal antibody detection by CIF
3 讨论
annexinA2最早在Rous肉瘤病毒转化的鸡胚胎成纤维细胞中被发现。对其早期研究主要集中在参与炎症机制的研究,如对蛋白激酶C和磷脂酶A2的抑制作用及参与细胞粘附、胞吐等。近年来发现其在肿瘤的发生发展过程中可能发挥重要作用[12]。实验表明,annexinA2蛋白高表达与肿瘤侵袭和转移具有密切关系。在许多人类肿瘤中都发现纤溶酶过表达,纤溶酶降解细胞外基质的活性增高,有利于血管再生和细胞迁移,并且与annexinA2的表达量一致。在乳腺癌研究中,annexinA2在侵袭性乳腺癌的细胞株MDA-BM231中表达,而弱侵袭性细胞株MCF-7中不表达,而且annexinA2单抗可以阻断纤溶蛋白酶依赖的肿瘤细胞侵袭和转移[13]。
本实验克隆了人annexinA2的基因片段,构建pET28a(+)-annexinA2的原核表达质粒。该质粒在BL21(DE3)细菌中可高效表达相对分子质量约28 kD的重组蛋白。纯化的目的蛋白免疫日本大耳白兔制备特异性多克隆抗体。经ELISA、流式和免疫荧光法验证抗体对细胞表达的抗原具有特异而高效的结合能力。该蛋白及抗体的成功制备,为进一步研究annexinA2的生物学活性及进一步寻找与annexinA2有关的肿瘤及病毒感染疾病的治疗药物提供了实验基础。
1 Claire Hastie,John R Masters,Stephen E Moss et al.Interferon reduces cell surface expression of Annexin 2 and suppresses the invasive capacity of prostate cancer cells[J].Biological Chemistry,2008;283(18):1259-1265.
2 Ursula Rescher,Volker Gerke.Annexins-unique membrane binding proteins with diverse functions[J].Cell Science,2004;117(13):2631-2639.
3 Luo W,Yan G,Li L et al.Epstein-Barr virus latent membrane protein 1 mediates serine25 phosphorylation and nuclear entry of Annexin A2 via PI-PLC-PKCα/PKCβ pathway[J].Mol Carcinog,2008;47(12):934-946.
4 Matthew J Hayes,Stephen E Moss.Annexins and Disease[J].Biochemical and Biophysical Research Communications,2004;322:1166-1170.
5 Shi Z X,Sun J F,Guo H C et al.Genomic expression profiling of peripheral blood leukocytes of pigs infected with highly virulent classic swine fever virus strain Shimen[J].J Gen Virol,2009;90(7):1670-1680.
6 Jiang Y,Shi Z,Yan Y et al.Proteomic alteration of 592 PK-15 cells after infecton by classical swin fever virus[J].JProteome Res,2008;7(12):5263-5269.
7 Shaw M L,Stone K L,Colangelo CM et al.Cellular proteins in influenza virus particles[J].PLOSPathog,2008;4(6):e1000085.
8 Fanny L,Eri M,Guus F R et al.AnnexinⅡ inorporated into influenza virus particles supports virus replication by converting plasminogen into plasmin[J].JVirol,2008;82(14):6820-6828.
9 赵 玲,崔全才.Annexin A2在肿瘤发生中的作用研究进展[J].中华病理学杂志,2007;36(2):129-132.
10 萧 笑,王 元,张思河.钙依赖性磷脂结合蛋白AnnexinⅡ的研究进展[J].第四军医大学学报,2007;28(6):570-573.
11 Barwe SP,Anilkumar G,Moon S Y et al.Novel role for Na,K-ATPase in phosphatidylinositol 3-kinase signaling and suppression of cell motility[J].Mol Biol Cell,2005;16(3):1082-1094.
12 赵丽萍,陆晓媛.Annexin A2、Bcl-2在宫颈癌中的表达及意义[J].徐州医学院学报,2010;30(8):507-510.
13 Sharma M,Ownbey R T,Sharma M C.Breast cancer cell surface annexinⅡinduces cell migration and neoangiogenesis via tPA dependent plasmin generation[J].Exp Mol Pathol,2010;88(2):278-286.
