双特异性重组腺病毒Ad-HT对肝癌细胞的体内、外抑制效应①
2012-07-30刘广臣孙大辉齐延新王金辉王卓越朴秉国金宁一
刘广臣 孙大辉 齐延新 王金辉 王卓越 吴 娜 朴秉国 金宁一 李 霄
(吉林大学第一临床医院创伤骨科,长春130021)
自上个世纪50年代Caslary发现新城疫病毒(Newcastle disease virus,NDV)爆发流行使晚期胃癌患者的转移灶受到有效抑制以来,NDV的抗肿瘤作用开始被人们重视,相应的科研以及临床研究开始发展起来[1-3]。研究发现,NDV最主要的表面结构血凝素-神经氨酸酶(Hemagglutinin-neuramidinase,HN)可作为受体发挥类似于流感病毒的神经氨酸酶活性(Neuramidinase activity,NA)裂解唾液酸物质以暴露肿瘤细胞表面信号识别位点和表面抗原,HN基因还可诱导树突状细胞(Dendritic cell,DC)等外周血单核细胞(Peripheral blood monouclear cells,PBMC)释放大量 α 干扰素(Interferon-α,IFN-α),释放量比其他细胞高1 000倍左右,并具有如活化巨噬细胞、自然杀伤细胞和稳定活化T细胞的作用[4]。除此之外,目前已证实HN蛋白可作为糖蛋白在细胞膜表面形成独特的识别部位,通过激活机体免疫发挥对肿瘤细胞的杀伤功能。由此可见,HN基因在肿瘤基因治疗领域具有潜在的巨大的应用前景。本课题组利用人端粒酶反转录酶启动子(Human telomerase reverse transcriptase promoter,hTERTp)、人 2 型腺病毒复制必需基因E1a和HN基因制备了具有肿瘤特异性杀伤和肿瘤特异性复制功能的双特异抗肿瘤重组腺病毒Ad-HT,并针对人肺癌、人胃癌和人直肠癌等肿瘤细胞结合人胚肺、人肺肝等正常细胞证明了其特异性[5,6]。本研究旨在利用 Ad-HT探讨其对肝癌细胞的体内、外抑制作用。
1 材料与方法
1.1 材料 重组腺病毒 Ad-HT、Ad-HN、Ad-GT和Ad-EGFP由本室构建、鉴定并保存[7];人肝癌细胞BEL-7402和小鼠肝癌细胞H22由本室保存;噻唑兰(3-[4,5-dimethylthiazol-2-yl]-2,5-diphenyltetrazolium bromide,MTT)、吖啶橙(Acridine orange,AO)、溴化乙啶(Ethidium bromide,EB)、二脒基苯基吲哚(4,6-diamidino-2-phenylindole,DAPI)和罗丹明 123(rhodamine 123,Rho 123)和 2,7-二氯荧光素二乙酸乙酯(2,7-Dichloro Fluorescin Diacetate,DCFA)购自Sigma公司;RPMI1640细胞培养液和胎牛血清(Fetal bovine serum,FBS)购自 Invitrogen公司;蛋白提取试剂盒、BCA检测试剂盒、Annexin V检测试剂盒和Caspase检测试剂盒购自Beyotime公司;C57BL/6小鼠购自军事医学科学院实验动物中心;其它试剂均为国产分析纯。
1.2 MTT检测[8]于96孔细胞培养板内制备BEL-7402单层细胞(5×103),分别用 Ad-HT、Ad-HN、Ad-GT和 Ad-EGFP进行感染(设未感染对照孔),每种病毒采用3个感染复数(Multiplicity of infection,MOI)剂量(100 MOI、10 MOI和 1 MOI,每个剂量设3 个复孔)。分别于感染 12、24、36、48、60、72小时后加入20μl/孔 MTT(5 mg/ml),继续培养4小时后弃培养液并加入200μl/孔 DMSO,收集溶液并利用酶联免疫检测仪于490 nm波长检测吸光值(A)。并利用如下公式计算:细胞杀伤率=(对照孔A值—实验孔A值)/对照孔A值。
1.3 荧光检测[2]于6孔细胞培养板制备 BEL-7402单层细胞(1×106),分别用100 MOI的 Ad-HT、Ad-HN、Ad-GT和Ad-EGFP进行感染,继续培养48小时后收集细胞并重悬于磷酸盐缓冲液(Phosphate Buffered Saline,PBS)中,分别用 AO/EB 和DAPI进行染色,并于荧光显微镜下观察。
1.4 流式细胞检测[8]按1.3所述制备病毒感染细胞,培养48小时后收集细胞并重悬于PBS中,分别用 Annexin V-FITC/PI、Rho 123和DCFA进行染色,作用30分钟后用PBS洗涤3次,沉淀经200μl PBS重悬后用流式细胞仪分析。
1.5 Caspase酶检测 按1.3所述制备病毒感染细胞,培养48小时后收集细胞并提取总蛋白,利用BCA检测试剂盒进行蛋白定量后,按Caspase检测试剂盒说明书进行Caspase酶活性检测。
1.6 动物实验[8]用Hanks液洗涤并稀释H22细胞至1×107个/ml,于小鼠右后肢皮下注射0.1 ml,待肿瘤结节生长至直径为5 mm视为模型建立。将荷瘤小鼠随机分为5组(5只/组):第1组为生理盐水对照组,瘤内注射生理盐水(100μl/只),每周2次,为期3周;第2组至第5组分别为 Ad-HT、Ad-HN、Ad-GT和Ad-EGFP治疗组,瘤内注射相应病毒(109PFU/100μl/只),每周2次,为期3周。同时设正常小鼠对照组,不接受任何处置(未荷瘤,5只)。实验期间每日观察模型动物存活情况,数据录入Sigma plot软件,绘制生存曲线,另外,实验期间每2天用游标卡尺检测肿瘤长、短径长,通过公式:(短径长2×长径长×0.52),计算肿瘤体积。所有实验组模型动物于末次处置后10天处死,采集模型动物外周血并分离血清,按试剂盒说明书检测IL-2、IL-4、IL-10和IFN-γ含量;采集模型动物脾脏并分离T淋巴细胞,按试剂盒说明书检测细胞毒性T淋巴细胞(Cytotoxic T lymphocyte,CTL)和天然杀伤细胞(Nature killer cells,NK)活性。
1.7 统计学方法 学生氏t检验用于分析组间差异,Kaplan-Meier检验用于分析平均生存期。
2 结果
2.1 Ad-HT对BEL-7402细胞的抑制作用 如图1所示,Ad-HT、Ad-HN、Ad-GT和 Ad-EGFP均不同程度地表现出对BEL-7402的抑制作用,且呈现一定的剂效和时效关系趋势,即随感染剂量的增加和感染时间的延长,病毒对BEL-7402细胞的抑制作用随之增强。但Ad-HN和Ad-EGFP抑瘤作用的量效关系并不明显,时效关系也仅在高剂量组(100 MOI,48小时前)有所体现,而Ad-HT和Ad-GT的量效关系比较明显,且在各感染剂量均呈现一定的时效关系趋势。就抑瘤效果而言,Ad-HT优于Ad-GT、Ad-HN和 Ad-EGFP(P<0.05)。高剂量组(100 MOI)感染48小时后,Ad-HT对BEL-7402细胞的抑制率维持在65%以上,Ad-GT的抑制率在40% ~60%间波动。而Ad-HN和Ad-EGFP的抑制率则持续下降,其中以Ad-EGFP下降最为显著(P<0.05)。
2.2 Ad-HT对BEL-7402细胞形态的影响 如图2所示,经AO/EB染色,未感染细胞均呈现亮绿色,而Ad-HN、Ad-HT感染细胞则部分被染色呈现红色或橘红色,并伴有细胞皱缩等凋亡特征;经DAPI染色,未感染细胞的细胞核均呈现均匀一致的兰色,而Ad-HN、Ad-HT感染细胞的细胞核则呈现亮兰色,并伴有核内物质碎裂等凋亡特征。以上结果说明,Ad-HN、Ad-HT能够诱导BEL-7402细胞呈现典型凋亡形态。
2.3 Ad-HT对BEL-7402细胞膜及活性氧水平的影响 如图3所示,Annexin V检测结果显示,与对照组相比,Ad-HN、Ad-HT感染导致BEL-7402细胞磷脂膜外翻,说明 Ad-HN、Ad-HT感染能够诱导BEL-7402细胞凋亡。另外,Ad-HN、Ad-HT还导致BEL-7402细胞线粒体膜电位(Mitochondrial membrane potentials,△ψ)下降、活性氧(Reactive oxygen species,ROS)水平升高。其中,Ad-HT作用略强于Ad-HN。以上结果说明,Ad-HN和Ad-HT能够诱导BEL-7402细胞发生凋亡,且其作用与线粒体及活性氧密切相关。

图1 MTT检测结果Fig.1 The results of the MTT assay

图2 Ad-HT感染对BEL-7402细胞形态的影响Fig.2 Morphological change of Ad-HT-infected BEL-7402 cells

图3 Ad-HT对BEL-7402 Annexin V、△ψ和ROS的影响Fig.3 Effects of Ad-HT-infected on Annexin V,△ψ and ROS of BEL-7402 cells
2.4 Ad-HT感染对Caspase酶活性的影响 如图4所示,Ad-HN、Ad-HT均不同程度上调了Caspase 1、3、6、8酶的活性,其中以 Ad-HT的作用最为明显(P <0.05)。Ad-EGFP 对 Caspase 1、3、6、8 酶的活性无明显影响,而Ad-GT的作用却比较明显(P<0.05),几乎与Ad-HT相当,我们认为这可能与腺病毒感染导致细胞病变有关。
2.5 Ad-HT对体内实体肿瘤的抑制作用 如图5所示,虽然实验后期(24~30天),Ad-HN和Ad-HT实验组平均肿瘤体积小于其它实验组,但实验前期(0~24天)各实验组平均肿瘤体积差异并不明显,而且时常出现波动,这可能与模型动物死亡导致的平均肿瘤体积异常变化有关。然而,虽然Ad-HT减缓肿瘤生长速度的作用并不明显,但其对模型动物平均生存期却有明显改善作用,实验结束时,Ad-HT治疗模型动物生存率为100%,而生理盐水对照组、Ad-EGFP和Ad-GP治疗组模型动物在17~30天内相继死亡。
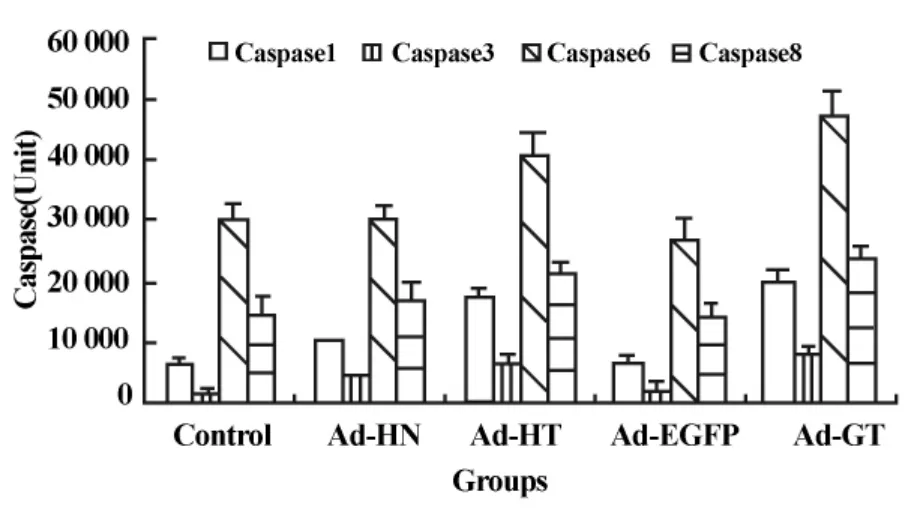
图4 Caspase含量比较Fig.4 The content comparison of Caspase

图5 模型动物肿瘤生长趋势和平均生存期Fig.5 The tumor growth kinetics and the mean survival of animal model
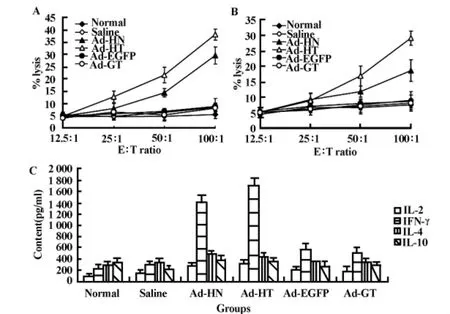
图6 模型动物免疫分析Fig.6 Analysis of immune of the animal model
2.6 Ad-HT对模型动物免疫的影响 如图6所示,与正常对照组、Ad-EGFP实验组和Ad-GT实验组相比,在效靶比为50∶1和100∶1时,Ad-HN和 Ad-HT能够有效增强模型动物CTL和NK活性,其中以Ad-HT作用最为明显(P<0.05)。另外,Ad-HN和Ad-HT实验组IL-2和IFN-γ等Th1类细胞因子含量明显高于其它实验组(P<0.05),而IL-4和IL-10含量差异并不明显。
3 讨论
肝癌是我国常见的恶性肿瘤之一,病人早期常无明显症状和体征,一旦出现典型的临床表现时已属于中晚期肝癌。其恶性度高、病情进展快、治疗难度大、疗效差、预后不好已成为其显著特点。为提高治疗的有效率、延长患者的生存期、降低患者的痛苦,人们一直在探索新的治疗方向,近年来,针对细胞受体、关键基因和调控分子为靶点的相关研究及试验性治疗渐渐走入人们的视线。Apoptin、Suvivin、端粒酶、NDV HN、腺病毒载体等已成为常见的研究对象。虽然其中一些基因与肿瘤间的作用机制还不完全清楚,但是通过多个靶点基因作用靶向性治疗肿瘤的研究已有报道[1,2,9]。针对肿瘤细胞开展多基因联合治疗,有效的、特异的抑制或杀伤肿瘤细胞已成为肿瘤基因治疗的一个重要发展趋势。
Fiola等[10]阐明了NDV在肿瘤细胞中选择性复制的机制。NDV的抗肿瘤作用现已被广泛认可,HN蛋白是NDV的主要结构蛋白,以N末端疏水区与病毒外膜相连,不仅能够介导受体识别,还具有水解这些受体中唾液酸成分的神经氨酸酶活性。以前的研究表明,HN蛋白在抗肿瘤免疫反应中发挥佐剂功能,具有活化DC、巨噬细胞、NK细胞,稳定活化的T细胞,刺激细胞产生IL-12受体的β链等作用[1-4]。HN所诱导产生的IFN-α还可以上调一些与抗原识别、细胞间作用、细胞粘附及细胞毒作用相关的重要分子[1,11,12]。
目前,腺病毒作为一种候选载体在动物实验和研究中已表现出良好的效果,腺病毒载体具有滴度高、感染范围广、DNA不整合到宿主染色体、可插入7~8 kb的外源DNA片段等优点,目前已成为基因治疗、基因功能研究、反义治疗、疫苗开发等领域最为常用的载体之一[13]。但重组腺病毒污染野生型病毒的问题一直没有得到很好的解决。本研究选用的重组腺病毒是采用RAPAdⅠ重组腺病毒系统构建的[14],该系统的基因组骨架质粒缺失了腺病毒复制和包装相关信号序列,并将上述序列置于穿梭质粒中,使得只有腺病毒基因组骨架质粒与穿梭质粒重组后,腺病毒才能够包装并增殖[13]。因此,应用RAPAdⅠ系统所构建的重组腺病毒Ad-HT理论上全部经过同源重组,这大大降低了野生型腺病毒污染的机会[13]。
本研究利用本课题组构建的重组腺病毒Ad-HT以及相关对照病毒 Ad-HN、Ad-EGFP和 Ad-GT,结合分子生物学检测方法,分析了Ad-HT对人肝癌细胞BEL-7402的抑制作用。结果显示,除Ad-EGFP外,Ad-HN、Ad-GP与 Ad-HT同样具有抑制 BEL-7402肿瘤细胞的作用,但Ad-HT的抑瘤效果明显强于其它对照病毒;Ad-HT在高感染剂量(100 MOI)的前提下呈现明显的时效关系趋势,而在低感染剂量(1 MOI和10 MOI)时,时效关系趋势不显著;另外,Ad-HT能够通过诱导细胞凋亡抑制BEL-7402肿瘤细胞增殖,而这种抑制作用可能通过影响BEL-7402细胞线粒体功能,促进其释放活性氧物质,进而激活凋亡相关Caspase酶实现。虽然Ad-HT对模型动物体内实体肿瘤体积的抑制作用并不十分显著,但却能有效延长其平均生存期,这可能与Ad-HT的免疫调节功能有关。
综上,重组腺病毒Ad-HT能够通过诱导人肝癌细胞BEL-7402凋亡抑制其生长。另外,Ad-HT对BEL-7402的凋亡诱导作用可能通过线粒体途径实现。同时,模型动物实验进一步证实了表达NDV HN基因抗肿瘤双特异性重组腺病毒Ad-HT对肿瘤细胞在免疫调节和免疫重建方面的显著作用。总之,随着对Ad-HT体内、外抑癌作用的不断深入研究,其将会显示出广泛的应用前景。
1 Mebatsion T,Koolen M J,de Vaan L T et al.Newcastle disease virus(NDV)marker vaccine:an immunodominant epitope on the nucleoprotein gene of NDV can be deleted or replaced by a foreign epitope[J].JVirol,2002;76(20):1038-1046.
2 Li X,Jin N,Lian H et al.Construction and anti-tumor effects of recombinant fowlpox virus expressing Newcastle disease virus hemagglutinin-neuramidinase gene[J].Chin Sci Bull,2006;51(22):2724-2730.
3 连 海,金宁一,李 霄et al.新城疫病毒HN基因诱导人肺癌细胞SPC-A1凋亡的作用机制[J].中国生物化学与分子生物学报,2006;22(3):222-227.
4 Zeng J,Fournier P,Schirrmacher V.Induction of interferon-α and tumor necrosis factor-related apoptosis-inducing ligand in human blood mononuclear cells by Hemagglutinin-Neuraminidase but not F protein of Newcastle Disease Virus[J].Virology,2002;297(1):19-30.
5 孙迎春,金宁一,米志强et al.新城疫病毒HN基因诱导肝癌细胞SMMC7721凋亡的作用机制[J].中华肿瘤杂志,2005;27(5):279-282.
6 李 霄,金宁一,米志强 et al.联合应用凋亡素基因、新城疫病毒HN基因及IL-18基因对黑色素瘤的抑制效应研究[J].高技术通讯,2004;12(1):33-36.
7 陈 漉,金宁一,李 霄 et al.含有Apoptin基因重组腺病毒的构建及鉴定[J].世界华人消化杂志,2008;16(31):3505-3509.
8 Li X,Liu Y,Wen Z et al.Potent anti-tumor effects of a dual specific oncolytic adenovirus expressing apoptin in vitro and in vivo[J].Mol Cancer,2010;9(20):10.
9 Bernt K M,Ni S,Tieu A T et al.Assessment of a combined adenovirus-mediated oncolytic and immunos-timulatory tumor therapy[J].Cancer Res,2005;65(10):4343-4352.
10 Fiola C,Peeters B,Fournier P et al.Tumor selective replication of Newcastle disease virus:Association with defects of tumor cells in an riviral defence[J].Int J Cancer,2006;119(2):328-338.
11 Bian H,Foumier P,Moormann R et al.Selective gene transfer to rumor cells by recombinant Newcastle Disease Virus via a bispecific fusion protein[J].Intl J oncol,2005;26:431-439.
12 Bian H,Foumier P,Moormann R et al.Selective gene transfer in vitro to tumor cells via recombinant Newcastle disease virus[J].Cancer Gene Ther,2005;12:295-303.
13 Anderson R D,Haskell R E,Xia H et al.A simple method for the rapid generation of recombinant adenovirus vectors[J].Gene Ther,2000;7:1034-1038.
14 陈 漉,金宁一,李 霄 et al.表达新城疫病毒血凝素-神经氨酸酶基因重组腺病素的构建及鉴定[J].中国免疫学杂志,2009;25(2):132-135.
