支气管哮喘患者治疗前后细胞因子和呼吸驱动的改变分析
2012-07-30王丽娟
王丽娟
陕西省西安市正和医院,陕西 西安 710054
支气管哮喘是重要的呼吸系统疾病,近年来在全球发病中呈明显上升趋势。支气管哮喘是一种气道炎症和支气管高反应性疾病,由多种细胞特别是肥大细胞、嗜酸性粒细胞和T淋巴细胞参与的慢性气道炎症性疾病[1]。细胞因子系指由免疫细胞及某些非免疫细胞经刺激而合成分泌的一类生物活性物质,是一组多样性的多肽或蛋白质,是在天然免疫和特异性免疫的效应阶段产生的并起介导和调节免疫及炎症应答作用的物质。细胞因子的产生、生物学作用、受体表达、相互调节等均具有网络特点,如IL-1能诱生IFN-α/β、IL-1、IL-2、IL-4、IL-5、IL-6、IL-8 等多种细胞因子,由此形成一种级联反应,表现正向或负向调节效应。IL-8是和支气管哮喘发病机制及病理异常相关介质中研究最早的细胞因子之一,而IL-4与IFN-γ是两种作用截然相反的T细胞亚群分泌的细胞因子,以相互拮抗的方式调节着机体的免疫应答[2]。反映呼吸中枢输出驱动强弱的指标有很多,近年来P0.1逐渐受到研究者的重视。P0.1是指吸气相的第0.1秒的口腔阻断压,除了具有其他指标的诸多优点外,尤其是这种方法具有无创性,容易操作且测定的重复性好[3]。本文具体探讨了支气管哮喘患者治疗前后上述相关细胞因子和呼吸驱动的改变情况,为提高支气管哮喘患者的治愈提供参考。
1 资料与方法
1.1 一般资料
选择2009年3月~2011年10月在我院门诊和住院部治疗的支气管哮喘患者80例作为观察组。所选病例标准:①年龄<60岁;②格拉斯哥昏迷评分(GCS)为3~8分;③入选患者均经过病史询问以及肺功能检查,临床诊断符合中华医学会呼吸病学分会支气管哮喘诊治指南;④无其他系统并发症及多器官损伤;⑤征得患者及家属同意。80例中男42例,女38例;年龄最小12岁,最大59岁,平均41.5岁;病程为1个月~15年,平均5.0年。观察组患者都采用综合治疗方法,首先应用呼吸兴奋药,然后应用无创机械通气治疗。同期选择正常健康人80例作为对照组。上述两组患者年龄、性别对比差异无统计学意义(P>0.05),具有可比性。本实验经过医院伦理委员会批准。
1.2 细胞因子检测
所有受试者均进行外周血单核细胞PBMC中IL-4、IL-8、IFN-γ水平的测定。采用双夹心ELISA法试剂盒,由博士德生物工程有限公司提供,IL-4、IL-8和IFN-γ的检测灵敏度分别为 0、0、50 ng/L。
1.3 呼吸驱动测定
P0.1把吸气相的第0.1秒的口腔阻断压变化视为延髓呼吸中枢神经的呼吸驱动功能,具体方法为经4~6个呼吸周期自动测出,至少测3次后取最小值,3次测量结果相差<10%。最大吸气压(PIMAX):受试者呼气至残气位,然后作最大努力吸气持续3 s以上,至少重复2次,误差<20%,取维持3 s以上的最大值即为PIMAX。
1.4 统计学方法
数据采用SPSS 20.0统计分析软件包进行统计学处理。计量资料采用均数±标准差()表示,组间比较采用t检验。以P<0.05为差异有统计学意义。
2 结果
2.1 治疗效果
经过治疗后,观察组所有患者均痊愈出院。
2.2 两组细胞因子检测结果比较
观察组治疗前IL-8和IFN-γ水平高于对照组(P<0.05),IL-4水平低于对照组 (P<0.05);观察组治疗后IL-8和IFN-γ 水平明显降低(P <0.05),IL-4水平显著升高(P < 0.05)。观察组治疗后上述细胞因子水平与对照组相比,差异无统计学意义(P > 0.05)。 见表 1。
表1 两组细胞因子检测结果比较(,ng/L)

表1 两组细胞因子检测结果比较(,ng/L)
注:与治疗前比较,*P<0.05;与对照组比较,#P<0.05
组别 时间 例数 IL-4 IL-8 IFN-γ对照组观察组 治疗前治疗后80 80 80 16.85±4.62 10.58±5.10#14.89±5.62*159.21±16.85 198.21±25.21#165.52±39.40*1 486.21±109.25 2 323.52±37.12#1 596.25±620.36*
2.3 两组呼吸驱动检测结果比较
观察组治疗前的P0.1值高于对照组,PIMAX低于对照组,差异均有统计学意义(P<0.05)。经过治疗后,均有明显改善(P < 0.05),且与对照组接近(P > 0.05)。 见表 2。
表2 两组呼吸驱动检测结果比较(,kPa)
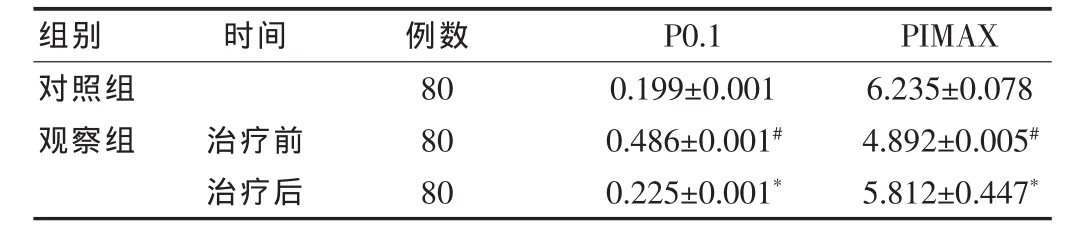
表2 两组呼吸驱动检测结果比较(,kPa)
注:与治疗前比较,*P<0.05;与对照组比较,#P<0.05
组别 时间 例数 P0.1 PIMAX对照组观察组 治疗前治疗后80 80 80 0.199±0.001 0.486±0.001#0.225±0.001*6.235±0.078 4.892±0.005#5.812±0.447*
3 讨论
支气管哮喘确切病因及发病机制仍不清楚,但目前支气管哮喘的发病学研究已有很大进展,其发病机制涉及细胞分子生物学机制、蛋白酶-抗蛋白酶系统氧化剂的作用等,而以细胞毒性T淋巴细胞CD8+T细胞巨噬细胞及中性粒细胞为主的气道壁的气流阻塞是支气管哮喘的两大特点[4]。IL-4是CD4+T细胞中Ⅱ型辅助性T淋巴细胞TH2和CD8+Tc2等分泌的一种具有多种生物学活性的淋巴因子,能促进内皮细胞某些黏附分子特别是VCAM-1的表达。研究发现,使用糖皮质激素可明显抑制IL-4和IL-5,而IL-4与呼吸道重塑结构有关,长期使用糖皮质激素的患者撤药过快,可能导致急性的支气管哮喘发作和呼吸道炎症的复发[5]。IL-8是趋化因子超家族中的一员,IL-8主要通过与靶细胞上的特异受体结合来发挥作用,合成的IL-8是中性粒细胞最主要的细胞因子,提示一旦中性粒细胞达到炎症处,可吸引更多的炎性细胞迁移到炎性部位[6]。干扰素IFN-γ属二型干扰素,IFN-γ可激活中性粒细胞,促进其呼吸爆发并激活血管内皮细胞,促进CD4+T细胞与内皮细胞的黏附及向血管外渗出[7-11]。本文结果显示,经过治疗后观察组所有患者都治疗痊愈出院,观察组治疗后IL-8和IFN-γ水平明显降低(P<0.05),IL-4水平显著升高(P<0.05),治疗后上述细胞因子水平与对照组无明显差异(P > 0.05)。
21世纪初,人们逐渐认识到呼吸力学检测的重要性,呼吸驱动是指吸气时呼吸中枢发出激发吸气肌收缩的神经冲动,它是可以量化的[12]。国外调查显示,呼吸中枢驱动可作为一种生理性生物标志物来监测慢性阻塞性肺疾病急性加重的变化[13]。P0.1已被确认为是反映呼吸中枢吸气驱动的良好指标,而PIMAX是常规的呼吸驱动功能指标[14]。本文结果显示,经过观察,观察组治疗前的P0.1值高于对照组,PIMAX低于对照组,差异均有统计学意义(P<0.05)。经过治疗后,都有明显改善(P < 0.05),且与对照组接近(P > 0.05)。
由此可见,支气管哮喘患者治疗前后细胞因子和呼吸驱动主要指标都有明显变化,加强上述相关指标的检测,将有助于早期进行治疗干预以利提高支气管哮喘患者的治疗成功率。
[1]刘立虎,刘东辉,徐宜全.支气管哮喘的治疗现状与进展[J].临床荟萃,2010,7(2):60-62.
[2]Kasahara K,Shiba K,Ozawa T,et al.Correlation between the bronchial subepithelial layer and whole airway wall thickness in patients with asthma[J].Thorax,2002,57(3):242-246.
[3]秦文敬.支气管哮喘患儿治疗前后血清IL-6、IL-10和GM-CSF检测的临床意义[J].放射免疫学杂志,2008,8(5):407-408.
[4]李刚.哮喘患者血清TNF-α、IL-13、IgE水平变化及意义[J].山东医药,2007,47(20):57-58.
[5]Warner SM,Might DA.Airway modeling and remodeling in the pathogenesis of asthma[J].Curr Opin Allergy Clin Immunol,2008,8(1):44-48.
[6] 罗英.浅谈支气管哮喘的治疗进展[J].基层医学论坛,2012,2(10):18-20.
[7]苏新明,刘志,刘刚,等.慢性阻塞性肺疾病呼吸驱动影响因素分析[J].中国医科大学学报,2005,34(6):552-554.
[8]孟玲.支气管哮喘患者血清肿瘤坏死因子-α、白细胞介素-6及白细胞介素-8 水平变化研究[J].中国医药导报,2012,9(11):61-62.
[9]覃宏志.肿瘤坏死因子α、超敏C反应蛋白、白细胞介素-4和白细胞介素-10在支气管哮喘患者中检测的临床价值分析[J].中国医药导报,2011,8(31):108-110.
[10]常青.舌下脱敏治疗儿童过敏性支气管哮喘疗效观察[J].儿科药学杂志,2011,17(6):27-29.
[11]黄英.小儿支气管哮喘的联合治疗[J].儿科药学杂志,2007,13(1):1-4.
[12]张玲玲.TNFα 308G/A基因多态性与食管鳞状细胞癌预后关系的研究[D].石家庄:河北医科大学,2010:99-101.
[13]Lai WO,Goh HH,Bao Z,et al.The role of sphingosine kinase in a murine model of allergic asthma[J].J Immunol,2008,180(6):4323-4239.
[14]Suarez CJ,Parker NJ,Finn PW.Innate immune mechanism in allergic asthma[J].Curr Allergy Asthma Pep,2008,8(5):451-459.
