上皮细胞间质转化对大肠癌肝转移的早期预测和靶向治疗的研究进展
2012-07-30程家乐综述审校
程家乐(综述),汪 昱,姚 敬(审校)
(上海交通大学附属第六人民医院普外科,上海200000)
随着人民生活水平的提高,膳食结构发生明显的变化,大肠癌成为目前国内高发的恶性肿瘤之一,大肠癌肝转移尤其是影响生存率的最大因素。大肠癌肝转移病因复杂,从正常大肠黏膜发展至大肠癌,大肠癌发展至肝转移的过程是一个受多种因素影响的,多环节的复杂转变过程,可能主要包含下列过程:正常上皮-癌前病变-大肠癌-正常间质-间质上皮化-上皮化间质癌变-癌灶转移,整个过程伴随着多种分子标志物的变化。现就上皮细胞间质转化(epithelial-mesenchymal transition,EMT)过程中出现的一些分子标志物,以及这些标志物对大肠癌肝转移的早期预测和靶向治疗的研究进展予以综述。
1 上皮细胞间质转化和致癌作用
最近,在一些肿瘤生物学的研究中已经发现了许多能标志肿瘤进展的分子机制,其中一项研究成果就是EMT的过程[1]。它是在胚胎形成的背景下首次发现的,在这个背景下,形态形成和器官形成包含了大量可塑性细胞,这些可塑性细胞在组织形态上可以从上皮细胞向间质细胞转化,也可以从间质细胞向上皮细胞转化。这样的转化也伴随着分子学的变化,如钙黏素、连环蛋白、蜗牛(Snail)家族蛋白,这些蛋白被称作是EMT过程的调节因子[2]。大肠和肝脏的胚胎学解释了EMT在胚胎形成中的作用。比如,众所周知的一些迁移到大肠的细胞组成浆膜间皮,通过EMT的过程在大肠内部迁移,使大肠血管的血管平滑肌细胞数量增加。实验证据表明,在肝脏发育的起始过程中表型和遗传型参与 EMT[3]。
20年前的一些研究就表明这些形态学和间质细胞样的改变也发生在培养液中的癌细胞,使得它们更具侵袭性,EMT同时也会阻碍细胞的凋亡,这是癌症的特征性标志。比如,通过激活多种包括磷脂酰激酶3/苏氨酸激酶和分裂素活化蛋白激酶在内的抗凋亡信号通路,EMT和Snail家族蛋白的转录控制能提高细胞的寿命[4]。研究显示许多因素能够诱导EMT,许多信号通路机制也参与其中。最近的一些动物实验表明,EMT、致癌作用、癌症转移三者之间有着直接的联系。一些人体的研究证实和原发肿瘤相比,在癌灶和转移灶中有上皮分子标志物的缺失和间质分子标志物的获得。然而,EMT与致癌作用及癌症转移的关系仍然存在争议[5]。部分原因是绝大多数支持EMT加快致癌及癌症转移的数据来自细胞及动物模型,此外,一些研究甚至显示肿瘤的进展和转移可能与EMT无关。这个可能性在一个皮肤癌的动物实验中被证实,这项研究的作者报道了在角质细胞中转化生长因子 β1(transforming growth factor-beta-1,TGF-β1)的诱导而不需要功能性TGF-β1受体就能引起肿瘤的转移,没有 EMT的迹象[6]。
2 EMT对大肠癌肝转移的影响
结肠癌是一个用来研究和了解肿瘤生物学非常好的模型。Vogelstein证明致癌作用的多步骤过程同样适用于其他实体肿瘤。大肠癌目前证实是一个很好的模型,用来研究EMT在一般实体肿瘤中的角色。部分原因是它广为人知地转移至肝脏和其他的致命部位[7]。事实上,最近一项采用了转录分析技术分析报道的研究表明,326例结肠癌患者的微点阵数据与EMT信号的结肠癌基因表达模式有紧密联系[8]。
可能已经有证据证实EMT在结肠癌的影响,但是多年来并未认识到这一点。早在1998年就发现β-连环蛋白细胞核(EMT的标志物)在大肠癌浸润的边缘过度表达[9]。很多问题没有答案,包括结肠癌细胞能通过敌对的血流环境成功地转移至肝脏。EMT可以提供一些解释。以TGF-β1和Snail 1(蜗牛蛋白1)为例,着重讨论EMT的生长诱导因子及转录调节因子在大肠癌中的作用。
TGF-β和肿瘤坏死因子α(tumor necrosis factor-α,TNF-α)在由高分化大肠癌细胞组成的三维细胞球体中能诱导EMT已经被证实,在那个系统中,高分化的类器官结构被转换成有很强迁移能力的单层结构。整合素αvβ6表达的增加伴随着EMT。在异种移植的研究中,进一步说明在肿瘤细胞侵犯的周围间质组织中,钙黏素E的缺失与整合素αvβ6表达的增加有密切联系。重要的是,对那些临床患者组织的研究中,研究显示这些数据标志着患者不良的预后。免疫组化研究显示,FLH2(four-and-a-half LIM protein 2)在转移的大肠癌组织中的高度表达,进一步证明了TGF-β1诱导的EMT在大肠癌的进展、侵袭及转移的重要性。利用细胞培养系统,研究者发现FLH2在大肠癌细胞中直接诱导EMT,这是依靠上游通路TGF-β1的存在[10]。
一项独立的研究也证明了Snail 1在大肠癌细胞中能诱导EMT,并用蛋白质组学技术发现了一系列新在Snail 1的控制下的蛋白质。此外,研究者利用免疫组织化学技术发现了一种Snail 1目标蛋白,14-3-3σ与临床大肠癌患者密切相关[11]。Snail 1是EMT下游的转录调节器。Snail 1的上游调节是什么?随后的研究显示,TGF-β1在大肠癌中诱导EMT通过FLH2也证明Snail 1确实是那一通路的下游,作用是使钙黏素E的转录表达上调[12]。因此,在大肠癌中,TGF-β1是Snail1控制的EMT的重要诱导因子。
此外,许多别的研究证明在不同的大肠癌细胞系中有EMT的诱导[13]。虽然大部分是体外实验,这些研究已经显露出重要的潜在机制。因此,EMT似乎在大肠癌的发展及肝转移中起着一定作用。更重要的是,在大肠癌EMT方面的研究可能会发现能有效地控制大肠癌肝转移的重要的靶向治疗。一项人体大肠癌细胞系和人体大肠癌组织的研究很好的证实了这个观点,这个研究证实了环氧合酶2(cyclooxygenase-2,COX-2)在转移大肠癌中的过度表达和EMT分子特征有重要的相关性[14]。这个发现可能非常重要,因为许多先前的研究表明COX-2在大肠癌发展的过程中非常重要,并且COX-2抑制剂可能对大肠癌有辅助化疗的效果。此外,普通大众有应用COX-2抑制剂的经历,而且它的不良反应比其他化疗药物要小得多。
然而,仍有许多原因来质疑EMT在大肠癌发展、侵袭、肝转移中的临床重要性,一项最近的研究报道了神经细胞黏附分子L1(β-连环蛋白的一个靶点)的强迫表达,促进了大肠癌的肝转移而不通过诱导EMT[15]。特别是,在大肠癌组织的仔细研究中发现肿瘤的边缘与肿瘤中心相比,有钙黏素E的异常表达。所以β-连环蛋白和钙黏素E的核超表达都是EMT的标志,可能这些支持EMT出现在大肠癌的数据只出现在人体中,而并不出现在体外实验中,这点原因还不是很明确,可能是因为他们所用的HCT116和SW620大肠癌细胞系处于微卫星不稳定(microsatellite instability,MSI)状态和无功能的TGF-β受体Ⅱ状态,这两种状态被证实与大肠癌中EMT的过程不能共同存在[16]。
另一个值得关注的理由是一些因子已知的复杂功能可能诱导EMT。TGF-β是一个典型的例子,这是研究得最好的诱导EMT的因子,最初它被认为是肿瘤的抑制因子,但是现在被证实肿瘤能够抵抗它的抑制效果,所以它的功能变为亲致癌性,诱导EMT,亲转移性。问题仍然是这些作用什么时候能在大量的癌症中看见。实验证明在早期大肠癌中TGF-β有抑制肿瘤的效果。目前的数据也表明TGF-β在大肠癌中的功能是诱导EMT,而不论是微卫星稳定或MSI状态,也不论TGF-β受体功能的有无[16]。就这一点而言,一项研究显示有EMT特征的大肠癌与微卫星稳定有重要的联系[16]。MSI在EMT中的确切作用还不明确。确实,就像一项研究显示的那样,肿瘤细胞有MSI和有功能的TGF-β受体Ⅱ状态在 TGF-β1的诱导下也经历 EMT[16]。因此,似乎是TGF-β1能否诱导EMT的关键在于是否存在TGF-β受体Ⅱ而不是MSI本身。
尽管EMT在大肠癌中的作用非常复杂,大量的数据表明EMT在大肠癌肝转移中起着重要的作用。
3 针对EMT进行靶向治疗的可能性和其预测大肠癌肝转移的标志物
EMT作为一个生物学进程已经提供了大量的肿瘤生物学信息。对它研究的价值实际上可能超出对肿瘤生物学本身的研究价值,因为在研究它如何调节肿瘤进展和转移的过程中,发现一些分子标志物可能在肿瘤的进展和转移方面起着决定性作用。更有研究显示,这些标志物可以靶向逆转EMT、肿瘤发生和肿瘤转移。人体研究也显示许多标志物有重要的预测价值[17]。当然,大多数的标志物是在研究其他肿瘤时发现的,但是现将讨论的范围仅局限在大肠癌肝转移的标志物中。
如上所述,大肠癌被证明是一个研究包括EMT在内的肿瘤生物学的好模型,对EMT在大肠癌的进展和转移的研究中显示了许多有前景的治疗靶点和肿瘤进展的预测指标(图1)。这些标志物包括brachyury 蛋白[18]、COX-2[14]、细胞外信号调节激酶[19]、连环蛋白 p120[20]、整合素 αvβ6[21]和 14-3-3σ[22]。αvβ6和 14-3-3σ 可能是大肠癌预后良好的分子标志物。但还需要大规模的人体研究来证实这个观点。COX-2抑制剂是很有前途的,因为其广泛应用于人群,并且事实上塞来昔布已经被证实对家族性遗传性腺瘤息肉病有效。然而,COX-2抑制剂对心脑血管的不良反应有待解决。细胞外信号调节激酶抑制剂在临床前和第1阶段的临床试验中也显示出很大的前景。
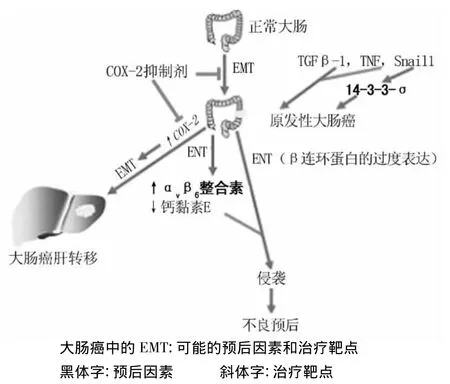
图1 EMT在大肠癌及大肠癌肝转移中作用的原理图
4 问题多于答案
研究者面临的问题多于答案。是否人体大肠癌侵袭性和转移性必须经过EMT?微环境中究竟是什么本质的东西促使人体大肠癌的侵袭性和转移性。关于肿瘤的微环境:肿瘤间质中的成纤维细胞和肿瘤内的低氧环境与EMT及致癌作用相关。研究发现,从人类乳腺癌组织中提取的成纤维细胞可以诱导EMT,并增加体外直接共同培养癌细胞模型的迁移能力[23]。低氧环境在大肠癌、乳腺癌、胰腺癌细胞系中能诱导EMT。然而,EMT可能从另一个重要的途径影响肿瘤微环境的本质东西。一项研究显示,癌细胞中的EMT诱导会导致多种包括白细胞介素8在内的趋化因子分泌的增加,同时白细胞介素8也会相应地增加EMT的诱导[24]。另外一些趋化因子CCL2和 CCL5与 EMT有关[25]。因此,EMT在肿瘤微环境中可以作为一个自立的过程,通过释放趋化因子最终导致肿瘤的进展和转移。
一些相关的问题始终存在。比如,肿瘤细胞是如何逃过肝脏的免疫敌对环境而移植到肝脏的?EMT是起到全部的作用还是部分作用?新兴的数据似乎表明EMT是异质性的,许多癌细胞处于中间的不完全的EMT状态[26]。同时,一些研究者发现肿瘤的远处转移与EMT的逆转移方向有关,这种现象称作间质细胞上皮转移。比如,在大肠癌中,发现肝转移与miR-200C表达的增加和特征性EMT的增加密切相关[27]。MET在癌症转移中的确切作用存在争议,因为在一些癌症的数据中表明MET起到反肿瘤转移的作用[28]。总之,哪些分子标志物可以作为肿瘤治疗的靶点?这一问题仍然存在。
5 结语
很明显,面临的问题多于答案。体外实验和动物实验的数据表明肿瘤的进展和转移与EMT有着密切联系。但是,能支持这个观点的人体研究相当有限。因此,需要更多的人体研究来明确EMT在人体肿瘤的进展和转移方面的确切作用。同时,需要专业的研究来明确EMT过程中各靶点药物在治疗肿瘤的进展和转移中的临床效果。
[1] Chaffer CL,Weinberg RA.A perspective on cancer cell metastasis[J].Science,2011,331(6024):1559-1564.
[2] Gumbiner BM.Regulation of cadherin-mediated adhesion in morphogenesis[J].Nat Rev Mol Cell Biol,2005,6(8):622-634.
[3] Su J,You P,Li WL,et al.The existence of multipotent stem cells with epithelial-mesenchymal transition features in the human liver bud[J].Int J Biochem Cell Biol,2010,42(12):2047-2055.
[4] Franco DL,Mainez J,Vega S,et al.Snail1 suppresses TGF-beta-induced apoptosis and is sufficient to trigger EMT in hepatocytes[J].J Cell Sci,2010,123(20):3467-3477.
[5] Turley EA,Veiseh M,Radisky DC,et al.Mechanisms of disease:epithelial-mesenchymal transition-does cellular plasticity fuel neoplastic progression?[J].Nat Clin Pract Oncol,2008,5(5):280-290.
[6] Han G,Lu SL,Li AG,et al.Distinct mechanisms of TGFbeta(1)-mediated epithelial-to-mesenchymal transition and metastasis during skin carcinogenesis[J].J Clin Invest,2005,115(7):1714-1723.
[7] Wilmanns C,Steinhauer S,Grossmann J,et al.Site-dependent differences in clinical,pathohistological,and molecular parameters in metastatic colon cancer[J].Int J Biol Sci,2009,5(5):458-465.
[8] Loboda A,Nebozhyn MV,Watters JW,et al.EMT is the dominant program in human colon cancer[J].BMC Med Genomics,2011,4:9.
[9] Brabletz T,Jung A,Hermann K,et al.Nuclear overexpression of the oncoprotein beta-catenin in colorectal cancer is localized predominantly at the invasion front[J].Pathol Res Pract,1998,194(10):701-704.
[10] Zhang W,Jiang B,Guo Z,et al.Four-and-a-half LIM protein 2 promotes invasive potential and epithelial-mesenchymal transition in colon cancer[J].Carcinogenesis,2010,31(7):1220-1229.
[11] Larriba MJ,Casado-Vela J,Pendas-Franco N,et al.Novel Snail1 target proteins in human colon cancer identified by proteomic analysis[J].PLoS One,2010,5(5).
[12] Zhang W,Wang J,Zou B,et al.Four and a half LIM protein 2(FHL2)negatively regulates the transcription of E-cadherin through interaction with Snail1[J].Eur J Cancer,2011,47(1):121-130.
[13] Bowen KA,Doan HQ,Zhou BHP,et al.PTEN loss induces epithelial-mesenchymal transition in human colon cancer cells[J].Anticancer Res,2009,29(11):4439-4449.
[14] Jang TJ,Jeon KH,Jung KH.Cyclooxygenase-2 expression is related to the epithelial-to-mesenchymal transition in human colon cancers[J].Yonsei Med J,2009,50(6):818-824.
[15] Gavert N,Vivanti A,Hazin J,et al.L1-mediated colon cancer cell metastasis does not require changes in emt and cancer stem cell markers[J].Mol Cancer Res,2011,9(1):14-24.
[16] Pino MS,Kikuchi H,Zeng M,et al.Epithelial to mesenchymal transition is impaired in colon cancer cells with microsatellite instability[J].Gastroenterology,2010,138(4):1406-1417.
[17] Chen LL,Chan THM,Yuan YF,et al.CHD1L promotes hepatocellular carcinoma progression and metastasis in mice and is associated with these processes in human patients[J].J Clin Invest,2010,120(4):1178-1191.
[18] Fernando RI,Litzinger M,Trono P,et al.The T-box transcription factor Brachyury promotes epithelial-mesenchymal transition in human tumor cells[J].J Clin Invest,2010,120(2):533-544.
[19] Tay PN,Tan P,Lan YH,et al.Palladin,an actin-associated protein,is required for adherens junction formation and intercellular adhesion in HCT116 colorectal cancer cells[J].Int J Oncol,2010,37(4):909-926.
[20] Bellovin DI,Bates RC,Muzikansky A,et al.Altered localization of p120 catenin during epithelial to mesenchymal transition of colon carcinoma is prognostic for aggressive disease[J].Cancer Res,2005,65(23):10938-10945.
[21] Bates RC,Bellovin DI,Brown C,et al.Transcriptional activation of integrin beta 6 during the epithelial-mesenchymal transition defines a novel prognostic indicator of aggressive colon carcinoma[J].J Clin Invest,2005,115(2):339-347.
[22] Larriba MJ,Casado-Vela J,Pendas-Franco N,et al.Novel Snail1 target proteins in human colon cancer identified by proteomic analysis[J].PLoS One,2010,5(5).
[23] Gao MQ,Kim BG,Kang S,et al.Stromal fibroblasts from the interface zone of human breast carcinomas induce an epithelial-mesenchymal transition-like state in breast cancer cells in vitro[J].J Cell Sci,2010,123(20):3507-3514.
[24] Fernando RI,Castillo MD,Litzinger M,et al.IL-8 signaling plays a critical role in the epithelial-mesenchymal transition of human carcinoma cells[J].Cancer Res,2011,71(15):5296-5306.
[25] Soria G,Ofri-Shahak M,Haas I,et al.Inflammatory mediators in breast cancer:coordinated expression of TNF alpha&IL-1 beta with CCL2&CCL5 and effects on epithelial-to-mesenchymal transition[J].BMC Cancer,2011,11(1):130.
[26] Strauss R,Li ZY,Liu Y,et al.Analysis of epithelial and mesenchymal markers in ovarian cancer reveals phenotypic heterogeneity and plasticity[J].PLoS One,2011,6(1):e16186
[27] Hur K,Takahashi M,Balaguer F,et al.MicroRNA-200c/141 cluster as a control switch between epithelial-to-mesenchymal transition(EMT)and mesenchymal-to-epithelial transition(MET)in human colorectal cancer metastasis[J].Gastroenterology,2011,140(5):S817-S820.
[28] Chen J,Wang L,Matyunina LV,et al.Overexpression of miR-429 induces mesenchymal-to-epithelial transition(MET)in metastatic ovarian cancer cells[J].Gynecol Oncol,2011,121(1):200-205.
