大鼠挤压伤所致急性肾损伤的病理生理变化
2012-07-29王静雯王德文李杨左红艳徐新萍王少霞郭晓明彭瑞云
王静雯,王德文,李杨,左红艳,徐新萍,王少霞,郭晓明,彭瑞云
大鼠挤压伤所致急性肾损伤的病理生理变化
王静雯,王德文,李杨,左红艳,徐新萍,王少霞,郭晓明,彭瑞云
目的:分析大鼠挤压伤所致急性肾损伤的病理生理改变。方法:雄性Wistar大鼠48只,体重200~230 g,随机分为对照组(12只)和挤压伤组(36只),钳夹大鼠双后肢近端建立大鼠挤压伤模型,于第1天、第3天、第5天、第7天、第9天、第11天取血检测尿素氮(BUN)、肌酐(Cr),观察肾脏组织学和超微结构改变,免疫组织化学方法检测肾脏c-Fos表达。结果:挤压伤大鼠BUN水平第1天、第3天、第5天高于对照组,Cr于第1天、第3天、第5天升高具有显著性差异(P<0.01),第7天渐恢复,至第11天均趋于正常;肾脏皮质和髓质肾小管上皮细胞于第3天、第5天出现变性、凋亡,第7天后渐恢复;c-Fos在第5天可见明显的阳性表达细胞。结论:挤压伤引起大鼠肾脏功能和形态学改变,并诱导肾脏c-Fos表达。
挤压伤;急性肾损伤;形态学;c-Fos
R 363.2
严重地震等自然灾害、矿难等意外事故可引起建筑物倒塌和人员掩埋,常常发生挤压伤[1]。挤压伤所致急性肾损伤是挤压伤伤员死亡的重要原因之一,其治疗措施尚有待进一步探索和改善。由于近年重大地震等时有发生,挤压伤所致急性肾损伤的研究备受瞩目。本实验拟系统观察挤压伤后大鼠肾功能、肾脏组织学、超微结构改变,并动态检测肾脏c-Fos表达,探讨其变化与肾脏功能和病理损伤的关系,旨在为挤压伤所致急性肾损伤的研究和防治提供理论依据。
1 材料和方法
1.1 材料清洁级雄性Wistar大鼠48只,体重200~230 g;兔抗c-Fos抗体(美国Santa Cruz公司);聚合物辅助剂(北京中杉金桥生物公司);辣根酶标记抗兔IgG多聚体(北京中杉金桥生物公司)。
1.2 方法
1.2.1 动物分组和模型建立实验大鼠随机分为挤压伤组(36只)和对照组(12只),挤压伤组活杀时间点于第1天、第3天、第5天、第7天、第9天、第11天,每个时间点6只。挤压伤模型建立采用5%戊巴比妥钠腹腔注射麻醉后钳夹大鼠双后肢近端的方法。对照组不予任何处理。
1.2.2 血清生化指标检测实验大鼠解剖时下腔静脉取血,全自动生化分析仪检测血清尿素氮(BUN)、肌酐(Cr)。
1.2.3 超微结构观察3.1%戊二醛固定2 h,1%锇酸固定2 h,梯度乙醇和丙酮脱水,Epon812包埋,制作超薄切片,醋酸铀和柠檬酸铅双重染色,Phi lip-CM120型透射电镜进行超微结构观察。
1.2.4 免疫组织化学石蜡切片经脱蜡水化后,3%H202孵育10min去除内源性过氧化物酶,抗原修复后,c-Fos一抗(1:50)4℃过夜,聚合物辅助剂37℃孵育30min,辣根酶标记抗兔IgG多聚体孵育30min,DAB显色,苏木素复染,盐酸酒精分化,常规脱水,二甲苯透明,中性树胶封片。每张切片随机选取3个视野,计数细胞核呈棕黄色阳性表达细胞百分比。
1.3 统计学处理利用SPSS 17.0统计软件对数据采用t检验,以±s表示,P<0.05具有显著性差异。
2 结果
2.1 BUN和Cr水平与对照组比较,挤压伤后第1天、第3天、第5天血清BUN升高,但差异不显著,第7天后趋于正常(图1,A);挤压伤第1天、第5天血清Cr水平与对照组明显升高(P<0.01),第7天后趋向正常,与对照组无明显差异(图1,B)。见图1。
2.2 肾脏组织学改变挤压伤第1天大鼠肾脏未见明显组织学改变,于挤压伤第3天肾皮质近曲和远曲肾小管上皮细胞浊肿,并可见胞浆空泡(图2,A、B);第5天肾皮质和髓质肾小管上皮细胞除上述改变外,出现明显细胞肿胀、胞浆疏松浅染等水样变性表现和核固缩浓染,并可见于各段肾小管,尤以皮质内侧(内皮质)和髓质外侧为严重(图2,C、D);第7天后渐恢复,到第11天未见结构明显异常。见图2。
2.3 肾脏超微结构改变超微结构观察显示,于挤压伤第3天皮质和髓质各段肾小管上皮细胞出现线粒体肿胀,局部囊泡化,细胞核核形不规则,染色质凝聚、边集,重者呈细胞凋亡改变,血管内皮细胞也见类似变化。见图3。
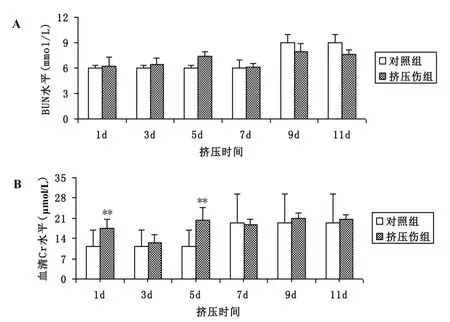
图1 挤压伤对大鼠BUN和血清Cr水平的影响
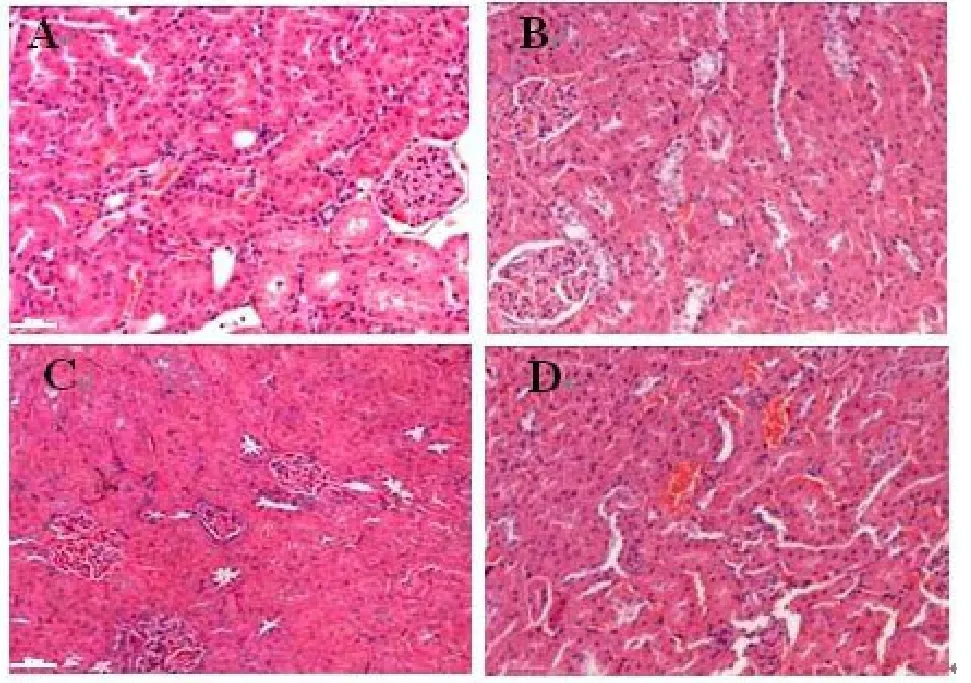
图2 挤压伤后大鼠肾脏组织学改变(×200)
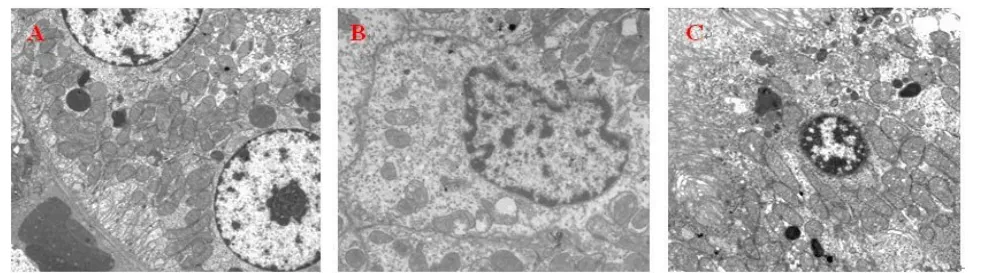
图3 挤压伤第3天大鼠肾脏皮质近曲小管细胞超微结构变化
2.4 肾脏c-Fos表达大鼠肾脏c-Fos免疫组化染色结果显示,对照组和挤压伤组第1天、第3天、第7天、第9天、第11天均仅见肾小管上皮个别细胞胞浆浅染,未见明确的细胞核阳性细胞(未示),挤压伤组第5天皮髓质各段肾小管均可见c-Fos细胞核表达阳性细胞,其中皮质c-Fos阳性细胞百分比(7.00±1.00)%,髓质阳性细胞百分比(7.67± 0.58)%。见图4。
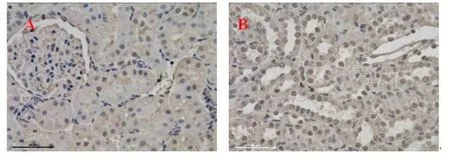
图4 挤压伤诱导大鼠肾脏c-Fos表达(×400)
3 讨论
四肢或躯干肌肉丰富部位长时间受到挤压可造成肌肉坏死溶解,挤压伤后引起的全身改变是多方面的,但其中最主要在于对肾脏产生的损害[2-3]。有研究表明,挤压伤后BUN和血清Cr升高,肾脏病理形态学观察可见肾小管上皮细胞坏死[4],但迄今对持续性挤压伤所致急性肾损伤中肾功能和形态学的动态变化规律和特点尚未见系统深入的研究报道。对挤压伤所致急性肾损伤机制的研究表明,自由基、NO在挤压伤所致急性肾损伤中起重要作用[5],发生挤压伤后大鼠肾脏炎性因子TNF-α、ICAM-1表达升高,肾小管上皮细胞Fas、FasL、Bcl-2等凋亡蛋白表达增加,挤压伤后肾组织发生低氧,这可能是挤压伤后发生急性肾损伤的重要机制之一[6],然而,挤压伤所致急性肾损伤的机制至今尚未完全明确,有关c-Fos在其中作用还未见文献报道。
目前国内外研究挤压伤多采用甘油肌肉注射或重物压迫的方法[7-9],本实验室首次应用钳夹方法成功建立了挤压伤模型,与目前国内外相关研究中应用较多的甘油肌肉注射方法相比,更为接近临床实际;与应用重物压迫建立的模型方法相比,则具有简单易行,并可进行持续挤压所致损伤效应研究的优点。本实验系统观察了BUN和Cr的动态变化规律,在挤压伤第1天、第3天、第5天中,BUN水平显示出升高的趋势,挤压伤第1天、第5天血清Cr水平显著高于对照组,表明本实验中挤压伤导致了急性肾功能损伤。挤压伤后第7天血清BUN和Cr渐恢复,到第11天达正常水平,可能与钳夹肢体于第7天到第11天已干枯、脱落,横纹肌坏死溶解减少,同时,肾脏病理损伤明显减轻,甚至接近消失,肾功能进入恢复阶段有关。
本实验系统揭示了挤压伤后大鼠肾脏形态学改变的动态变化规律和特点。组织学观察发现,于挤压伤第3天肾皮质肾小管上皮细胞出现胞浆空泡,第5天肾皮髓质肾小管上皮细胞出现细胞肿胀、胞浆疏松浅染等水样变性、核固缩浓染改变,第7天进入恢复阶段。超微结构观察发现,挤压伤第3天肾小管上皮细胞线粒体扩张,局部囊泡化,细胞核核形不规则,染色质凝聚边集,并发生细胞凋亡。以上研究结果表明,挤压伤后肾小管损伤最早见于皮质,远曲和近曲小管均可发生损伤,随挤压时间延长,皮髓质各段肾小管均可出现损伤。本挤压伤模型所致急性肾功能和结构损伤起病具有快速性、病程呈现阶段性(早期第1天、高峰期第5天、恢复期第7天后)和病变累及部位的广泛性(肾皮质和髓质、各级肾小管均受累及)。
c-Fos是即早反应基因之一,属于AP-1转录因子家族,与其他分子形成异源聚合物,调控多种生理和病理过程[10-11]。既往研究表明,缺血再灌注、一些毒物和药物引起的损伤等可诱导肾脏c-Fos高表达,其高表达能诱导细胞凋亡[12-13],但c-Fos在挤压伤所致急性肾损伤中的病理生理意义尚未见有关文献报道。本实验首次动态观测了挤压伤后不同时间大鼠肾脏c-Fos表达变化,并探讨了其变化与肾脏功能和病理损伤的关系,结果显示,挤压伤仅于第5天出现c-Fos细胞核阳性细胞,且c-Fos阳性表达细胞出现时间与形态学改变具有明显的同步性,提示c-Fos可能参与挤压伤后肾脏病理生理改变。其作用有待进一步深入研究。
[1]伍晓靖,王跃,卢冰,等.汶川大地震挤压伤伤员伤情特点及干预措施[J].实用医院临床杂志,2010,7(1):27-28.
[2]阿布力孜·阿不都热合曼,尔西丁·买买提,金茂强,等.50例挤压综合征尸检案例分析[J].新疆医科大学学报,2002,25(1):96.
[3]Vanholder R,Van Biesen W,Lameire N,et al.The role of the international society of nephrology/renal disaster relief task force in the rescue of renal disaster victims[J].Cont rib Nephrol,2007,156:325-332.
[4]Huerta-AlardínAL,Varon J,Marik PE.Bench-to-bedside review:Rhabdomyolysis—an overview for cl inicians[J].Crit Care,2005,9(2):158-169.
[5]Aydogdu N,Atmaca G,Yalcin O,et al.Protective ef fects of L-carnitine on myoglobinuric acute renal fai lure in rats[J].Cl in Exp Pharmacol Physiol,2006,33(1-2):119-124.
[6]Rosenberger C,Goldfarb M,Shina A,et al.Evidence for sustained renal hypoxia and t ransient hypoxia adaptation in experimental rhabdomyolysis-induced acute kidney injury[J].Nephrol Dial Transplant,2008,23(4):1135–1143.
[7]Ustundag S,Yalcin O,Sen S,et al.Experimental myoglobinuric acute renal fai lure:the ef fect of vitamin C[J].Ren Fai l,2008,30(7):727-735.
[8]张晓彤,谷振勇,韩业兴,等.大鼠双后肢挤压伤局部肌组织NO变化及其作用[J].法医学杂志,2006,22(4):264-268.
[9]Ustundag S,Sen S,Yalcin O,et al.L-Carnitine amel iorates glycerol-induced myoglobinuric acute renal failure in rats[J].Ren Fai l,2009,31(2):124-133.
[10]Ely HA,Mel lon PL,Coss D.GnRH induces the c-Fos gene via phosphorylation of SRF by the calcium/calmodul in kinaseⅡpathway[J].Mol Endocrinol,2011,25(4):669-680.
[11]Gar riz JS,Suarez C,Capponi AM.c-Fos mediates angiotensinⅡ-induced aldosterone production and protein synthesis in bovine adrenal glomerulosa cel ls[J].Endocrinolgy,2009,150(3):1294-1302.
[12]Li H,Xie P,Li G,et al.In vivo study on the effects of microcystin extracts on the expression profi les of proto-oncogenes(c-fos,c-jun and c-myc)in l iver,kidney and testis of male Wistar rats injected i.v.with toxins[J].Toxicon,2009,53(1):169-175.
[13]Naito M,Bomsztyk K,Zager RA.Renal ischemia-induced cholesterol loading:transcription factor recruitment and chromatin remodel ing along the HMG CoA reductase gene[J].Am J Pathol,2009,174(1):54-62.
国家科技部709项目(No.2006FK130006)
100850北京,军事医学科学院二所(王静雯,王德文,李杨,左红艳,徐新萍,王少霞,郭晓明,彭瑞云)
王德文,E-mai l:wangdewen1938@yahoo.com.cn
2012-10-15)
