光谱法研究野漆树苷与人血清蛋白的结合作用
2012-07-28邓少东肖凤霞卓嘉琳
邓少东,帅 欧,林 励,肖凤霞,卓嘉琳
(广州中医药大学中药学院,广东广州 510006)
血清蛋白(SA)是血液中重要的运输蛋白,药物进入机体后首先与血清蛋白结合,通过血浆的存储和运输,到达受体部位产生药理作用,是药物发挥药效的重要载体和靶分子。SA在紫外光激发下,分子具有较强的内源荧光发射,也可与多种内源和外源性物质结合而使其荧光光谱有所变化[1]。探讨具有药理活性的小分子与SA的作用机制,对阐明药物在体内的分布与代谢过程以及了解药物发挥药效的作用机制有重要意义[2-3]。
野漆树苷为化橘红、山香圆叶等中药中的黄酮类活性成分,具有抗炎、抗氧化、抗登革热及促进胰岛素受体磷酸化等作用[4-6]。近年,关于野漆树苷的研究越来越多,已被收录为2010年版中国药典一部山香圆叶及其制剂山香圆片的含量测定用对照品[7],但迄今未见野漆树苷与人血清蛋白(HSA)之间相互作用的报道,为此作者开展了本项研究,以期为野漆树苷在临床上合理应用提供理论参考。
1 材料
1.1 仪器 F-2500型荧光分光光度计(日本HITACHI);CARY-50型紫外 -可见分光光度计(美国 VARIAN);BP211D型电子天平(德国Sartorius公司);DKB-501A型超级恒温水槽(上海森信实验仪器有限公司);Genpure超纯水系统(德国TKA公司);PHB-3型PH计(上海三信仪表厂)。
1.2 试药 野漆树苷(自制,纯度99.32%),精密称取适量溶于50%甲醇/水中,配制成浓度为2.576 mmol·L-1的溶液;Tris-盐酸缓冲液(上海双螺旋生物科技,批号K0810A),精密量取适量加入超纯水,稀释成50 mmol·L-1(pH 7.4)的缓冲液;HSA(广州威佳科技,纯度95%,批号70024-90-7),精密称取适量用上述缓冲液配制成0.01036 mmol·L-1的溶液;实验用水均为超纯水。
2 方法
2.1 光谱扫描 在220~800 nm范围内,测定HSA溶液的激发光谱和发射光谱,得Ex=280 nm,Em=336 nm。在5 ml具塞试管中,各加入1.9ml HSA溶液,分别加入0.0、8.0、16.0、24.0、32.0、40.0、48.0、56.0、64.0、72.0、80.0、88.0、96.0 μl的野漆树苷溶液,用移液枪加Tris-盐酸缓冲液至2.00 ml,将温度分别调至 25℃、37℃,激发和发射光谱狭缝宽度均为5.0 nm,进行荧光光谱扫描,记录野漆树苷对HSA的荧光猝灭光谱图,同时记录Δλ=15 nm与 Δλ=60 nm的同步荧光光谱;紫外-可见分光光度计测定与 HSA相同浓度的野漆树苷在290~500 nm范围内的紫外吸收光谱。
2.2 猝灭机制确定及猝灭常数的计算 根据Stern-Volmer方程和Lineweaver-Burk双倒数方程判断野漆树苷的荧光猝灭机制[8]。
Stern-Volmer方程:
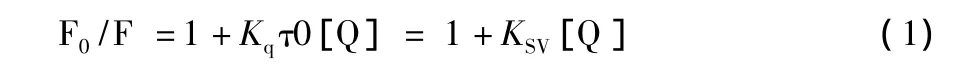
Lineweaver-Burk双倒数方程:
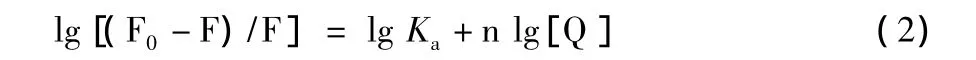
式中F0、F分别为未加和加入猝灭剂时HSA的荧光强度。Kq为双分子猝灭速率常数,[Q]为猝灭剂的浓度,τ0为不存在猝灭剂时荧光分子平均寿命(约为10-8s),KSV为动态猝灭常数,Ka为静态猝灭常数,n为结合位点数。
2.3 结合距离的测定 根据 Foster能量转移原理[9],当化合物满足以下条件时会发生非辐射能量转移:供能体发射荧光;供能体荧光发射光谱与受能体吸收光谱有足够的重叠;供能体与受能体之间的结合距离不超过7 nm。
能量转移效率E与结合距离r之间的关系:
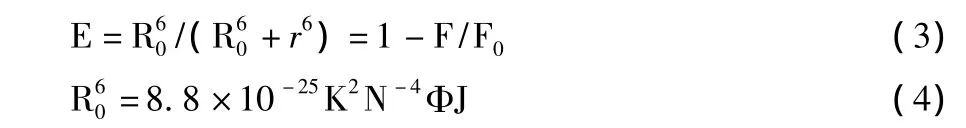
E为能量转移效率,R0为能量转移效率为50%时的临界距离,r为供能体与受能体之间的距离,F为HSA浓度与药物浓度为1∶1时HSA的荧光强度,K2为供能体-受能体偶极空间取向因子,N为介质的折射指数,Φ为HSA的荧光量子产率,J为供能体的发射光谱与受能体的吸收光谱的重叠积分。
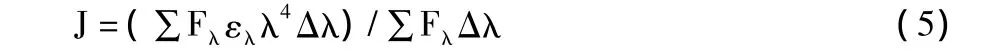
其中,Fλ是供能体在波长λ处的荧光强度,ελ是受能体在波长λ处的摩尔吸光系数,Δλ为计算时分割的波长跨度。根据HSA荧光发射光谱与野漆树苷吸收光谱的叠加图,把光谱重叠部分分割成很小的矩形,依据式(5)求得野漆树苷与 HSA的重叠积分,将 J值及 K2、n、Ф值代入式(4),即可求出临界距离 R0,计算中 K2、n、Ф 分别取 2/3、1.336、0.118。能量转移效率E可由E=1-F/F0求出,最后得出HSA与野漆树苷之间的结合距离。
2.4 作用力类型的确定 有机小分子和HSA之间的结合力主要包括氢键、范德华力、静电引力、疏水作用力等[10]。根据反应前后热力学参数焓变(ΔH)和熵变(ΔS)的相对大小,可以判断小分子与蛋白质间的主要作用力类型,ΔH>0、ΔS>0为典型的疏水作用力;ΔH<0、ΔS<0为氢键和范德华力;ΔH<0、ΔS>0为静电作用力。根据热力学关系式,计算野漆树苷与HSA相互作用的热力学参数,从而判断作用力类型。K1、K2分别为在T1、T2温度下野漆树苷与 HSA的结合常数,R为气体常数约等于8.314。

2.5 同步荧光光谱的测定 固定HSA浓度为1×10-5mol·L-1,改变野漆树苷浓度测定△λ分别为15 nm和60 nm的同步荧光光谱。
3 结果
3.1 野漆树苷对HSA荧光光谱的影响 HSA的荧光光谱能反映HSA分子中氨基酸残基所处微环境及其分布情况、蛋白质高级结构[11]。Fig 1显示:随着加入野漆树苷浓度的增加,336 nm处HSA的最大荧光发射峰逐渐降低。野漆树苷仅引起HSA内在荧光有规律的猝灭,并未出现明显的发射波长红移、蓝移或峰形改变。
3.2 野漆树苷对HSA内在荧光猝灭的机制探讨 以F0/F对[Q]作图(Fig 2)得 KSV与 Kq,以 lg[(F0-F)/F]对 lg[Q]作图(Fig 3),得出药物与HSA的结合常数Ka和结合位点数n。根据 KSV与Ka随温度的变化可以对猝灭机制进行判断[12]。对于动态猝灭,温度升高有利于猝灭过程进行,KSV随温度的升高而增大;而静态猝灭,温度升高形成的复合物稳定性降低,Ka随温度的升高而减小。由Tab 1发现,野漆树苷的Ka都随温度升高而降低,Kq值均远大于各类猝灭剂对生物大分子的最大动态猝灭速率常数2.0×1010L·mol-1·s-1[13],表明野漆树苷对 HSA的荧光猝灭作用主要是其分子与HSA的Trp残基结合形成了某种特定结构的超分子复合物所引起的静态猝灭。
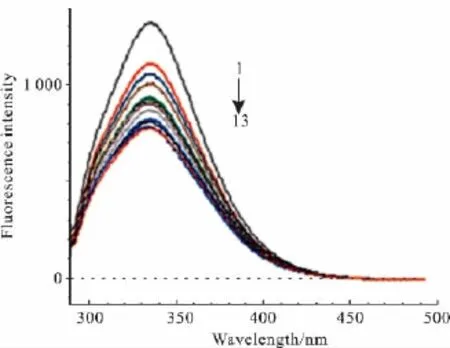
Fig 1 Effect of rhoifolin on fluorescence spectra of HSA at 37℃
3.3 野漆树苷与HSA的结合距离 根据HSA荧光发射光谱与野漆树苷吸收光谱的叠加图(Fig 4),计算得出 HSA与野漆树苷之间的结合距离为4.16 nm,小于7 nm。说明HSA(供能体)与野漆树苷(受能体)之间发生非辐射能量转移,推测其对HSA内在荧光的猝灭可能是通过分子间的能量转移而引起的。
3.4 野漆树苷与HSA的作用力类型 根据热力学公式,计算野漆树苷与HSA相互作用的热力学参数,见Tab 2。由Tab 2可知,野漆树苷与HSA的互相作用是氢键和范德华力结合为主的自发过程。
3.5 野漆树苷对 HSA同步荧光光谱的影响 △λ=15 nm和△λ=60 nm的同步荧光光谱分别显示酪氨酸残基和色氨酸残基特征[14]。芳香氨基酸残基的最大发射波长与其所处环境极性有关,由发射波长的改变可判断 HSA中芳香氨基酸残基所处微环境的变化。最大发射波长红移,表明芳香氨基酸残基所处微环境的疏水性降低,极性增强;蓝移则表明微环境的疏水性增强,极性降低。
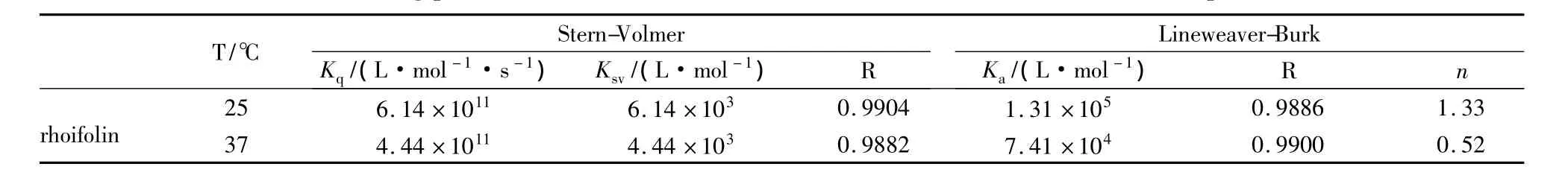
Tab 1 Fitting parameters of the interaction between HSA and rhoifolin at different temperature
同步荧光光谱(Fig 5)测定结果表明酪氨酸残基和色氨酸残基的特征荧光光谱峰均随野漆树苷浓度的增加而产生猝灭,野漆树苷的色氨酸残基和酪氨酸残基光谱最大发射波长基本没变,表明对应的HSA中色氨酸残基和酪氨酸残基附近的微环境并未改变。
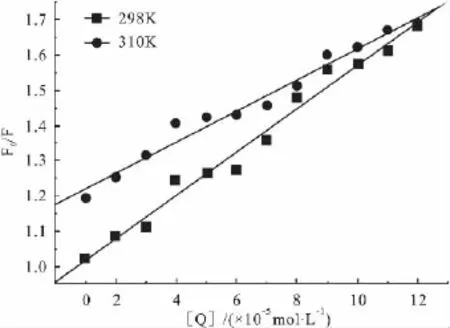
Fig 2 Stern-Volmer plots of the interaction between HSA and rhoifolin
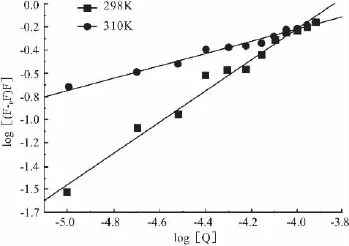
Fig 3 Lineweaver-Burk plots of the interaction between HSA and rhoifolin
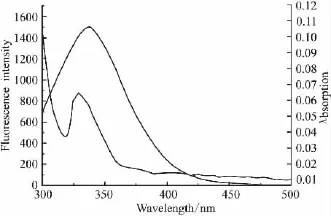
Fig 4 Overlap of absorption of rhoifolin with HSA fluorescence spectra

Tab 2 Thermodynamic parameters of interaction between HSA and rhoifolin
4 讨论
本实验采用光谱法研究了模拟生理条件下野漆树苷与HSA的相互作用。结果表明,静态猝灭是导致野漆树苷对HSA荧光猝灭的主要原因,两者互相作用以氢键和范德华力结合为主。与HSA的结合距离表明了HSA(供能体)与野漆树苷(受能体)之间可发生非辐射能量转移,它们对HSA内在荧光的猝灭可能是通过分子间的能量转移而引起的。
野漆树苷与HSA的同步荧光实验表明:野漆树苷的色氨酸残基和酪氨酸残基光谱最大发射波长基本没变,推测是由于它们的结合常数较小,不利于与ⅡA区域结合,从而未使蛋白质中色氨酸残基和酪氨酸残基的构象发生变化。随着野漆树苷的加入发现色氨酸残基荧光猝灭程度比酪氨酸残基荧光猝灭程度更为明显,表明HSA的荧光主要由色氨酸残基所贡献,野漆树苷与HSA结合位点更接近于色氨酸残基。
[1] 黄 芸,崔力剑,窦玉红,等.阿司匹林与人血清白蛋白的相互作用研究[J].中国药理学通报,2008,24(9):1192-5.
[1] Huang Y,Cui L J,Dou Y H,et al.Research on the interaction of mechanism between aspirin and human serum albumin[J].Chin Pharmacol Bull,2008,24(9):1192-5.
[2] Krisztina P,Jozsef M,Lajos H.High affinity binding of paclitaxel to human serum albumin[J].Eur J Biochem,2001,268(7):2187-91.
[3] Casagrande F,Darbon J M.Effects of structurally related flavonoids on cell cycle progression of human melanoma cells:regulation of cyclin-dependent kinases CDK2 and CDK1[J].Biochem Pharmacol,2001,61(10):1205-15.
[4] Davide B,Ersilia B,Corrado C,et al.Flavonoid composition and antioxidant activity of juices from Chinotto(Citrus-myrtifolia Raf.)fruits at different ripening stages[J].J Agric and Food Chem,2010,58(5):3031-6.
[5] Rajkumar S,Jebanesan A.Bioactivity of flavonoid compounds from Poncirus trifoliataL.(Family:Rutaceae)against the dengue vector,Aedes aegypti L.(Diptera:Culicidae)[J].Parasitol Res,2008,104(11):19-25.
[6] Yerra K R,Lee M J,Chen K,et al.Insulin-mimetic action of rhoifolin and cosmosiin isolated from citrus grandis(L.)osbeck leaves:enhanced adiponectin secretion and insulin receptor phosphorylation in 3T3-L1 cells[J].Evidence-Based Compl Altern Med,2011:1-9.
[7] 国家药典委员会.《中国药典》Ⅰ部[S].北京:化学工业出版社,2010:28.
[7] Chinese Pharmacopoeia Commission.Chinese pharmacopoeia Volume I[S].Beijing:Chinese Medical Science and Technology Press,2010,10(10):28.
[8] 尚永辉,李 华,孙家娟.荧光光谱法研究木犀草素、芹菜素或葛根素与牛血清白蛋白的相互作用机理[J].理化检验-化学分册,2011,47(2):186-90.
[8] Shang Y H,Li H,Sun J J.Fluorescence spectroscopic study on the mechanism of interaction of bovine serum albumin with luteolin,apigenin or puerarin[J].PTCA,2011,47(2):186-90.
[9] Liu J M,Yue Y Y,Liu M W,et al.Synthesis and interaction studies of benzimidazole derivative with human serum albumin[J].Spectrochim Acta Part A,2011,82:299-05.
[10]黄 芸,崔力剑,王建明,等.光谱法研究槲皮苷与人血清白蛋白的相互作用[J]. 中草药,2011,42(4):676-9.
[10] Huang Y,Cui L J,Wang J M,et al.Spectroscopic study on interaction of quercitrin with human serum albumin[J].Chin Tradit Herbal Drugs,2011,42(4):676-9.
[11] 黄 芸,崔力剑,陈 晨,等.黄芩素及黄芩苷与牛血清白蛋白结合作用比较研究及葡萄糖的影响[J].中国药理学通报,2010,26(6):754-8.
[11] Huang Y,Cui L J,Chen C,et al.The comparative studies on the interaction of baicalein and baicalin with bovine serum album in and the influence of glucose[J].Chin Pharmacol Bull,2010,26(6):754-8.
[12]郭 明,徐兴涛,吴志武.中药活性成分土大黄苷与人血清白蛋白的结合反应机制研究[J].药学学报,2011,46(9):1084-92.
[12] Guo M,Xu X T,Wu Z W.Binding mechanism of rhaponticin and human serum albumin[J].Acta Pharm Sin,2011,46(9):1084-92.
[13]梁 慧,赵 芳,李炳奇.光谱及电化学方法研究大黄酸与牛血清白蛋白的相互作用[J].光谱学与光谱分析,2011,31(9):2446-9.
[13] Liang H,Zhao F,Li B Q.Studies on the interaction of rhein with bovine serum albumin by spectroscopy and voltammetric methods[J].Spectroscopy Spectral Analysis,2011,31(9):2446-9.
[14]刘永春,胡之德.药物与蛋白质相互作用的荧光光谱法研究概述[J]. 宝鸡文理学院学报,2005,25(1):42-9.
[14] Liu Y C,Hu Z D.On the interaction between drugs and proteins by fluorescence spectroscopy[J].J Baoji Univ Arts Sci,2005,25(1):42-9.