HIV gp41融合多肽对抗原特异性Treg活化的抑制作用
2012-07-28胡义平贺龙刚李润明李珉珉张嘉杰刘叔文李晓娟
胡义平,贺龙刚,李润明,李珉珉,张嘉杰,刘叔文,李晓娟
(1.南方医科大学药学院,广东广州 510515;2.暨南大学附属第一医院,广东广州 510630)
HIV感染引起的艾滋病,在中国乃至全世界都属于重大疾病,却无有效的预防性疫苗。由于HIV主要感染CD4+T淋巴细胞,病毒与免疫细胞的相互作用是疾病研究的关键[1]。在CD4+T细胞,具有免疫抑制作用的CD4+CD25+Foxp3+调节性T细胞(Treg)与 HIV 感染密切相关[2-3]:Treg 比 CD4+记忆性T细胞更易感染HIV;感染早期,病毒抗原刺激产生的特异性Treg,聚集在人体内HIV复制的主要部位淋巴结;Treg数目在早期和进展病人中升高,随后不断减少,到艾滋病后期大量耗竭[4]。
HIV gp41融合多肽(fusion peptide,FP)可以插入CD4+T细胞膜,启动病毒与靶细胞膜的融合,实现病毒的感染[5]。此外,FP还能通过插入人和小鼠细胞膜,与TCR结合,影响抗原递呈细胞(antigen presenting cells,APC)递呈的活化信号与TCR交联,抑制抗原特异性CD4+T细胞的活化[6]。Treg活化也需要 TCR 的信号[7-8],然而 FP 能否因此影响抗原特异性的Treg细胞活化未见报道。
本研究中,我们分离DO11.10 OVA转基因小鼠CD4+CD25+Treg,用OVA刺激抗原特异性Treg细胞活化[9],观察FP多肽对Treg细胞活化后免疫抑制功能、相关细胞因子IL-10表达的影响;由于FP也可以插入小鼠的细胞膜[6],我们检测Treg细胞表面FP与TCR的共分布情况,初步探讨FP对抗原特异性Treg活化的影响。本研究将有助于深入理解HIV病毒与机体的相互作用。
1 材料与方法
1.1 材料 DO11.10转基因小鼠(♀,6~12周龄),购自南京大学遗传动物所,清洁级BALB/c近交系小鼠(♀性,6~8周龄)购自南方医科大学实验动物中心。RPMI 1640培养基,胎牛血清(fetal bovine serum,FBS)和β-二巯基乙醇购自美国Gibco公司产品。CCK-8(Cell Counting Kit-8)试剂盒购自日本Dojindo化学研究所,二抗AlexFluo 488 goatanti-mouse IgG2a购自美国 Invitrogen公司。Anti-Mouse DO11.10 TCR FITC(Clone:KJ1-26)、小鼠IL-10的ELISA检测试剂盒,CD4+CD25+Foxp3+调节性T细胞检测试剂盒购自美国eBioscience公司。CD4+CD25+调节性T细胞MACS磁珠分离试剂盒购自德国美天旎公司。FP1-25(AVGIGALFLGFLGAAGSTMGARSMTLTVQARQL)、FP-Rho、FP 对照多肽(VLGGGCALLRCIPALDSLTPANED,FP Scram)由以色列魏兹曼研究所 Yechiel Shai实验室提供。OVA323-339由上海强耀公司合成。
1.2 方法
1.2.1 CD4+CD25+调节性 T 细胞和 CD4+CD25-效应性T细胞的分离和检测 分离小鼠脾脏细胞,按MACS磁珠分离试剂盒说明书获得纯化的CD4+CD25-效应性T细胞(Teff)和CD4+CD25+Treg细胞;分离前后 CD4+CD25-、CD4+CD25+T细胞纯度用流式细胞仪检测,分离前Treg细胞Foxp3检测按试剂盒说明进行[10]。
1.2.2 CCK-8 法分析 CD4+CD25-效应性 T 细胞增殖 CD4+CD25-效应性T细胞按5×104/孔加入96孔板里,加或不加CD4+CD25+调节性 T细胞(2.5×104/孔),再加入3×105/孔丝裂霉素 C(mitomycin C)处 理 的 小 鼠 脾 细 胞 作 为 APC[11]。OVA323-339 终浓度为 100 μg·L-1,FP 和对照多肽为25 mg·L-1。培养3 d后,结束前4 h每孔加入20 μl CCK-8,每组设3个复孔,检测OD450反映CD4+CD25-T细胞增殖。由于Treg细胞具有免疫无能性,受抗原等刺激后不增殖,而经过丝裂霉素C处理后的小鼠脾细胞也失去增殖活性,在丝裂原等刺激下不增殖,只保留其递呈抗原的功能。因此,我们通过CCK-8法检测的主要是CD4+CD25-Teff细胞的增殖,同时反映出Treg体外抑制Teff增殖的功能。
1.2.3 ELISA分析 Treg细胞 IL-10的分泌 5×104个DO11.10小鼠 CD4+CD25+Treg细胞与3×105个 APC(同上)加入96孔板中,加 OVA323-339和FP多肽共培养,3 d后收集上清,ELISA检测上清IL-10分泌。
1.2.4 荧光共聚焦检测Treg细胞表面FP和TCR的分布 磁珠分离DO11.10 OVA Tg小鼠脾脏Treg,按5×104/孔加入96孔板,加入 3×105/孔丝裂霉素C处理的BALB/C小鼠脾脏细胞作为APC,加 OVA323-339 100μg·L-1刺激 3 d。收集细胞后用4%多聚甲醛固定,加抗DO11.10小鼠OVA TCR抗体和抗TCR抗体的二抗孵育,孵育的最后5 min加入FP-RHO。细胞用PBS离心冲洗后加到玻璃片上,荧光共聚焦检测细胞膜表面TCR和FP的分布情况。
2 结果
2.1 CD4+CD25+调节性T细胞和CD4+CD25-效应性T细胞的分离后纯度检测[11]磁珠分选前后进行细胞的流式细胞仪检测:Fig 1A为分选前的小鼠脾细胞CD4+CD25+调节性T细胞和CD4+CD25-效应性T细胞比例;以 CD4+CD25+双阳性圈出设门,分析Foxp3的表达(Fig 1B),表明CD4+CD25+T细胞确为高表达Foxp3的天然调节性T细胞。细胞经分选后,CD4+CD25-效应性T细胞和CD4+CD25+调节性T细胞纯度均可达90%以上(Fig 1C、D),进行后续实验。
2.2 FP对Treg细胞抑制功能的影响 结果表明,FP多肽本身对Teff细胞增殖具有抑制作用。Treg:Teff(1∶2)共培养时,Treg能够明显抑制Teff细胞的增殖,抑制率约为35.2%;而在FP 25 mg·L-1存在的情况下,Treg对Teff增殖的抑制降低,抑制率约为27.0%(Fig 1)。FP对照多肽无影响。
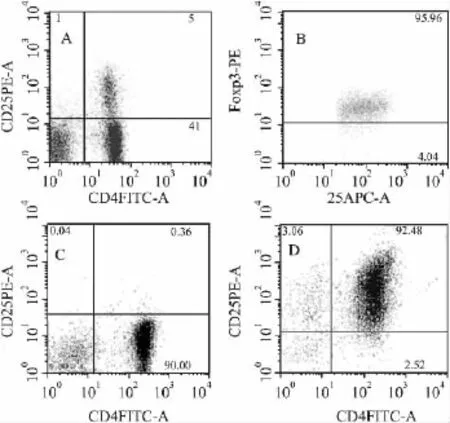
Fig 1 Foxp3 expression of CD4+CD25+regulatory T cells and purity test of Teff and Treg
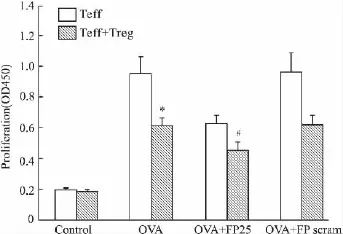
*P<0.05 vs OVA stimulated Teff group;#P<0.05 vs OVA+FP25 treated stimulated Teff+Teff group
2.3 FP对OVA激活的Treg细胞IL-10表达的影响 在Treg与APC共培养的情况下,10 μg·L-1和100 μg·L-1OVA能剂量依赖性刺激Treg分泌IL-10。FP 在25 mg·L-1的浓度时能明显抑制 100 μg·L-1OVA刺激的IL-10表达。FP对照多肽无作用(Fig 3)。
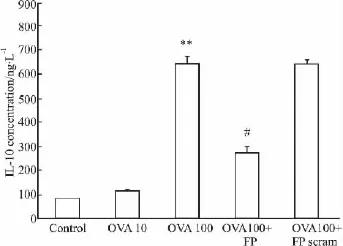
Fig 3 Effects of FP on IL-10 production in OVA activated Treg
2.4 FP在活化的Treg细胞表面能与TCR重叠OVA刺激后,在活化的OVA Tg小鼠分离的Treg细胞表面,TCR荧光呈半月形,FP和TCR分布一致,出现荧光的重叠,而在非活化细胞绿色荧光呈圆环型,表面未见红色荧光(Fig 4)。由于已知FP和TCR跨膜区能够互相结合[6],结果提示FP与TCR信号的重叠可能产生相互作用,从而影响APC向Treg递呈信号、干扰Treg活化。
3 讨论
HIV gp41融合多肽是启动病毒感染的重要多肽。HIV包膜蛋白gp120与靶细胞上CD4受体和辅助受体结合后,跨膜亚基gp41暴露出来,位于其N末端的FP可以插入靶细胞膜,启动N-端和C-端螺旋重复序列形成六聚体,拉近病毒和靶细胞膜的距离发生融合,从而使病毒基因组进入并感染宿主细胞[5]。
HIV主要感染CD4+的T淋巴细胞,它与宿主免疫细胞的相互作用是影响疾病发展的重要因素,也是影响疫苗成功的基础因素。近年有报道,FP能抑制抗原特异性的CD4+T细胞活化,并缓解抗原诱导的关节炎。FP对T细胞活化的作用是TCR依赖性的:它可以插入人和小鼠CD4+T细胞膜,与TCR的跨膜区结合,可能通过影响TCR、CD3分子的对话(cross-talk)发挥抑制作用。FP不影响抗原呈递细胞的功能,对非抗原特异性的包被抗CD3抗体或PMA/inomycin刺激的T细胞活化(两个系统均不依赖APC)无影响。因此,FP在插入靶细胞膜的时候,可能同时抑制了CD4+T细胞对HIV病毒抗原特异性的免疫应答[6]。占CD4+T细胞5% ~10%的调节性T细胞(CD4+CD25+Foxp3+,Treg)与HIV的感染和进展关系密切[12],Treg活化也离不开TCR[7-8],但是未知 FP 能否因此抑制抗原特异性的Treg活化。
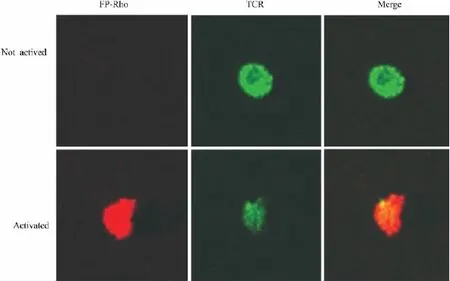
Fig 4 Colocalization of FP and TCR on activated Treg cells
我们研究发现FP在体外能减低抗原活化后Treg细胞的免疫抑制功能和IL-10分泌。由于Treg激活后可以通过细胞间直接接触或通过分泌IL-10、TGF-β等细胞因子对局部免疫产生抑制作用,提示FP减低Treg的抑制功能可能与降低IL-10的分泌有关[14]。另外,荧光共聚焦结果显示FP能插入OVA活化的Treg细胞表面,与TCR分布一致。由于TCR介导Treg的活化[15],Treg的激活通常也需要经过TCR和辅助信号刺激[7-8],提示 FP也可能通过与TCR结合影响APC递呈信号给TCR,从而抑制抗原刺激的Treg细胞活化和功能。
在HIV感染时,FP能插入Treg细胞膜,导致可能因此影响Treg功能和免疫应答,尤其是在Treg增多的情况下。由于在HIV感染的早期,淋巴结中存在病毒抗原特异性的Treg细胞活化;在不能良好控制病毒复制的HIV阳性感染者(Non-controllers)的肠道中存在升高的Treg细胞[13],FP对Treg的影响可能影响病毒感染的进程。Treg对HIV感染的影响可概括为好和坏两方面[3]:好的一面是Treg及其功能蛋白Foxp3能够抑制HIV病毒复制(HIV主要感染活化的细胞,并在活化的细胞内复制,而Treg抑制CD4效应T细胞活化),有助于控制慢性免疫激活和激活造成的T细胞死亡、免疫系统崩溃;坏的一面是Treg可抑制机体对HIV的免疫应答和清除,易于造成病毒的持续感染。
综上,HIV融合多肽能插入活化的Treg细胞表面,减弱抗原特异性的小鼠Treg细胞活化;FP对抗原特异性Treg细胞的影响,可能改变病毒和机体免疫细胞之间感染和抗感染力量的对比,影响艾滋病的疾病进展和疫苗免疫。
[1] Stevenson M.HIV-1 pathogenesis[J].Nat Med,2003,9(7):853-60.
[2] 苑 航,夏大静,曹雪涛.CD4+CD25+调节性T细胞与HIV感染关系研究进展[J].国际流行病学杂志,2006,33(2):83 -5.
[2] Yuan H,Xia D J,Cao X T.CD4+CD25+regulatory T cells in HIV infection[J].Int J Epid Infect Dis,2006,33(2):83 -5.
[3] Rouse B T,Sarangi P P,Suvas S.Regulatory T cells in virus infections[J].Immunol Rev,2006,212:272 -86.
[4] Nilsson J,Boasso A,Velilla P A,et al.HIV-1-driven regulatory T-cell accumulation in lymphoid tissuses is associated with disease progression in HIV/AIDS[J].Blood,2006,108(12):3808 -17.
[5] Liu S,Jing W,Cheung B,et al.HIV gp41 C-terminal heptad repeat contains multifunctional domains.Relation to mechanisms of action of anti-HIV peptides[J].J Biol Chem,2007,282(13):9612-20.
[6] Quintana F J,Gerber D,Cohen I R,et al.HIV-1 fusion peptide targets the TCR and inhibits antigen-specific T-cell activation[J].J Clin Invest,2005,115:2149 - 51.
[7] Fontenot J D,Rudensky A Y.A well adapted regulatory contrivance:regulatory T cell development and the forkhead family transcription factor Foxp3[J].Nat Immunol,2005,6(4):331 -7.
[8] Sakaguchi S.Naturally arising Foxp3-expressing CD25+CD4+regulatory T cells in immunological tolerance to self and nonself[J].Nat Immunol,2005,6(4):345 -52.
[9] Takahashi T,Kuniyasu Y,Toda M,et al.Immunologic self-tolerance maintained by CD25+CD4+naturally anergic and suppressive T cells:induction of autoimmune disease by breaking their anergic/suppressive state[J].Int Immunol,1998,10(12):1969 -80.
[10]李晓娟,胡义平,刘 燕,等.TF3-H4对CD4+CD25+调节性T细胞和CD4+CD25-效应性T细胞早期活化的影响[J].中国药理学通报,2012,28(3),421 -4.
[10] Li X J,Hu Y P,Liu Y,et al.Effects of TF-3-H4 on the early activation of CD4+CD25+Treg cells and CD4+CD25-Teff cells in mice by flow cytometry[J].Chin Pharmacol Bull,2012,28(3),421-4.
[11] Li X,Hu Y,He L,et al.Icaritin inhibits T cell activation and prolongs skin allograft survival in mice[J].Int Immunopharmcol,2012,13(1):1-7.
[12] Suchard M S,Mayne E,Green V A,et al.FOXP3 expression is upregulated in CD4 T cells in progressive HIV-1 infection and is a marker of disease severity[J].PLoS One,2010,5(7):e11762.
[13] Shaw J M,Hunt P W,Critchfield J W,et al.Increased frequency of regulatory T cells accompanies increased immune activation in rectal mucosae of HIV-positive noncontrollers[J].J Virol,2011,85(21):11422-34.
[14] Torheim E A,Ndhlovu L C,Pettersen F O,et al.Interleukin-10-secreting T cells define a suppressive subset within the HIV-1-specific T-cell population[J].Eur J Immunol,2009,39(5):1280 -7.
[15] Moran A E,Holzapfel K L,Xing Y,et al.T cell receptor signal strength in Treg and iNKT cell development demonstrated by a novel fluorescent reporter mouse[J].J Exp Med,2011,208(6):1279-89.