白藜芦醇预处理对局灶性脑缺血/再灌注大鼠海马CA1区神经元凋亡的保护作用和机制
2012-07-28王烈成柯道平朱洁平
方 芳,李 珍,王烈成,祝 延,2,周 艺,柯道平,朱洁平
(1.安徽医科大学生理学教研室,安徽 合肥 230032;2.蚌埠医学院生理学教研室,安徽蚌埠 233000;3.安徽医科大学附属六安医院,安徽 六安 237000;4.皖西卫生职业学院,安徽 六安 237000)
脑缺血性疾病是神经系统常见病症,其中以缺血/再灌注后导致神经元凋亡所引起的继发性脑损伤危害最大,常导致严重的神经功能障碍[1]。如何降低脑缺血病人的发病率,减少缺血所致神经细胞的凋亡,提高病人的存活率,是目前预防脑缺血性疾病急需解决的问题。白藜芦醇(resveratrol,Res)是广泛存在于葡萄、虎杖、花生、决明等植物性食物或药物中的多酚类化合物,近年来的研究表明Res对人体许多重要器官,比如肾脏、脑、心脏的缺血损伤都具有保护作用[2-3]。而缺血预处理可以减少脑缺血性损伤,减少细胞的凋亡及坏死[4]。我们近期的研究证明Res预处理对脑缺血/再灌注具有一定的神经保护作用[5],但其保护作用机制是否涉及到凋亡及其相应的信号转导通路,目前尚未见报道。为此,我们利用TUNEL法和免疫组化法对大鼠海马CA1区神经元凋亡及相应凋亡蛋白进行检测,以期能够对Res的神经保护作用机制进行进一步探讨,从而为临床研发预防脑血管疾病的新药提供实验依据。
1 材料与方法
1.1 主要试剂、仪器 白藜芦醇,Sigma公司;兔抗鼠 Caspase-3、PI3K、p-Akt多克隆抗体均购自 Bioworld公司;细胞凋亡原位检测试剂盒(In Situ Cell Death Detection Kit,POD),Roche 公司;光学显微镜及其拍照分析系统,日本Olympus公司。
1.2 动物分组 ♂SD大鼠60只(220~250 g),由安徽医科大学实验动物中心提供,随机分为3组:假手术组(Sham)、缺血/再灌注组(I/R)、白藜芦醇预处理组(Res+I/R),每组20只。假手术组大鼠只分离血管,不留置拴线;I/R组大鼠采用栓线法阻塞右侧大脑中动脉,90 min后拔出拴线给予再灌注;Res+I/R组大鼠在缺血前1 h腹腔注射Res(30 mg·kg-1)。
1.3 方法
1.3.1 局灶性脑缺血模型制备[6]采用颈内动脉栓线法制备大脑中动脉阻塞(middle cerebral artery occlusion,MCAO)脑缺血模型。大鼠用10%水合氯醛(300 mg·kg-1,i p)麻醉后,仰卧位固定于手术台上,颈部正中切口,分离右侧颈总动脉、颈外动脉、颈内动脉,轻轻剥离迷走神经,结扎颈外动脉和颈内动脉上的所有分支。颈总动脉切口,插入直径为0.26 mm的MCAO栓线(购自北京沙东生物技术有限公司),转过颈总动脉分叉进入颈内动脉,然后缓缓插入,至有轻微阻力时为止(自分叉处约20 mm),阻断大脑中动脉的所有血供。缺血90 min后,轻轻拔出MCAO栓线,恢复血供进行再灌注。在实验过程中保持动物体温(37±0.5)℃。
1.3.2 模型筛选标准 再灌注后22 h,按Bederson方法[7]进行肢体功能的神经缺损评分,标准:0分,无任何神经功能损失;1分,提尾左前肢屈曲内收;2分,向左侧行走;3分,向左侧转圈,成追尾状。只有评分在1分以上,且取脑时脑底无凝血块,动脉环无血栓形成,排除蛛网膜下腔出血和继发性血栓形成的大鼠才可被选入继后的实验组。I/R组和Res组共40只动物,其中2只因麻醉意外死亡,3只线栓推进失败,实际观察35只,出现上述神经病学症状31只,成功率为88.57%。
1.3.3 TTC染色测定梗死范围 按照朱东亚报道的方法测定梗死范围[8]。再灌注后24 h,动物断头取脑,去嗅球、小脑和脑干,用生理盐水冲洗大脑表面血污,吸干,–20℃冷冻5~10 min使之变硬,沿冠状面切成1.5 mm厚的脑片,置于2%的TTC染液中37℃染色30 min。正常组织呈鲜红色,梗死组织呈灰白色。将显色后的脑切片置于4%多聚甲醛溶液中固定24 h,细心将梗死区挖下,称重,以梗死组织的重量占缺血侧脑重量的百分比作为相对梗死范围。
1.3.4 原位细胞凋亡检测(TUNEL法)在缺血/再灌注后第5天,用10%水合氯醛(300 mg·kg-1,i p)麻醉后,经心脏灌注4%多聚甲醛固定至大鼠四肢僵硬,取出缺血侧大脑放入相应固定液中于4℃冰箱中固定过夜。截取视交叉至大脑横裂的部分,常规石蜡包埋,连续冠状切片,片厚 4 μm。按TUNEL检测试剂盒进行操作,DAB显色,苏木精复染。采用Image Pro Plus 6.0图像分析软件,计数400倍视野下缺血侧海马CA1区凋亡阳性细胞数,每个标本取4张切片,每张切片海马CA1区选5个不重叠的高倍视野,取平均值。
1.3.5 免疫组织化学检测 PI3K、p-Akt,Caspase-3的表达每只动物取上述石蜡标本连续切片各3张,采用过氧化物酶标记的链霉卵白素(SP)法进行免疫组化染色和DAB显色法显色。每张切片在400倍视野下随机选取缺血侧海马CA1区5个不重叠的高倍视野,采用Image Pro Plus 6.0图像分析软件对结果进行定量分析,测定平均光密度值(OD)。
2 结果
2.1 白藜芦醇预处理降低脑缺血/再灌注大鼠神经功能评分及减少脑梗死体积 I/R组大鼠神经学评分平均为2.6±0.13,明显高于Sham组评分(P<0.05),而缺血前1 h进行Res预处理可明显改善脑缺血大鼠的神经行为学障碍(P<0.05),见Fig 1A。TTC染色结果显示,Sham组大鼠脑组织全部染成红色,未发现梗死灶。I/R组大鼠缺血侧梗死范围为(37.2±3.8)%,而缺血前1 h进行Res预处理的Res+I/R组大鼠缺血侧梗死范围为(16.3±2.6)%,与I/R组大鼠缺血侧梗死范围相比明显减少(P <0.05),见 Fig 1B。
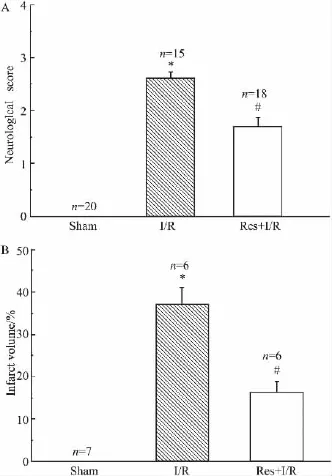
Fig 1 Effects of resveratrol pretreatment on neurological score and infarction volume
2.2 白藜芦醇预处理明显减少了海马CA1区神经细胞的凋亡 经TUNEL染色和苏木精复染后大鼠海马CA1区凋亡细胞以细胞核染成棕黄色为主。在Sham组,海马CA1区偶见TUNEL阳性细胞,表达于细胞核内。与Sham组比较,I/R组海马CA1区凋亡细胞数量明显增多(P<0.01);而缺血前1 h进行Res预处理,可以明显减少凋亡细胞数量(P<0.05),见 Fig 2A,2B。
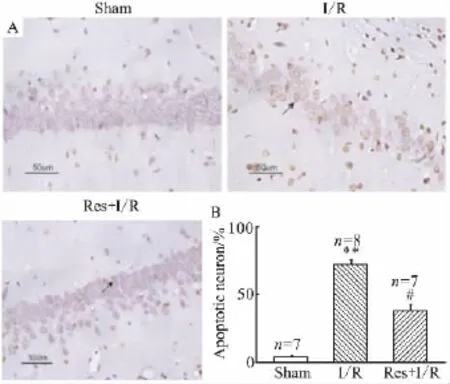
Fig 2 Resveratrol protects neurons from focal cerebral ischemia-induced apoptosis(TUNEL staining×400)
2.3 白藜芦醇预处理对大鼠海马CA1区PI3K、p-Akt表达的影响 各组大鼠海马CA1区免疫组织化学检测结果显示,PI3K、p-Akt蛋白的阳性细胞染色均以胞质有棕黄色物质沉积为主,并可显示细胞轮廓。结果显示Sham组大鼠海马CA1区可见较多呈点状分布的p-Akt阳性细胞,几乎无PI3K阳性细胞。与Sham组比较,I/R组海马CA1区PI3K阳性细胞差异没有显著性(P>0.05),但p-Akt阳性细胞数量明显减少(P<0.05),见Fig 3。而缺血前1 h进行Res预处理的Res+I/R组大鼠,海马CA1区PI3K及p-Akt表达均明显增多(P<0.05),见Fig 3和Tab 1。说明Res通过诱导PI3K的表达增高进一步诱导下游p-Akt水平的增高。
Tab 1 Expressions of PI3K and p-Akt proteins in hippocampal CA1 region(±s,n=8)
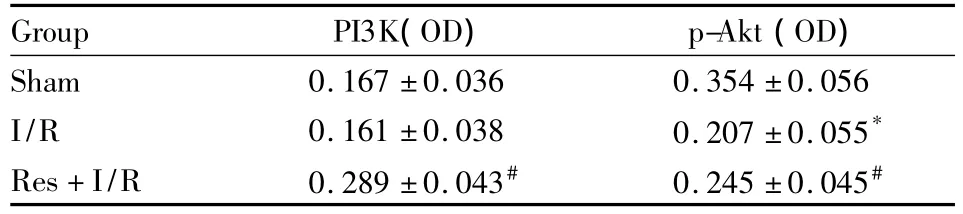
Tab 1 Expressions of PI3K and p-Akt proteins in hippocampal CA1 region(±s,n=8)
*P<0.05 vs sham group;#P<0.05 vs I/R group
Group PI3K(OD)p-Akt(OD)Sham 0.167 ±0.036 0.354 ±0.056 I/R 0.161 ±0.038 0.207 ±0.055*Res+I/R 0.289 ±0.043# 0.245 ±0.045#
2.4 白藜芦醇预处理对大鼠海马CA1区Caspase-3表达的影响 免疫组织化学结果显示,Sham组大鼠海马CA1区仅见极少数Caspase-3蛋白的阳性染色胞质;脑缺血/再灌注后第5天,与Sham组比较,I/R组大鼠海马CA1区Caspase-3表达明显增多(P<0.05),见Fig 4和Tab 2,染色呈棕黄或深褐色;而在缺血前1 h进行Res预处理的Res+I/R组大鼠,海马CA1区Caspase-3表达明显减少(P<0.05),见Fig 4和 Tab 2。
Tab 2 Expression of Caspase-3 protein in hippocampal CA1 region(±s,n=8)

Tab 2 Expression of Caspase-3 protein in hippocampal CA1 region(±s,n=8)
*P<0.05 vs sham group;#P<0.05 vs I/R group
Group Caspase-3(OD)Sham 0.256 ±0.0923 I/R 0.552 ±0.0958*Res+I/R 0.341 ±0.0765#
3 讨论
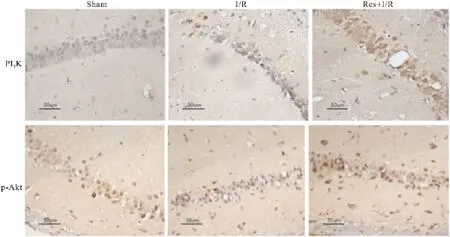
Fig 3 PI3K and p-Akt positive cells in hippocampal CA1 region shown by immunohistochemical assay(×400)
脑缺血/再灌注损伤是一个复杂的病理生理过程,如出现大量的氧自由基、细胞内Ca2+超载、能量障碍、兴奋性氨基酸释放增加等[9],这些环节都可通过启动凋亡相关基因、诱导凋亡信号转导通路,最终导致神经元的凋亡或坏死[10]。海马是学习记忆的重要脑区之一,海马CA1区对缺氧缺血特别敏感[11]。和以往的研究一致,我们的实验结果也表明,局灶性脑缺血/再灌注导致海马CA1区神经元出现大面积凋亡。近年来的研究表明Res能够通过多种机制对缺血性损伤发挥保护作用,包括抗氧化、清除自由基、抗凋亡等[12]。但Res具体是通过何种信号转导机制对脑缺血/再灌注导致的海马CA1区神经元凋亡发挥保护作用的,目前还鲜有这方面的报道。
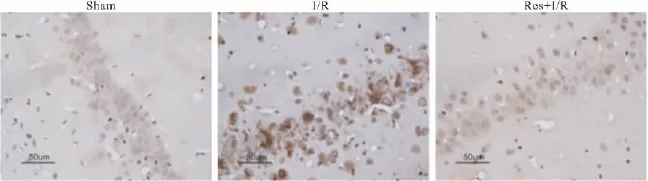
Fig 4 Caspase-3 positive cells in hippocampal CA1 region shown by immunohistochemical assay(×400)
Akt是一种丝氨酸/苏氨酸激酶,它是磷酸化肌醇磷脂3位羟基的激酶(phosphoinositide 3-kinase,PI3K)下游靶分子最重要的效应介质。Akt的活化直接或间接影响多种转录因子的表达和促凋亡蛋白活性,增强抗凋亡基因的表达和抑制细胞凋亡蛋白活性,参与生长、发育、分化和细胞的存活[13]。Noshita等[14]应用荧光双染技术显示脑缺血后Akt阳性细胞不是凋亡细胞,指出PI3K/Akt信号活化可以促进细胞存活减少凋亡。Lesne等[15]发现,脑缺血早期给予外源性营养因子可减少缺血脑组织的损伤,与提高缺血周围区Akt的表达有关。本研究结果显示,与I/R组相比,Res预处理使脑缺血大鼠海马CA1区细胞凋亡数量明显减少、PI3K和p-Akt数量明显增多,这和以往的研究结果是一致的,并提示Res有类似于外源性营养因子的作用,通过激活PI3K/Akt信号转导通路,发挥细胞存活和对抗凋亡的作用。近年来的研究发现Caspase-3参与了脑缺血后神经元损伤的病理过程,它的激活是凋亡的关键步骤,是凋亡的最终执行者[16]。活化后的Caspase-3可以切割许多蛋白质底物,使细胞内一些参与DNA修复、mRNA剪切和DNA复制的蛋白失活,从而使细胞丧失修复功能,稳态不能正常进行。而活化的Akt通过磷酸化作用,可以抑制下游效应分子Caspase-3的活性,进而发挥调节细胞存活、增殖和分化等作用[17]。West等[18]发现 Res预处理通过减少Caspase-3的激活,对新生儿缺氧缺血性脑损伤发挥保护作用。我们实验中也发现,局灶性脑缺血导致海马CA1区Caspase-3表达明显增加,Res预处理使缺血大鼠海马CA1区Caspase-3表达明显降低,这和以往的实验结果是一致的。
综上所述,本研究发现Res预处理对局灶性脑缺血/再灌注导致的大鼠海马CA1区神经元凋亡具有保护作用。其主要作用机制可能是通过激活PI3K-Akt信号通路,使p-Akt的水平增加,进而抑制下游效应分子Caspase-3蛋白的激活来发挥神经保护作用的,但具体的机制亟待进行更深入的研究。
[1] Doyle K P,Simon R P,Stenzel-poore M P.Mechanisms of ischemic brain damge[J].Neuropharmacology,2008,55(3):310 - 8.
[2] Bastinaetto S,Zheng WH,Quirion R.Neuroprotective abilities of resveratrol and other red wine constituents against nitric oxide-related toxicity in cultured hippocampal neurons[J].Br J Pharmacol,2000,131(4):711 -20.
[3] Chander V,Chopra K.Protective effect of nitric oxide pathway in resveratrol renal ischemia-reperfusion injury in rat[J].Arch Med Res,2006,37(1):19 -26.
[4] Gross G J,Fryer R M.Mitochondrial K(ATP)channels:triggers or distal effectors of ischemic or pharmacologocal preconditioning[J].Circ Res,2000,87(6):431 -3.
[5] 李 珍,王斌生,孔德虎,王烈成.白藜芦醇预处理对大鼠局灶性脑缺血∕再灌注损伤的神经保护作用[J].中国药理学通报,2010,26(6):802-6.
[5] Li Z,Wang B S,Kong D H,Wang L C.Neuroprotective effects of preconditioning with resveratrol on focal cerebral ischemia-reperfusion injury in rats[J].Chin Pharmacol Bull,2010,26(6):802-6.
[6] Zhu D Y,Li R,Liu G Q,et al.Nimodipine inhibitscalcium-independent nitric oxide synthase activity in transient focal cerebral ischemia rats and cultured mouse astroglial cells[J].Life Sci,1999,65:221-31.
[7] Bederson J B,Pitts L H,Tsuji M,et al.Rat middle cerebral artery occlusion:evaluation of the model and development of a neurologic examination[J].Stroke,1986,17(3):472 -6.
[8] Zhu D Y,Liu S H,Sun H S,Lu Y M.Expression of inducible nitric oxide synthase after focal cerebral ischemia stimulates neurogensis in the adult bodfent dentate gyrus[J].J Neurosci,2003,23(1):223-9.
[9] Turley K R,Toledo-Pereyra L H,Kothari R U.Molecular mechanisms in the pathogenesis and treatment of acute ischemic stroke[J].J Invest Surg,2005,18:207 -18.
[10] Kotake Y,Yamamoto M,Matsumoto M,et al.Sivelestat,a neutrophil elastase inhibitor,attenuates neutrophil priming after hepatoenteric ischemia in rabbits[J].Shock,2005,23(2):156 -60.
[11] Li Z,Cui S Z,Zhang Z,et al.DHEA-neuroprotection and –neurotoxicity after transient cerebral ischemia in rats[J].J Cereb Blood Flow Metab,2009,29(2):287-96.
[12] Elmali N,Esenkayal I,Karadag N,et al.Effects of resveratrol on skeletal muscle in ischemia-reperfusion injury[J].Ulus Travma Acil Cerrahi Derg.2007,13(4):274-80.
[13] Viscomi M T,Oddi S,Latin L,et al.Selective CB2 receptor agonism protects central neurons from remote axtomy-induced apoptosis through the PI3K/Akt pathway[J].J Neurosci.2009,29(14):4564-70.
[14] Noshita N,Lewen A,Sugawara T,et al.Evidence of phosphorylation of Akt and neuronal survival after transient focal cerebral ischemia in mice[J].J Cereb Blood Flow Metab,2001,21(12):1442-50.
[15] Lesne S,Gabriel C,Nelson DA,et al.Akt-dependent expression of NAIP-1 protects neurons against amyloid-beta toxicity[J].J Boil Chem,2005,280(26):24941-7.
[16]李 琴,郭云良,李 霞,等.胡黄连苷Ⅱ对大鼠脑缺血/再灌注损伤Caspase-3和PARR表达的影响[J].中国药理学通报,2010,26(3):342-5.
[16] Li Q,Guo Y L,Li X,et al.The interterence of picrosideⅡ on the expressions Caspase-3 and PARR following cerebral ischemia reperfusion injury in rats[J].Chin Pharmacol Bull,2010,26(3):342-5.
[17] Smolock E M,Korshunov V A.Pharmacological inhibition of Axl affects smooth muscle cell functions under oxidative stress[J].Vascul Pharmacol,2010,53(3-4):185-92.
[18] West T,Atzeva M,Holtzman D M.Pomegranate polyphenols and resveratrol protect the neonatal brain against hypoxic-ischemic injury[J].Dev Neurosci,2007,29(4 -5):363 -72.