绞股蓝总皂苷对HDL-CE诱导的HepG2细胞SR-BⅠ受体表达的影响
2012-07-28王萍儿卢德赵林韬琦沃兴德
王萍儿,卢德赵,林韬琦,杨 贞,沃兴德
(浙江中医药大学生命科学学院,浙江杭州 310053)
动脉粥样硬化(atherosclerosis,AS)是常见的严重危害人类健康的动脉慢性炎症性疾病。主要的病因为胆固醇在外周血管中大量积聚,出现脂质代谢紊乱,引起内膜灶性纤维性增厚及粥样斑块形成,继而引发动脉粥样硬化[1-2]。肝脏是胆固醇代谢的最主要器官,如何促进肝脏清除体内过多的胆固醇,减少胆固醇在血管内壁的沉积是预防和治疗AS的关键[3]。
绞股蓝(gynostemma pentaphyllum,GP)为葫芦科绞股蓝属植物绞股蓝的根状茎或全草,味甘苦、性寒,有清热解毒、化痰止咳、益气健脾之功效[4]。绞股蓝总皂苷(gypenosides,GPS)是绞股蓝最主要的生物活性成分之一,能够有效地保护心脑血管和肝脏、降低血脂和胆固醇、消除自由基,促进肝细胞LDL-R 的表达[5],具有良好的抗 AS 作用[6-7]。本研究拟以HepG2细胞为研究对象,探讨在高脂环境中绞股蓝总皂苷对胆固醇逆运转过程中起重要作用的清道夫受体SR-B1表达的影响,为绞股蓝总皂苷抗AS作用机制的研究和临床应用提供实验依据。
1 材料与方法
1.1 实验材料 HepG2细胞株从中国科学院上海细胞库购买;培养液RPMI 1640、胎牛血清购于杭州四季青生物工程材料研究所;绞股蓝总皂苷(产品批号:20101026)购于安徽芜湖甙尔塔研究所;总胆固醇和游离胆固醇试剂盒从宁波塞克生物技术有限公司购买;细胞膜蛋白抽提试剂盒购于碧云天生物技术研究所;β-actin、SR-BⅠ羊抗兔抗体均购于Santa Cruz公司;eECL Western blot Kit试剂购自北京康为世纪生物科技有限公司;SR-BⅠmRNA引物合成自上海生工生物工程有限公司;PCR、逆转录试剂试剂均购自TaKaRa大连宝生物工程有限公司,SsoFast EvaGreen Supermix试剂购自美国Bio-Rad公司。
1.2 实验仪器 P80MX超速离心机购自日本Hitachi公司,SpectraMax M3酶标仪购自美国MD公司,AKTA液相色谱仪购自美国GE公司,细胞培养箱购自德国Heraeus公司,DM IL型倒置荧光显微镜购自德国 Leica公司,IQ5荧光定量 PCR仪、SDSPAGE电泳仪、WB转膜仪、凝胶成像仪均购自美国Bio-Rad公司。
1.3 HDL-CE的提取 取健康人血清经序列超速离心法分离密度1.063-1.125 kg·L-1的 HDL-CE粗提物,经Sepharose 6B凝胶层析法分离纯化HDLCE。将纯化的HDL-CE转入截留小分子的透析袋中,用PBS缓冲液透析24 h,PEG20000浓缩后用Lowery法测定蛋白浓度,4℃保存。
1.4 细胞培养及细胞增殖活力的检测 HepG2细胞用含10%胎牛血清的RPMI 1640培养基培养于37℃、5%CO2的培养箱中,当细胞汇合度达80%~90%时进行传代培养或进行后续试验。将细胞以1.0×104个/孔密度传代培养于96孔板中,贴壁培养8 h,加入不同剂量的绞股蓝总皂苷,使其终浓度为30、60、90、120、150、180、210、240、270、300、400 mg·L-1,每个浓度设6个重复,同时加入HDL-CE(终浓度为300 mg·L-1)进行共孵育培养,每孔终体积为200 μl。作用24 h后每孔中加入20 μl 5 g·L-1MTT暗室孵育4 h,弃去培养液,加入150 μl DMSO/孔,震荡混匀沉积在孔底的蓝紫色结晶甲臜,并在10 min内于570 nm波长处检测各孔吸光度值(OD570),确定绞股蓝总皂苷对高脂环境下的HepG2细胞增殖的影响。
1.5 油红O染色 将细胞以4.0×106个/孔密度传代培养于6孔板中,贴壁培养8 h。随机分为对照组(正常培养 HepG2细胞)、模型组(300 mg·L-1HDL-CE处理HepG2细胞24 h)、洛伐他汀组(300 mg·L-1HDL-CE、20 μmol·L-1洛伐他汀与 HepG2细胞共孵育24 h)、GPS处理组(300 mg·L-1HDLCE、不同浓度绞股蓝总苷皂苷与HepG2细胞共孵育24 h)。用PBS缓冲液清洗3次,加入10%甲醛磷酸缓冲液固定20 min,PBS轻轻洗3次,用油红O染色30 min,再用60%的异丙醇固定5 min,立即用PBS清洗3次,显微镜下观察荷脂细胞形态及脂滴分布情况。
1.6 细胞内总胆固醇和胆固醇酯的测定 将细胞以1.0×107个/孔密度传代培养于25 cm2细胞培养瓶中,贴壁培养8 h,实验分组“同1.5”,各组细胞用预冷PBS清洗5次,细胞刮刀轻柔刮下细胞,分别转移至1.5 ml的EP管中,用无水乙醇超声破碎萃取细胞内胆固醇,参照总胆固醇(TC)和游离胆固醇(FC)检测试剂盒操作说明书,测定细胞内TC和FC的含量,计算细胞内胆固醇酯(CE)的含量,并根据CE=TC-FC,求出荷脂细胞内CE的含量。
1.7 Real-time PCR检测SR-BⅠ的mRNA表达按TRIzol试剂盒说明书一步法提取各处理组细胞(实验分组同“1.5”)总RNA,用核酸蛋白分析仪测RNA在260 nm和280 nm的吸光度(A)值,使A260/A280的比值介于1.8~2.2之间。并根据260 nm的A值对样品的总RNA进行初步定量,并用Invitrogen逆转录试剂盒合成 cDNA,再通过引物进行荧光定量PCR扩增。包括β-actin引物:上游5'-CTGACCCTGAAGTACCCCATT-3',下 游:5'-TCTGCGCAAGTTAGGTTTTGT-3',扩增产物长度为324 bp;SR-BⅠ引物:上游5'-GGCGGTGATGATGGAGAAT-3',下游 5'-TGAAGAGCCCAGAGTCGGA-3',PCR 扩增产物长度为 227 bp。采用 Bio-Rad SsoFast EvaGreen Supermix荧光预混液于Bio-Rad iQTM5多重实时荧光定量PCR仪系统来检测上述引物产品的mRNA表达量,实验结果以β-actin的mRNA进行标准化。
1.8 Western blot检测SR-BⅠ的蛋白质表达 各实验组细胞用预冷的PBS缓冲液清洗5次,收集细胞后按照细胞膜蛋白抽提试剂盒提取各实验组膜蛋白,并用BCA蛋白定量试剂盒测定蛋白浓度。一定量的膜蛋白样品与上样缓冲液按比例混合后煮沸5 min,SDS-PAGE电泳80 V恒压2 h,WB湿转(0.45 μm的PVDF膜)200 mA恒流2 h,5%脱脂牛奶室温封闭2 h,TBST漂洗3次后分别加入一抗SR-BⅠ(1∶200稀释)和β-actin(1∶600稀释)4℃孵育过夜,TBST漂洗3次,于37℃二抗(1∶1 000)反应2 h后进行ECL显色。用美国Bio-Rad公司的凝胶成像分析系统分析WB电泳条带,以β-actin作为内参,计算各处理组目的蛋白SR-B1的表达情况。
2 结果
2.1 绞股蓝总皂苷对HepG2源性荷脂细胞增殖活力的影响 MTT实验结果显示,与对照组相比较,0~120 mg·L-1绞股蓝总皂苷对HepG2源性荷脂细胞增殖无影响,大于120 mg·L-1时出现对细胞增殖的抑制作用(Fig 1)。
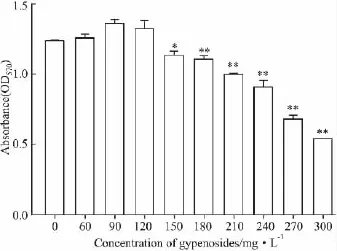
Fig 1 Effects of gypenosides on proliferation of HepG2-derived cholesterol-road cell
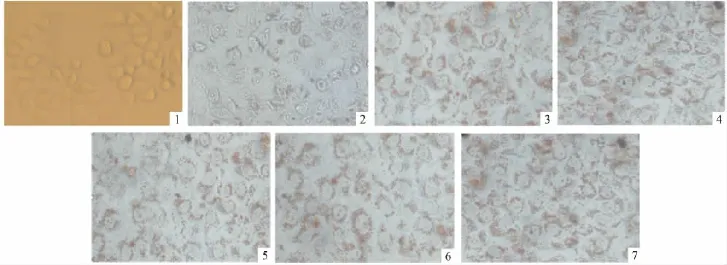
Fig 2 Oil red O staining maps of HepG2 cell(10×40)
2.2 细胞形态观察及油红O染色 倒置显微镜观察对照组HepG2贴壁细胞呈不规则形,胞质凸出饱满,轮廓清晰。模型组细胞、洛伐他汀组细胞、GPS处理组细胞边缘不光滑,胞质不凸出,细胞折光度下降。油红O染色观察胞内脂滴分布情况(Fig 2),发现与对照组比较,各组胞内脂滴明显增多,染色后细胞边缘呈红色“手环状”,细胞中央出现红色小颗粒,且镜下观察显示模型组、洛伐他汀组、GPS处理组细胞内脂滴含量差异无显著性。
2.3 绞股蓝总皂苷对HepG2胞HDL-CE脂质摄取的影响 实验结果显示(Fig 3),与对照组相比较,模型组(P<0.05)、洛伐他汀组(P <0.01)、GPS处理组(P<0.01)细胞内TC含量明显增加;与模型组相比较,洛伐他汀组和GPS处理组细胞内TC含量差异均无显著(P>0.05);且所有实验组间细胞内FC含量无差异(P>0.05)。说明300 mg·L-1HDL-CE孵育细胞24 h可能是通过增加细胞内CE的含量来提高胞内TC的水平,使细胞处于一种高脂状态,20 μmol·L-1洛伐他汀和不同浓度 GPS 作用于高脂环境中的HepG2细胞后胞内脂质含量仍处于较高水平。
2.4 绞股蓝总皂苷对HepG2细胞SR-BⅠmRNA表达的影响 与对照组SR-BⅠ mRNA水平比较,模型组SR-BⅠ mRNA水平明显增加,而洛伐他汀组SR-BⅠmRNA的表达却降低了,60和240 mg·L-1GPS处理组SR-BⅠ mRNA的表达差异无显著性,120 mg·L-1GPS处理组SR-BⅠ mRNA的表达增加。与模型组比较,除120 mg·L-1GPS处理组SR-BⅠmRNA表达下降不明显外,洛伐他汀组和其余GPS处理组细胞的SR-BⅠ mRNA表达均明显下降(Fig 4)。
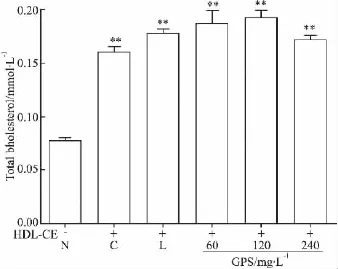
Fig 3 Effects of gypenosides on content of intracellular TC
2.5 绞股蓝总皂苷对HepG2细胞SR-BⅠ蛋白表达的影响 应用免疫印迹法对各组细胞SR-BⅠ蛋白表达进行检测。实验结果显示β-actin蛋白条带均一(Fig 5),可用于实验数据分析。与对照组比较,模型组SR-BⅠ蛋白表达明显增加,说明HDL-CE可以上调HepG2细胞SR-BⅠ蛋白的表达,60 mg·L-1GPS处理组SR-BⅠ蛋白的表达水平无差异,120、240 mg·L-1GPS处理组SR-BⅠ蛋白的表达水平均降低;而与模型组相比较,GPS各处理组SR-BⅠ蛋白的表达水平均降低,说明GPS可以剂量依赖性下调高脂环境中HepG2细胞SR-BⅠ蛋白的表达。
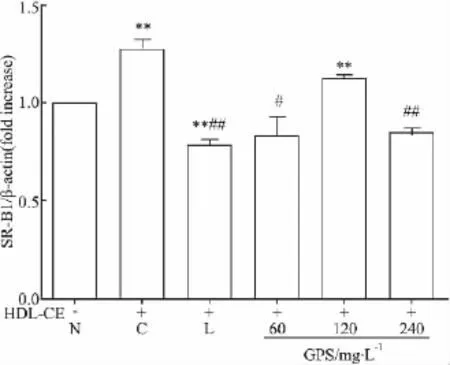
Fig 4 Effects of GPS on SR-BⅠmRNA expression in HepG2 cell
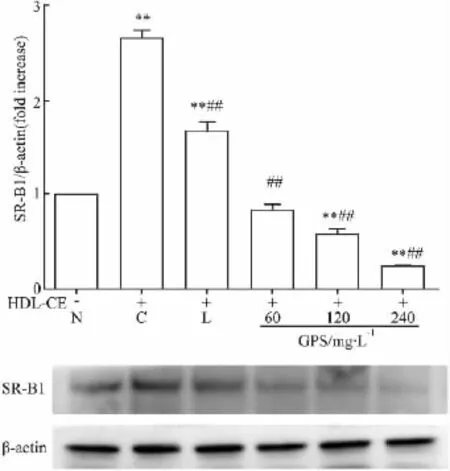
Fig 5 Effects of GPS on SR-BⅠprotein expression in HepG2 cell
3 讨论
研究已证明绞股蓝总皂苷具有良好的调脂和抗动脉粥样硬化作用,但是对其作用机制研究的尚不深入。血浆高密度脂蛋白(high density lipoprotein,HDL)具有抗氧化、抗炎、抑血栓形成、促内皮修复等作用,还能介导“胆固醇逆向转运”(RCT)来降低血管脂质的沉积,与AS的发生发展呈负相关性[8]。血清中的贫脂HDL可以结合外周组织中多余的胆固醇(包括AS斑块),形成新生的圆盘状HDL,并在卵磷脂胆固醇酯酰基转移酶(LCAT)的作用下将胆固醇酯化[9],由球状小颗粒的HDL3逐步转变成大颗粒的HDL2(成熟的HDL-C,即HDL-CE),再转运到肝脏进行再循环或形成胆汁酸代谢,或转运到类固醇激素生成组织被分泌,实现胆固醇的流出、酯化及清除,以上途径均需清道夫受体 SR-B1的参与[10]。
B型Ⅰ类清道夫受体(SR-BⅠ)是迄今为止介导肝脏选择性摄取 HDL-CE的主要受体[11],将HDL-CE转运到肝脏定位的细胞膜区域并在此通过细胞特殊的胆固醇中间水解酶把HDL-CE水解成游离胆固醇,从胆汁酸中清除或合成极低密度脂蛋白(VLDL)进行代谢,从而促进RCT的进行,清除外周组织中过多沉积的胆固醇,保护血管,防止AS的形成或改善已形成的AS。此外,HDL上的载脂蛋白与脂质脱离后可以回到外周中进行再循环。
莫中成等[12]研究表明高密度脂蛋白可以上调HepG2细胞中SR-BI的表达,增加细胞内胆固醇的蓄积,促进肝细胞摄脂功能。Jeyakumar等[13]发现WNIN/Ob品系肥胖鼠体内血清HDL-C水平异常升高,肝脏SR-BI受体表达下调;而补给Vit A后可以上调肝脏SR-BI受体的表达,促进RCT,从而来实现WNIN/Ob品系肥胖鼠HDL-C的内环境稳态。Fluiter等[14]研究显示高脂饮食和17α-乙炔基雌二醇(EE)能下调大鼠的肝实质细胞中SR-BI蛋白表达,而且伴随着肝实质细胞对HDL-CE中脂质摄取能力的下降。Witt等[15]针对 Vit E对大鼠肝组织和HepG2细胞SR-BⅠ蛋白和基因表达的影响进行了系统的研究,发现Vit E能降低HepG2细胞的SRBⅠ蛋白表达水平,同时还伴随PKC蛋白表达的下调,因此推测Vit E可能是通过抑制PKC信号通路调节细胞SR-BⅠ受体的表达。
本实验结果显示,300 mg·L-1HDL-CE孵育细胞24 h后胞内总胆固醇和胆固醇酯的含量明显增加,细胞膜受体SR-BⅠ的mRNA和蛋白表达水平明显增加,说明HDL-CE可能是通过增强HepG2细胞膜表面受体SR-BⅠ的表达来促进细胞对HDL-CE中胆固醇酯的摄取,清除对外周中过多的脂质,达到抗动脉粥样硬化的作用。但不同浓度绞股蓝总皂苷与HDL-CE与细胞共孵育后,细胞内TC和CE的含量无差异,且细胞膜受体SR-BⅠ的mRNA表达水平较模型组降低;而值得深思的是,对于SR-BⅠ的蛋白表达水平却是出人意料的呈剂量依赖性降低,此结果与Fluiter等研究高脂饮食对肝实质细胞SRBⅠ蛋白表达的影响实验及Witt等发现的Vit E能降低HepG2细胞中SR-BⅠ蛋白表达结果相符,推测HepG2细胞与HDL-CE孵育时摄入了过多的脂质,GPS对细胞进行反馈性调节而降低了SR-BⅠ基因的表达,且其调节作用主要发生在翻译水平而不是转录水平,但具体机制尚有待于进一步的探索。
[1] Forrester J S,Shah P K.Emerging strategies for increasing high density lipoprotein[J].Am J Cardiol,2006,98(11):1542 -9.
[2] Brunzell J D,Davidson M,Furberg C D,et al.Lipoprotein management in patients with cardiometabolic risk:consensus statement from the American Diabetes Association and the American College of Cardiology Foundation[J].Diabetes Care,2008,31(4):811-22.
[3] Barter P J,Kastelein J J.Targeting cholesteryl ester transfer protein for the prevention and management of cardiovascular disease[J].J Ant Coll Cardiol,2006,47(3):492 -9.
[4] 李时珍.本草纲目[M].北京:人民卫生出版社,1985,2:1326.
[4] Li S Z.Compendium of Materia Medica[M].Beijing:People's Medical Publishing House,1985,2:1326.
[5] 王亚利,范春雷,窦晓兵.绞股蓝总皂苷对肝细胞低密度脂蛋白受体表达的影响[J].中国药理学通报,2010,26(1):138-9.
[5] Wang Y L,Fan C L,Dou X B.Effect of gypenosides on the expression of LDL-R in HepG2[J].Chin Pharmacol Bull,2010,26(1):138-9.
[6] 贺 平,谭华炳,赵 琴.绞股蓝总皂甙抗高脂血症致动脉粥样硬化的机制研究进展[J].中西医结合心脑血管病,2009,7(4):464-5.
[6] He P,Tan H B,Zhao Q.The research progress of gypenosides anti-hyperlipidemia atherosclerosis mechanism[J].Chin J Int Med on Card/Cerebrov Dis,2009,7(4):464-5.
[7] 倪爱东,徐先祥,高 建.绞股蓝总皂甙心血管系统作用的研究进展[J].中国中医药科技,2002,9(2):127-8.
[7] Ni A D,Xu X X,Gao J.Research progress of gypenosides on cardiovascular system[J].Chin J Tradit Med Sci Technol,2002,9(2):127-8.
[8] Gordon D J,Rifkind B M.High-density lipoprotein——the clinical implications of recent studies[J].N Engl J Med,1989,321:1311-6.
[9] Schaefer J R.HDL level or HDL function as the primary target in preventive cardiology[J].Herz,2012,37:51 - 5.
[10] West M,Greason E,Kolmakova A,et al.Scavenger receptor class B type I protein as an independent predictor of high-density lipoprotein cholesterol levels in subjects with hyperalphalipoproteinemia[J].J Clin Endocrinol Metab,2009,94(4):1451 -7.
[11]Connelly M A,Kellner-Weibel G,Rothblat G H,et al.SR-BI-directed HDL-cholesteryl ester hydrolysis[J].J Lipid Res,2003,44:331-41.
[12]莫中成,陈 欣,曹 轩,等.高密度脂蛋白和低密度脂蛋白对HepG2细胞SR-BI表达的影响[J].南华大学学报医学版,2010,38(1):10-3.
[12] Mo Z C,Chen X,Cao X,et al.Influences of the SR-BI expression by HDL and LDL in HepG2 cells[J].J Univ South China,2010,38(1):10-3.
[13] Jeyakumar S M,Vajreswari A,Giridharan N V.Impact of vitamin A on highdensity lipoprotein-cholesterol and scavenger receptor class BI in the obese rat[J].Obesity,2007,15(2):322 - 9.
[14] Fluiter K,van der Westhuijzen D R,van Berkel T J.In vivo regulation of scavenger receptor BI and the selective uptake of high density lipoprotein cholesteryl esters in rat liver parenchymal and Kupffer cells[J].J Biol Chem,1998,273(14):8434 -8.
[15] Witt W,Kolleck I,Fechner H,et al.Regulation by vitamin E of the scavenger receptor BI in rat liver and HepG2 cells[J].J Lipid Res,2000,41:2009 -16.