磷酸肌酸联合缺血后适应对大鼠心肌缺血/再灌注损伤的保护作用
2012-07-28张会珍邢艳秋寇学俊
张会珍,邢艳秋,肖 冬,章 萌,王 慧,寇学俊
(1.济南医院心内科山东济南 250013;2.山东省医学科学院基础医学研究所,山东济南 250062;3.山东大学齐鲁医院,山东济南 250012)
无论是在发展中国家还是在发达国家,急性心肌梗死(acute myocardial infarction AMI)仍然是威胁人类身体健康的一个全球问题。每年大约有数百万世界人口的死亡都与 AMI有关,死亡率大约是10%,而且它也是慢性心力衰竭的主要病因[1]。早期开通罪犯血管,恢复缺血心肌的血流灌注仍然是最有效的治疗措施。然而再灌注损伤不可避免。缺血后适应作为一种新的治疗策略能够有效的减轻心肌再灌注损伤,但它的不足之处是由于再灌注过程中反复的缺血损害了细胞内三磷酸腺苷(ATP)产生[2]。磷酸肌酸(phosphocreatine PCr)是一种高能磷酸化合物,在心肌急性缺血时应用外源性磷酸肌酸可以减少心肌酶的释放,缩小心肌梗死面积,但其对缺血心肌的保护机制目前还不是完全清楚。本研究旨在探讨外源性磷酸肌酸联合缺血后适应对再灌注损伤心肌的保护作用,并从促炎细胞因子水平和细胞凋亡通路方面研究其作用机制。
1 材料与方法
1.1 实验动物 健康、♂、SPF级Wistar大鼠40只,体质量260~290 g,由山东大学实验动物中心提供,合格证号SCXK鲁20090001。动物分笼饲养,室温控制在(20~24)℃,湿度为(50~60)%,饮用水和标准饲料均经灭菌后动物自由食用。
1.2 药品与试剂 磷酸肌酸(商品名:里尔统),1 g/支,批号:6252,意大利阿尔法韦士曼制药公司生产。肌酸激酶(CK)试剂盒,批号:20111219,乳酸脱氢酶(LDH)试剂盒,批号:20111216,髓过氧化物酶(MPO)试剂盒,批号:20110730,南京建成生物工程有限公司生产。TNF-α ELISA试剂盒由武汉伊艾博科技有限公司生产。兔抗大鼠磷酸化Akt(Ser473)抗体、兔抗大鼠Bcl-2抗体由美国Cell Signaling公司生产。辣根酶标记山羊抗兔lgG由北京中杉金桥生物技术公司生产。伊文思蓝(Evans blue),美国Sigma公司生产。氯化三苯基四氮唑(TTC),美国Amresco公司生产。BCA蛋白浓度测定试剂盒(增强型),碧云天生物技术研究所生产。
1.3 实验仪器 小动物呼吸机(江西省特力麻醉呼吸设备公司)、离心机(Bechman公司)、酶标仪(Thermo公司)、电子天平(上海精科公司)、垂直电泳槽、转膜槽(美国BIO-RAD公司)等均由山东大学教育部、卫生部心血管重构与功能研究重点实验室提供。
1.4 模型制备及分组 大鼠心肌缺血/再灌注模型的建立:40只大鼠采用30 mg·kg-1戊巴比妥钠腹腔麻醉,气管切开后连接小动物呼吸机进行机械通气(呼吸比1∶1.5,呼吸频率60次/分),分离肌层,沿胸骨左缘切开第3、4肋间,剪开心包,暴露心脏,在左心耳下方2 mm,肺动脉圆锥左缘之间穿线进针,以冠状静脉为标志穿入7-0丝线用于结扎左冠状动脉前降支(LAD),同时将一内径1.5 mm的乳胶管至于结扎线和LAD之间,拉紧结扎线使乳胶管压迫LAD,造成急性心肌缺血。缺血30 min后,拔出乳胶管,冠状动脉再通,形成再灌注。实验中以左室前壁出现紫绀及心电图标II导联ST段抬高为心肌缺血成功标志。冠状动脉阻塞之前经尾静脉推注肝素钠(300 U·kg-1)抗凝。Wistar大鼠编号按抽签法随机分为4组(n=10),均予心肌缺血30 min,再灌注120 min处理:(1)I/R组,缺血30 min后直接再灌注;(2)IPost组,再灌注前给予3次再灌注10 s/缺血10 s处理;(3)PCr组,再灌注前5min经股静脉缓慢推注PCr 200 mg·kg-1;(4)PCr+IPost组,再灌注前5 min给予PCr 200 mg·kg-1,同时再灌注前予3次再灌注10 s/缺血10 s处理。I/R组、IPost组分别给予等量生理盐水。
1.5 标本采集与处理 (1)于再灌注2 h末,经股静脉取血 2 ml,3 000 r·min-1离心 15 min,取上清于-80℃冰箱保存待测。于再灌注2 h末每组随机抽取3只大鼠,取左室前壁缺血区心肌组织作Western blot检测,每组剩余7只大鼠用于心肌梗死面积测定。(2)血清CK、LDH、MPO活性测定:采用比色法测定CK、LDH、MPO各指标的酶活力,具体操作参照试剂盒说明书。(3)血清 TNF-α检测:采用ELISA方法进行TNF-α检测,根据标准品绘制蛋白标准曲线,将样本测得的OD值在标准曲线上确定TNF-α蛋白的含量。(4)Western blot检测心肌组织磷酸化Akt蛋白(P-Akt)和Bcl-2蛋白表达:取待测心肌约60 mg提取细胞内蛋白,BCA法测定蛋白浓度,10%SDS-PAGE凝胶电泳分离,转印到硝酸纤维素膜,5%脱脂奶粉室温封闭2 h,洗涤后将硝酸纤维膜置于一抗中孵育,P-Akt、Bcl-2、β-actin的稀释比例分别为1 ∶300、1 ∶500、1 ∶1 000,4℃反应过夜,TBS-T漂洗后加入辣根过氧化物酶标记相应二抗,稀释比例分别为1 ∶5 000、1 ∶10 000、1 ∶20 000,化学发光显影。以 P-Akt/β-actin及 Bcl-2/β-actin灰度比值表示蛋白表达的半定量水平。(5)心梗面积测定:实验结束后,原位结扎冠状动脉,经颈静脉注入1%的Evans蓝2~3 ml,将非缺血心肌染成蓝色,从而显示出缺血危险区(AAR)心肌。10%氯化钾处死动物,立即摘取心脏,去除大血管、心房及右心室,-20℃冷冻10 min,沿左心室(LV)长轴横切为4~5片厚约1~2 mm的心肌片,将之置于1%氯化三苯基四氮(TTC)中,于37℃孵育20 min,此时坏死区(AN)呈灰白色,非坏死心肌呈砖红色,非缺血区心肌呈蓝紫色。最后将切片置于10%甲醛中固定30 min,光学显微镜下仔细将AN心肌及非梗死的AAR心肌分开。将分离好的心肌组织分别称重,心肌缺血面积以缺血区心肌重量/左室重量(AAR/LV)来表示,心肌梗死面积以坏死区心肌重量/缺血区心肌重量(AN/AAR)来表示。
1.6 统计学分析 采用SPSS 16.0软件进行统计分析。计量资料以±s表示。多组均数及组间两两比较分别采用单因素方差分析和最小显著差异法(LSD法),两指标间相关性分析采用Spearman相关分析。
2 结果
2.1 各组血清 CK、LDH、MPO活性及 TNF-α变化IPost组、PCr组、PCr+IPost组较 I/R 组 CK、LDH、MPO活性及TNF-α明显降低(P<0.05);PCr+IPost组与 IPost组、PCr组相比,CK、LDH、MPO 活性和TNF-α进一步降低(P<0.05),见Tab 1。
Tab 1 Comparison of serum CK,LDH,MPO and TNF-α in each experimental group(±s,n=10)
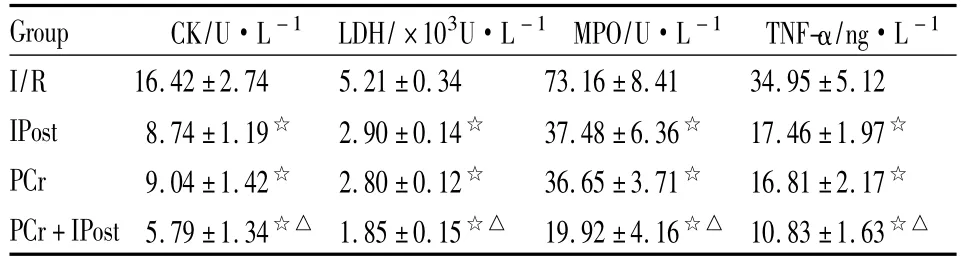
Tab 1 Comparison of serum CK,LDH,MPO and TNF-α in each experimental group(±s,n=10)
☆P<0.05 vs I/R group;△P<0.05 vs IPost group and PCr group
Group CK/U·L-1 LDH/×103U·L-1 MPO/U·L-1 TNF-α/ng·L -1 I/R 16.42±2.74 5.21±0.34 73.16±8.41 34.95±5.12 IPost 8.74±1.19☆ 2.90±0.14☆ 37.48±6.36☆ 17.46±1.97☆PCr 9.04±1.42☆ 2.80±0.12☆ 36.65±3.71☆ 16.81±2.17☆PCr+IPost5.79±1.34☆△ 1.85±0.15☆△ 19.92±4.16☆△ 10.83±1.63☆△
2.2 心肌缺血及梗死面积比较结果 各组大鼠间体重、左心室重量均差异无统计学意义。PCr+IPost组缺血危险区面积(AAR/LV)小于IPost组、PCr组和I/R组(P<0.05),其余3组间AAR/LV差异无统计学意义。IPost组、PCr组和PCr+IPost组心肌梗死面积小于I/R组(P<0.05),PCr+IPost组小于IPost组、PCr组(P <0.05),见 Tab 2。
Tab 2 Percentages of risk area and infarct size(±s,n=7)
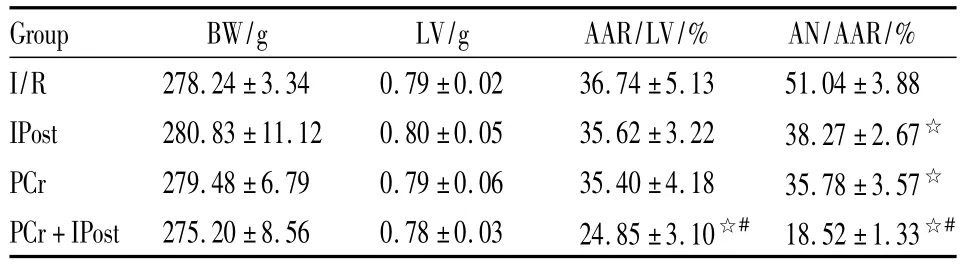
Tab 2 Percentages of risk area and infarct size(±s,n=7)
☆P<0.05 vs I/R group;#P<0.05 vs IPost group and PCr group
Group BW/g LV/g AAR/LV/% AN/AAR/%I/R 278.24±3.34 0.79±0.02 36.74±5.13 51.04±3.88 IPost 280.83±11.12 0.80±0.05 35.62±3.22 38.27±2.67☆PCr 279.48±6.79 0.79±0.06 35.40±4.18 35.78±3.57☆PCr+IPost 275.20±8.56 0.78±0.03 24.85±3.10☆# 18.52±1.33☆#
2.3 心肌组织P-Akt及Bcl-2蛋白表达结果IPost组、PCr组、PCr+IPost组 P-Akt蛋白表达均明显高于 I/R组(0.228±0.012、0.214±0.011、0.418±0.012比0.094±0.009,P 均 <0.05)。IPost组、PCr组、PCr+IPost组Bcl-2蛋白表达均明显高于I/R 组(0.234±0.012、0.475±0.013、0.749±0.016比0.139±0.011,P 均 <0.05)。PCr+IPost组 PAkt及Bcl-2蛋白表达明显高于IPost组、PCr组(P<0.05),见 Fig 1。
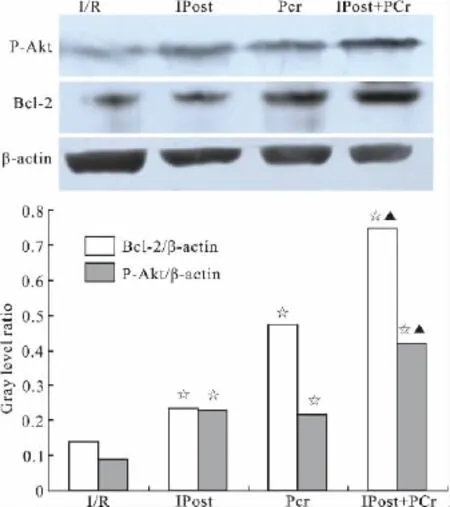
Fig 1 Results of Western blot detection of left ventricular anterior ischemic myocardium P-Akt and Bcl-2 protein expression
3 讨论
尽管近年来心血管疾病研究飞速发展,但缺血性心脏病仍然是世界主要的死因[3]。目前,已经开展的及时开通罪犯血管的治疗手段不可避免的带来了心肌缺血/再灌注损伤。缺血后适应能有效减轻再灌注损伤。Lønborg等[4-5]研究显示,介入时配合缺血后适应操作可以明显减少心肌酶的释放、改善左室功能。PCr是一个非常重要的能量底物,且它与心肌组织有特别高的亲和性,很容易被心脏吸收,故磷酸肌酸可能成为减轻再灌注损伤的理想药物。因药物后适应与缺血后适应一样有更好的临床应用前景,故我们首次建立了PCr后适应动物模型。我们研究发现,PCr及IPost均能明显降低血清 CK、LDH的释放和心肌梗死面积,对缺血/再灌注心肌起到了很好的保护作用,两者联合应用心肌梗死面积进一步减少,对缺血/再灌注心肌起到了更好的保护作用。
在心肌缺血/再灌注损伤中,细胞凋亡占有重要地位[6]。PI-3K(phosphatidyl-inositol-3 kinase,磷酯酰肌醇-3激酶)/Akt/Bcl-2途径是主要的抗细胞凋亡的通路之一[7]。Shroff等[8]研究显示 PI-3K/Akt信号通路通过调节Bcl-2蛋白的表达发挥抗凋亡效应;Yu等[9]研究显示应用PI-3K抑制剂wortmannin可以明显下调Bcl-2蛋白表达。PCr作为一种心肌保护剂,具有抑制细胞凋亡作用,但是其通过何种上游途径发挥抑制凋亡作用,目前尚无相关报道。我们首次研究发现PCr后适应可以明显上调心肌组织中P-Akt和Bcl-2蛋白表达,心肌梗死面积及心肌酶明显降低,由此提示磷酸肌酸抑制细胞凋亡的上游机制可能是通过激活P-Akt/Bcl-2信号通路发挥心脏保护作用。而且我们也研究发现PCr+IPost,心肌组织P-Akt、Bcl-2蛋白表达进一步升高,心梗面积进一步减少,两者联合应用对缺血/再灌注心肌起到了更好的保护作用。关于PCr+IPost是通过何种途径促进PI-3K活化、上调P-Akt蛋白,我们推测可能与共同激活细胞表面的腺苷受体有关,进一步可以通过应用腺苷受体阻断剂来证实。
目前,关于炎症因子和I/R损伤的关系也逐渐成为一种共识。TNF-α是一个有力的促炎细胞因子,它可激活并诱导中性粒细胞在组织中黏附、聚集,而中性细胞的激活又可以增加许多促炎细胞因子如TNF-α的产生,从而起到信号级联放大效应,加重了心肌炎症反应,造成明显的再灌注损伤[10-11]。MPO作为一种主要由中性粒细胞释放的酶,因此MPO活性测定成为反映中性粒细胞浸润和炎症反应程度广泛使用的生物标志物[11]。我们对TNF-α和MPO进行Spearman相关分析显示两者呈明显的正相关(rs=0.736,P<0.01),由此也进一步说明TNF-α与组织的炎性浸润程度之间存在着密切关系。我们研究发现,IPost及PCr后适应均可以明显抑制TNF-α和MPO活性,两者联合应用血清TNF-α和MPO水平进一步减低,由此可见,两者发挥心脏保护作用机制可能与抑制组织的炎症反应有关。
综上所述,磷酸肌酸后适应联合缺血后适应可以明显减轻大鼠心肌缺血/再灌注损伤,其保护机制可能与共同激活PI-3K/Akt/Bcl-2信号通路和抑制炎症反应有关。因两者联合应用可以明显保护大鼠缺/血再灌注心肌,因此它们可能为临床再灌注损伤的预防开辟了一条新的治疗方法和思路。
[1] Perrelli M G,Pagliaro P,Penna C.Ischemia/reperfusion injury and cardioprotective mechanisms:Role of mitochondria and reactive oxygen species[J].World J Cardiol,2011,3(6):186-200.
[2] Moriguchi A,Otani H,Yoshioka K,et al.Inhibition of contractile activity during postconditioning enhances cardioprotection by restoring sarcolemmal dystrophin through phosphatidylinositol3-kinase[J].Circ J,2010,74(11):2393-402.
[3] Yao Y W,Zhang G H,Zhang Y Y,et al.Lipopolysaccharide pretreatment protects against ischemia/reperfusion injury via increase of HSP70 and inhibition of NF-κB[J].Cell Stress Chaperones,2011,16(3):287-96.
[4] Zhao W S,Xu L,Wang L F,et al.A 60-s postconditioning protocol by percutaneous coronary intervention inhibits myocardial apoptosis in patients with acute myocardial infarction[J].Apoptosis,2009,14(10):1204-11.
[5] Lønborg J,Kelbaek H,Vejlstrup N,et al.Cardioprotective effects of ischemic postconditioning in patients treated with primary percutaneous coronary intervention,evaluated by magnetic resonance[J].Circ Cardiovasc Interv,2010,3(1):34-41.
[6] 史婷婷,白建平,梁月琴,等.芹菜素对大鼠缺血/再灌注心肌细胞凋亡及相关蛋白Bcl-2、Bax、Caspase-3 表达的影响[J].中国药理学通报,2011,27(5):666-71.
[6] Shi T T,Bai J P,Liang Y Q,et al.Effect of apigenin on the cardiomyocyte apoptosis in rats with ischemia and reperfusion and the expression of Bcl-2,Bax,Caspase-3[J].Chin Pharmacol Bull,2011,27(5):666-71.
[7] 芦 滨,赵建力,牛栓成,等.异丙酚对肝缺血/再灌注大鼠心肌损伤的影响及P13K/Akt信号通路在其中的作用[J].中华麻醉学杂志,2010,30(10):1251-3.
[7] Lu B,Zhao J L,Niu S C,et al.Effect of propofol on myocardial injury induced by hepatic ischemia/reperfusion in rats and the role of PI3K/Akt signaling pathway[J].Chin J Anesthesiol,2010,30(10):1251-3.
[8] Shroff E H,Snyder C M,Budinger G R,et al.BH3 peptides induce mitochondrial fission and cell death independent of BAX/BAK[J].PloS One,2009,4(5):e5646.
[9] Yu L N,Yu J,Zhang F J,et al.Sevoflurane postconditioning reduces myocardial reperfusion injury in rat isolated hearts via activation of PI3K/Akt signaling and modulation of Bcl-2 family proteins[J].J Zhejiang Univ Sci B,2010,11(9):661-72.
[10] Fichtlscherer S,Rossig L,Breuer S,et al.Tumor necrosis factor antagonism with etanercept improves systemic endothelial vasoreactivity in patients with advanced heart failure[J].Circulation,2001,104(25):3023-5.
[11] Shin I W,Jang I S,Lee S M,et al.Myocardial protective effect by ulinastatin via an anti-inflammatory response after regional ischemia/reperfusion injury in an in vivo rat heart model[J].Korean J Anesthesiol,2011,61(6):499-505.