铁皮石斛多糖对RAW264.7细胞分泌TNF-α的影响
2012-07-28蔡海兰黄晓君聂少平谢明勇崔武卫
蔡海兰,黄晓君,聂少平,田 芳,谢明勇,崔武卫,3
(1.南昌大学食品科学与技术国家重点实验室,江西南昌 330047;2.云南金九地生物科技有限公司,云南昆明650033;3.加拿大农业与农业食品部圭尔夫食品研究中心,安大略尔夫NIG5C9)
铁皮石斛(Dendrobium officinale Kimura et Migo.)是兰科石斛属多年生草本植物,始载于《神农本草经》,具有“主伤中;除痹,下气;补五脏虚劳羸瘦,强阴。久服厚肠胃;轻身延年”的作用。以新鲜或干燥茎入药,云南、贵州、浙江、安徽、江西、湖南等地均有分布。古语有云:“北有人参,南有枫斗”,铁皮石斛由于其独特的药用价值,2010年版《中华人民共和国药典》中作为单独一味中药从近百种石斛属植物中突显出来,建立起自己明确的专属性标准。铁皮石斛化学成分多样,主要有生物碱、多糖、菲类、联苄类、香豆素类、花青素等化合物[1-2],关于铁皮石斛多糖的研究,国内外主要集中在多糖的提取方法和结构解析上[3-4],对铁皮石斛多糖的药理研究较少,已有部分报道证明铁皮石斛多糖具有抗氧化、抗肿瘤、免疫调节[5-7]等作用。本文将以小鼠巨噬细胞株RAW264.7细胞为研究对象,研究铁皮石斛多糖对RAW264.7细胞活性、肿瘤坏死因子TNF-α的分泌、TNF-α mRNA的表达及核转录因子NF-κB的影响[8],旨在阐述铁皮石斛多糖免疫调节作用的可能机制,为充分开发应用铁皮石斛提供参考依据。
1 材料
1.1 细胞 小鼠巨噬细胞株RAW264.7购自上海细胞所,培养于含10% 胎牛血清的RPMI 1640培养液中(含 100 mg·L-1青霉素,100 mg·L-1链霉素),置于37℃,5%CO2细胞培养箱中,每天换液,隔2 d传代1次。
1.2 试剂 RPMI 1640培养基(Gibco公司),胎牛血清(Hyclone公司),脂多糖(LPS)(美国Sigma公司),TNF-α ELISA 试剂盒(武汉博士德公司),TRIzol试剂盒(美国Invitrogen公司),逆转录试剂盒(美国Fermenta公司),PCR试剂盒(北京全式金公司),细胞核蛋白与细胞质蛋白抽提试剂盒(南京凯基公司),BCA蛋白浓度测定试剂盒、ECL化学发光试剂盒(北京碧云天公司),β-actin小鼠单克隆抗体、HRP标记山羊抗鼠IgG二抗、HRP标记的羊抗兔IgG二抗(北京中杉公司),I-κB兔多单克隆抗体(美国CST公司)。
1.3 铁皮石斛多糖 来源为云南铁皮石斛干燥茎(云南金九地生物科技有限公司提供),经水提醇沉后得到粗多糖(polysaccharides from Dendrobium officinale,DOP)。经硫酸苯酚法检测其糖含量为75%,凯氏定氮法测定蛋白含量为9% 。DOP溶于一定量细胞培养液中,过滤除菌,-20℃分装保存。
1.4 仪器与设备 3K15-高速冷冻离心机(德国Sigma公司),HH-4数显恒温水浴锅(深圳国华电器有限公司),METTLER TOLEDO AL104电子天平(梅特勒-托利多仪器有限公司),CO2培养箱、E-330酶标仪(美国 Thermo公司),超净工作台(吴江市净化设备总厂),倒置显微镜(日本 Olympus公司),PCR仪、凝胶成像系统(美国Bio-Rad公司)。
2 方法
2.1 MTT法检测细胞活性 采用MTT法检测DOP对RAW264.7细胞的增殖作用。取对数生长期的RAW264.7细胞,以5×104/孔接种于96孔细胞培养板中,分别加入不同体积的铁皮石斛多糖,补充培养液至200 μl,使多糖终浓度为20,40,80,160 mg·L-1;同时设LPS组(终浓度为1 mg·L-1)。在5%CO2、37℃培养箱中培养24 h后,吸去培养液,每孔加入20 μl MTT,上述条件下继续培养4 h,弃上清,每孔加入150 μl DMSO,振荡器上震荡10 min,酶标仪570 nm波长检测吸光值,计算细胞相对增殖率。

2.2 ELISA法检测细胞分泌TNF-α 取对数生长期的RAW264.7细胞1×105/孔接种于96孔细胞培养板中,实验处理同“2.1”项,24 h后取上清液测定TNF-α含量。每实验组6个复孔,重复3次。采用ELISA试剂盒,具体操作方法参照试剂盒说明书进行,450 nm处测定吸光度。
2.3 RT-PCR检测细胞表达TNF-α mRNA调整细胞浓度为1×106/孔接种于6孔培养板,每孔1 ml,于5%CO2,37 ℃培养箱中培养24 h,实验处理同“2.1”项,培养 24 h,TRIzol试剂盒提取RAW264.7细胞RNA,1%琼脂糖凝胶电泳鉴定其完整性。TNF-α引物上游序列:5'-CTTCAGCCCCAG CAGTGTATTCTTT-3',下游序列:5'AGAGAACCTGGGAGTAGACAAGGTA-3',扩增产物为 692 bp;β-actin上游序列:5'-CACCACACCTTCTACAATGAGCTGC-3',下游序列:5'-GCTCAGGAGGAGCAATGATCTTGAT-3',扩增产物为153 bp。PCR条件为 94℃ ×30 s,60 ℃ ×30 s,72 ℃ ×2 min,29 个循环扩增。得到的扩增产物进行1.5%的琼脂糖凝胶电泳,Quantity One软件分析。
2.4 Western blot检测细胞中I-κBα蛋白表达收集空白组、DOP 处理组(80,160 mg·L-1)、LPS组(1 mg·L-1)细胞,按胞质蛋白提取试剂盒要求提取蛋白。BCA法检测蛋白浓度。加入SDS-蛋白上样缓冲液,水浴煮沸5 min变性,-80℃保存。在10%聚丙烯酰胺凝胶(SDS-PAGE)中进行电泳,每孔蛋白上样量30 μg。50 V电泳30 min,至指示剂到浓缩胶与分离胶交界处,改为100 V电泳至溴酚蓝到凝胶底部,停止电泳。置硝酸纤维膜,放入电转槽中进行电转移(60 V,120 min)。移膜至含封闭液的平皿中,室温下脱色摇床摇动封闭1 h。加一抗孵育4℃过夜。洗涤后加二抗,室温孵育1 h后,再次洗涤。用ECL检测液发光显影定影,Quantity One软件分析。
3 结果
3.1 DOP对RAW264.7细胞的活性影响 MTT实验结果(Tab 1)显示,DOP可促进RAW264.7细胞的增殖,且在 20、40、80 mg·L-1剂量范围内与对照组相比,差异具有统计学意义(P<0.01),高剂量(160 mg·L-1)的DOP细胞增殖率下降,但仍可促进细胞增殖,表明DOP无细胞毒作用。
Tab 1 Effects of DOP on cell proliferation in RAW264.7 cells by MTT assay(±s,n=6)
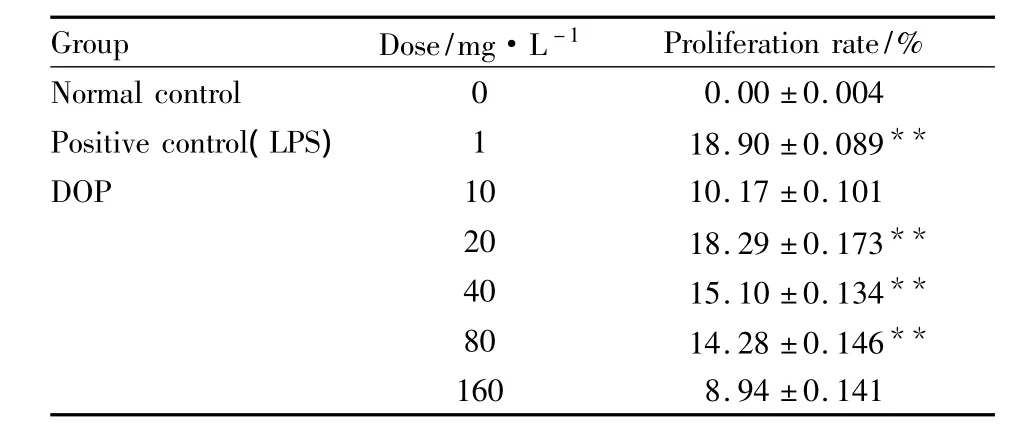
Tab 1 Effects of DOP on cell proliferation in RAW264.7 cells by MTT assay(±s,n=6)
**P<0.01 vs normal control
Group Dose/mg·L-1Proliferation rate/%Normal control 0 0.00 ±0.004 Positive control(LPS)1 18.90 ±0.089**DOP 10 10.17 ±0.101 20 18.29 ±0.173**40 15.10 ±0.134**80 14.28 ±0.146**160 8.94 ±0.141
3.2 DOP对 RAW264.7细胞分泌TNF-α的影响
ELISA检测结果(Tab 2)显示,DOP能刺激小鼠巨噬细胞分泌肿瘤坏死因子TNF-α,并随着DOP剂量的增加,TNF-α的分泌量逐渐升高,与空白组相比,20、40、80、160 mg·L-1处理组差异均具有显著性。
Tab 2 Effects of DOP on TNF-α production in RAW264.7 cells(±s,n=6)
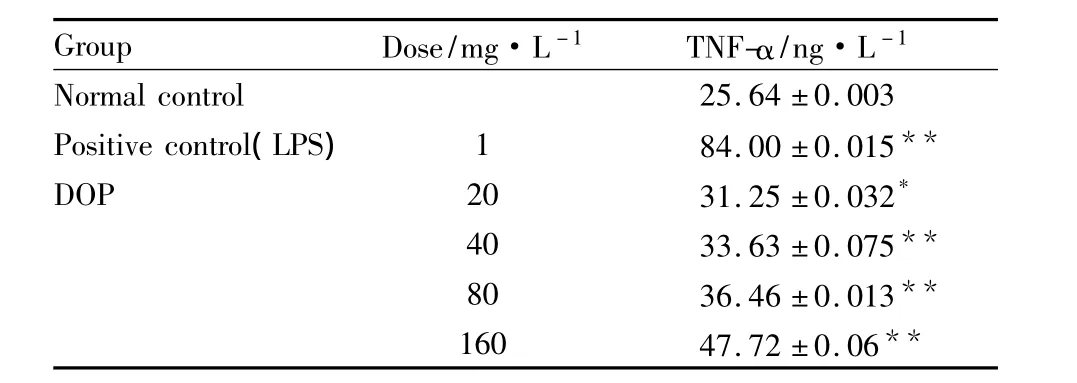
Tab 2 Effects of DOP on TNF-α production in RAW264.7 cells(±s,n=6)
*P<0.05;**P<0.01 vs normal control
Group Dose/mg·L -1 TNF-α/ng·L -1 Normal control 25.64 ±0.003 Positive control(LPS)1 84.00 ±0.015**DOP 20 31.25 ±0.032*40 33.63 ±0.075**80 36.46 ±0.013**160 47.72 ±0.06**
3.3 DOP对RAW264.7细胞TNF-α mRNA表达的影响 在“3.2”中发现DOP可以剂量依赖性增加小鼠巨噬细胞TNF-α的分泌量,但是不清楚这种分泌量的增加是否在转录水平调控,故对TNF-α mRNA进行半定量实验,结果如Fig 1所示。在未受刺激的状态下,TNF-α mRNA少量表达,LPS处理后,TNF-α mRNA表达量明显增加。DOP处理组随着DOP浓度的增加,TNF-α mRNA的表达量也呈增加趋势,160 mg·L-1剂量下达到最大值。说明DOP促进TNF-α的分泌可能是通过增加TNF-α mRNA表达量来调控。
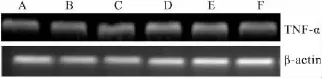
Fig 1 Effects of DOP on the expression of mRNA of TNF-α
3.4 DOP对RAW264.7细胞I-κBα蛋白表达的影响 在“3.2”、“3.3”研究的基础上,本实验以80、160 mg·L-1为 DOP 的作用浓度。DOP 作用于RAW264.7细胞24 h后收集细胞,胞质蛋白提取试剂盒提取蛋白,Western blot检测胞质内 I-κBα水平,结果如Fig 2所示。DOP作用于RAW264.7细胞后,样品内参β-actin蛋白量表达基本不变的情况下,DOP能剂量依赖性降低RAW264.7细胞胞质内I-κBα 水平。
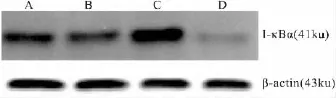
Fig 2 I-κB expression by DOP-stimulated RAW264.7 cells
4 讨论
巨噬细胞是免疫效应细胞,具有多种免疫功能,包括免疫防御、免疫监视、免疫调节等,在机体的先天性免疫系统中发挥重要作用[9]。TNF-α是活化的巨噬细胞杀灭病原微生物及肿瘤细胞的主要效应分子,可通过上调巨噬细胞MHCⅡ类分子,提高其抗原递呈能力;还可提高中性粒细胞的吞噬能力,增强超氧阴离子产生,增强ADCC(抗体依赖的细胞介导的细胞毒作用)功能,刺激细胞脱颗粒和分泌髓过氧化物酶;活化NK细胞发挥细胞毒作用。由于巨噬细胞分泌的TNF-α在抗肿瘤,提高免疫力等方面有独特的作用,已激起人们极大的兴趣去发现调节TNF-α 的免疫治疗剂[10-11]。研究表明 NF-κB 的特异性性抑制剂PDTC(Pyrrolidine Dithiocarbamate)可以抑制 TNF-α 的表达[12],说明 NF-κB 参与 TNF-α转录水平的调控。在静止细胞中,NF-κB抑制蛋白(I-κB)与 NF-κB p65 蛋白结合,覆盖 p50 核定位信号,使NF-κB以一种非活化的形式存在于胞质中。巨噬细胞激活后可促使I-κBα磷酸化降解,从而使NF-κB转位进入细胞核,随着 NF-κB的激活,一系列在免疫反应和炎症反应中发挥重要作用的炎症因子、趋化因子的基因表达也相应被激活,如IL-1β、IL-6、NO 等,细胞周期调控蛋白 D、E[13]。
本实验研究发现DOP作用于细胞后,细胞生长状态良好,在所用剂量范围内,MTT测定证实其无细胞毒性。通过检测 DOP作用后 RAW264.7的TNF-α分泌增加,证实了DOP具有促TNF-α分泌的作用。与此同时,DOP增加TNF-α mRNA表达和I-κBα蛋白表达。研究结果提示,DOP增加TNF-α的分泌可能归结于两个原因:(1)DOP直接在转录水平调节TNF-α mRNA的表达;(2)DOP通过抑制I-κBα 的表达,破坏了 I-κBα-NF-κB 复合物导致核转录因子NF-κB的激活,从而调控TNF-α mRNA的表达。因此,DOP诱导的TNF-α的明显分泌可说明其具有增强免疫的功能。在临床上,可作为癌症治疗的免疫辅助药物来缓解抗癌药物的副作用,这也解释了为何铁皮石斛自古以来以其独特的药用价值被人们奉为九大仙草之首,其中发挥免疫增强活性的有效成分可能是DOP。但是,由于多糖分子量较大,可能主要通过细胞表面多糖特异性受体发挥调节作用[15],因而关于DOP发挥免疫调节活性的具体作用机制如信号通路等仍需要进一步研究。
[1] Li Y,Wang C L,Wang Y J,et al.Four new bibenzyl derivatives from Dendrobium candidum [J].Chem Pharm Bull,2009,57(9):997-9.
[2] 张俊青,吴 芹,石京山.金钗石斛生物总碱对脂多糖激活星形胶质细胞产生炎症因子的影响[J].中国药理学通报,2011,27(6):824-7.
[2] Zhang J Q,Wu Q,Shi J S.Effects of Dendrobium nobile total alkaloids on lipopolysaccharide-induced astrocyte activation and proinflammatory factors production[J].Chin Pharmacol Bull,2011,27(6):824-7.
[3] 盛家荣,李志华,易艳波.铁皮石斛多糖的研究进展[J].广西科学院学报,2011,27(4):338-40.
[3] Sheng J R,Li Z H,Yi Y B.Advances in the study of polysaccharide from Dendrobium officinal[J].J Guangxi Academy Sci,2011,27(4):338 -40.
[4] Yun F H,Ming Z,Cheng X F,et al.Structural characterization of a 2-o-acetylgucomannan from Dendrobium officinale stem[J].Carbohydrate Res,2004,339:2219 -24.
[5] 鲍素华.铁皮石斛多糖体外抗氧化活性的研究[D].合肥:合肥工业大学,2009:1-27.
[5] Bao S H.Studies on antioxidant activity of polysaccharides from Dendrobium Candium in vitro[D].Hefei:Hefei Univ Technol,2009:1-27.
[6] 张红玉,戴关海,马 翠,杨 锋.铁皮石斛多糖对S-(180)肉瘤小鼠免疫功能的影响[J].浙江中医杂志,2009,44(5):380-1.
[6] Zhang H Y,Dai G H,Ma C,Yang F.Immunomodulating effect of polysaccharides from Dendrobium officinale to Sarcoma-180-bearing mice[J].Zhejiang J Tradit Chin Med,2009,44(5):380-1.
[7] 李 钦,陈爱君,张信岳.铁皮石斛颗粒增强免疫功能作用研究[J].中药药理与临床,2008,24(1):53.
[7] Li Q,Chen A J,Zhang X Y.Immunomodulating activities of Dendrobium officinale particles[J].Pharmacol Clin Chin Mater Med,2008,24(1):53.
[8] 李 敏,刘耕陶.双环醇对脂多糖诱导巨噬细胞iNOS蛋白的表达和NF-κB活化的抑制作用[J].中国药理学通报,2006,22(12):1438-43.
[8] Li M,Liu G T.Inhibitory effect of bicyclol on iNOS expression and NF-κB activation degradation in marcrophages induced by lipopolysaccharides[J].Chin Pharmacol Bull,2006,22(12):1438-43.
[9] 张莘莘,聂少平,谢明勇,等.黑灵芝多糖对体外培养的小鼠腹腔巨噬细胞功能的影响[J].中国药理学通报,2010,26(9):1139-42.
[9] Zhang S S,Nie S P,Xie M Y,et al.Effects of polysaccharide of Ganpderma atrum on the function of mouse peritoneal macrophages in vitro[J].Chin Pharmacol Bull,2010,26(9):1139 -42.
[10]王文平,王佑民,王丽萍.肥胖大鼠非酒精性脂肪肝与血清脂联素和肿瘤坏死因子的关系及吡格列酮干预[J].中国药理学通报,2008,24(2):265-8.
[10] Wang W P,Wang Y M,Wang L P.Relationship between nonalcoholic fatty liver disease and levels of serum adiponectin and tumor necrosis factor-α in obese rats and pioglitazone intervention[J].Chin Pharmacol Bull,2008,24(2):265 -8.
[11] Lasek W,Feleszko W,Marczak M,et al.Antitumor effects of the combination immunotherapy with interleukin-12 and tumor necrosis factor α in mice [J].Cancer Immunol Immunother,1997,45:100-8.
[12] Kim J Y,Lee H J,Kim J S,et al.Induction of nitric oxide synthase by saponins of heat-processed ginseng[J].Biosci Biotechnol,2005,69(5):891 -5.
[13] Seulmee S,Jonghak K,Sungwon L,et al.Immunostimulatory effects of Cordyceps militaris on macrophages through the enchanced production of cytokines via the activation of NF-κB [J].Immune Network,2010,10(2):55-63.
[14]江乐明,黄丹菲,聂少平,等.大粒车前子多糖对树突状细胞分泌不同类型细胞因子的影响[J].南昌大学学报:工科版,2011,33(4):343-7.
[14] Jiang L M,Huang D F,Nie S P,et al.Effects of polysaccharides isolated from the seeds of Plantago Asiatica L.on cytokine production of Dendritic cells[J].J Nanchang Univ(Engineer & Technol),2011,33(4):343-7.
[15] Igor A S,Mark T Q.Botanical polysaccharides:Macrophage immunomodulation and therapeutic potential[J].Internat Immunopharmacol,2006,6(3):317 -33.