硫化氢对急性缺血所致心肌细胞凋亡的影响
2012-07-28张建新丁艳艳李兰芳张勤增解丽君
张建新,丁艳艳,李兰芳,刘 芳,张勤增,解丽君,郝 娜
(河北省医学科学院,河北 石家庄 050021)
研究显示,急性心肌缺血和心肌梗死等心血管疾病有细胞凋亡现象存在[1]。细胞凋亡是按细胞的固有基因程序进行的一种生理现象,不同于一般病理情况下的细胞死亡,是机体为维护内环境的稳定,通过基因调控和酶促反应进行的细胞程序化死亡。近些年来研究发现,硫化氢(hydrogen sulfide,H2S)在机体内发挥着广泛的生物学效应,本研究室前期实验表明,大鼠在急性心肌缺血过程中内源性H2S的含量明显下降,心肌组织CSE活性明显降低,线粒体功能受损,给予H2S可明显减轻心肌缺血损伤,改善心功能和线粒体功能,从而有效保护缺血的心肌[2-3]。但是其对缺血心肌细胞凋亡的影响尚未见报道。本实验观察了H2S供体—硫氢化钠(NaHS)对大鼠急性心肌缺血后心肌细胞凋亡率、caspase-3、Bcl-2和Bax蛋白表达的影响,旨在进一步探讨H2S对缺血受损心肌的作用及其可能机制。
1 材料与方法
1.1 药物和试剂 NaHS、溴化乙啶(ethidium bromide,EB),美国Sigma公司。考马斯亮蓝试剂盒购自南京建成生物工程研究所。兔抗活化型caspase-3单抗,武汉博士德。鼠抗Bcl-2单抗、鼠抗Bax单抗、丙烯酰胺、N,N-亚甲双丙烯酰胺,美国Santa Cruz公司。免疫组化检测试剂盒、DAB试剂盒、辣根酶标记山羊抗兔购自北京中杉金桥生物技术公司。
1.2 仪器 电动匀浆器(Silentcrusher M,德国Heidolph公司)。电泳仪(DYY-Ⅲ7B型)。水浴式电转膜仪(DYY-Ⅲ40B型)。显微镜(Olympus BX40型)。低温高速离心机(德国Eppendorf)。流式细胞仪(Epics-XLⅡ型)。
1.3 实验动物 健康♂Sprague-Dawley(SD)大鼠,8~10周龄,体质量(270±20)g,由河北省实验动物中心提供。
1.4 模型制备及动物分组
1.4.1 大鼠急性心肌缺血模型制备 将大鼠用10%水合氯醛350 mg·kg-1腹腔注射麻醉,取仰卧位固定,剪去胸前手术区毛,碘酒消毒,用血管钳沿第4肋间钝性分离肋间肌约3 cm长,打开胸腔,撑开4、5肋骨剪开心包膜将心脏轻轻挤出,在左心耳与肺动脉圆锥之间平左心耳下缘迅速结扎冠状动脉左前降支近段,立即关闭胸腔挤出胸腔内的气体,以恢复负压,帮助大鼠恢复自主呼吸。将肌肉层和皮肤分别缝合,制备急性心肌缺血模型。
1.4.2 动物分组与给药 健康成年♂ SD大鼠40只随机分为5组,每组8只,分别为:① 假手术组;②缺血组;③ 缺血 +NaHS低剂量组;④ 缺血 +NaHS中剂量组;⑤缺血+NaHS高剂量组。缺血组结扎左冠状动脉前降支3 h时腹腔注射2 ml·kg-1生理盐水,缺血+NaHS低、中、高剂量组分别于结扎左冠状动脉前降支3 h时腹腔注射0.78、1.56和3.12 mg·kg-1的NaHS(用时现用生理盐水配置,均为2 ml·kg-1),假手术组只穿线不结扎,各组大鼠均于结扎左冠状动脉前降支6h时处死,取心脏备用。取心尖部分心肌置于10%甲醛溶液中固定用于免疫组化法检测;置于 -80℃冰箱保存,进行Western blot分析;置于70%的乙醇溶液中固定用于FCM测定。
1.5 检测指标和方法
1.5.1 流式细胞术(flow cytometry,FCM)检测心肌细胞凋亡 于实验结束后取心尖部,剪碎,70%冷乙醇固定。弃去固定组织的70%酒精,生理盐水冲洗心肌组织块,在100目的不锈钢网上研磨,边研磨边用PBS冲洗于容器中,用200目铜网过滤并收集悬液,1 000 r·min-1,离心 10 min,弃上清,用 PBS 制成单细胞悬液。应用美国Beckman-Coulter公司生产的Epics-XLⅡ型流式细胞仪,激发光源300 mW氩离子激光器,激发波长488 nm,检测前调整仪器CV值在2%以内。每个样本检测10 000个细胞,以DNA组方图出现低于G1期DNA含量的亚G1峰的大小代表凋亡细胞的多少,用Expo32 ADC软件分析处理免疫荧光数据,计算凋亡百分率。
1.5.2 Western blot检测 caspase-3蛋白表达 将裂解的心肌组织离心,上清液与点样缓冲液热变性,做聚丙烯酰胺凝胶电泳,转膜,用吐温-PBS洗涤,5%脱脂奶粉封闭,加稀释的caspase-3一抗,再加相应的二抗,DAB显色后立即用水冲洗,照相,经扫描后用美国UVP公司Lab Works 4.5软件处理,确定相对吸光度值(每次对照的吸光度值为相对值1)。
1.5.3 免疫组化法检测Bcl-2和Bax蛋白表达采用ABC法,DAB显色。Bcl-2、Bax阳性表达呈棕黄色颗粒。每张切片随机选取10个高倍视野,分别计数阳性表达心肌细胞数和心肌细胞总数并进行汇总,计算蛋白表达阳性心肌细胞数占心肌细胞总数的百分率。
1.6 HE染色观察心肌组织学变化 于实验结束后摘取心脏,冰生理盐水冲净血液,取左心室前壁部分组织,4%多聚甲醛固定,用70% ~100%的酒精梯度脱水,二甲苯中透明两次,入石蜡内进行包埋,将修好的石蜡块固定于石蜡切片机上切片,厚度为4 μm,将完全展开的石蜡片贴附于清洁载玻片上,4℃ 保存备用,常规HE染色。
2 结果
2.1 心肌缺血后细胞凋亡率的变化 心肌缺血6 h后缺血组大鼠心肌组织细胞凋亡率明显高于假手术组(P<0.01);NaHS 3个剂量组大鼠心肌组织细胞凋亡率明显低于相应的缺血组(P<0.05或P<0.01,Tab 1,Fig 1)。
2.2 心肌缺血后细胞Bcl-2、Bax蛋白表达及Bcl-2/Bax比值的变化 免疫组化结果显示,Bcl-2和Bax蛋白阳性表达呈棕黄色颗粒,主要在心肌细胞和内皮细胞胞质表达,假手术组大鼠心肌细胞可见少量的Bcl-2和Bax蛋白阳性细胞,缺血组大鼠心肌细胞可见少量的Bcl-2和大量Bax蛋白阳性细胞,与假手术组比较,缺血组大鼠心肌细胞Bax蛋白表达明显升高(P<0.01),Bcl-2蛋白表达无明显变化(P>0.05),Bcl-2/Bax比值明显降低(P<0.01)。与缺血组比较,缺血3 h时给予NaHS低、中、高剂量治疗大鼠心肌组织Bcl-2蛋白表达明显升高(P<0.01),Bax蛋白表达明显降低(P<0.01),Bcl-2/Bax比值明显升高(P <0.01,Tab 1,Fig 2,3)。
Tab 1 Effects of NaHS on the apoptosis rate and the expression of caspase-3,bcl-2 and Bax,and bcl-2/Bax in myocardium after ischemia in rats(±s,n=8)
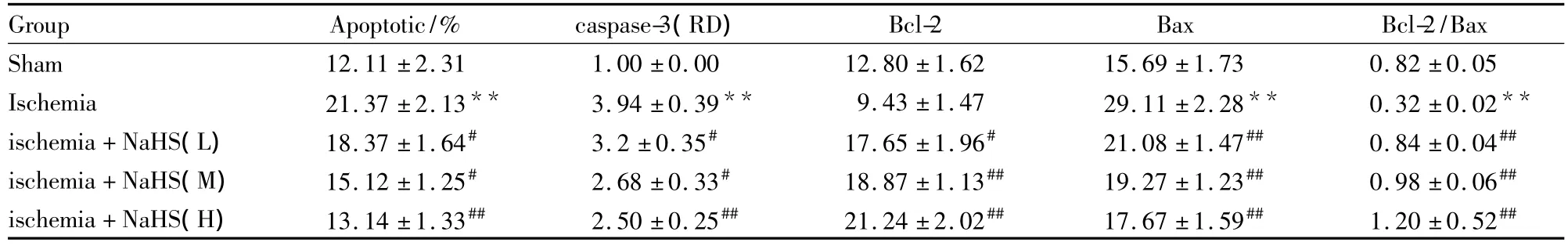
Tab 1 Effects of NaHS on the apoptosis rate and the expression of caspase-3,bcl-2 and Bax,and bcl-2/Bax in myocardium after ischemia in rats(±s,n=8)
**P <0.01 vs sham group;#P <0.05,##P <0.01 vs ischemia group
Group Apoptotic/% caspase-3(RD)Bcl-2 Bax Bcl-2/Bax Sham 12.11 ±2.31 1.00 ±0.00 12.80 ±1.62 15.69 ±1.73 0.82 ±0.05 Ischemia 21.37 ±2.13** 3.94 ±0.39** 9.43 ±1.47 29.11 ±2.28** 0.32 ±0.02**ischemia+NaHS(L)18.37 ±1.64# 3.2 ±0.35# 17.65 ±1.96# 21.08 ±1.47## 0.84 ±0.04##ischemia+NaHS(M)15.12 ±1.25# 2.68 ±0.33# 18.87 ±1.13## 19.27 ±1.23## 0.98 ±0.06##ischemia+NaHS(H)13.14 ±1.33## 2.50 ±0.25## 21.24 ±2.02## 17.67 ±1.59## 1.20 ±0.52##
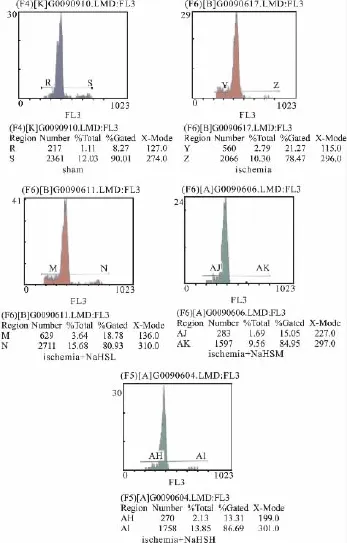
Fig 1 Change of the apoptosis rate(%)in myocardium after ischemia in rats
2.3 心肌组织的形态学变化 HE染色光镜观察结果显示,假手术组大鼠心肌细胞排列整齐,着色均匀。缺血组大鼠部分区域心肌纤维横纹不齐或消失,核偏移甚至裂解消失,有炎性因子渗出。NaHS低、中、高剂量治疗组大鼠心肌缺血损伤程度明显减轻(Fig 4)。
2.4 心肌缺血后caspase-3蛋白表达的变化Western blot检测结果显示,假手术组大鼠心肌细胞仅有少量的caspase-3的表达;缺血后各组caspase-3表达量均明显增加,缺血3 h治疗3 h时,NaHS低、中、高剂量组与缺血组比较,心肌细胞caspase-3表达明显降低 (P <0.05,Tab 1,Fig 5)。
3 讨论
细胞凋亡作为细胞主动死亡形式具有复杂的分子生物学机制,受许多因素的影响,细胞凋亡的发生主要受细胞内凋亡调节蛋白的调控,细胞凋亡的发生是促凋亡蛋白和抗凋亡蛋白之间平衡丧失的结果,Bcl-2家族在各类刺激信号引起的凋亡中起关键作用[4],其中Bcl-2和Bax是与凋亡密切相关的基因,Bcl-2为凋亡抑制基因,是膜的整合蛋白,在线粒体参与的凋亡途径中起调控作用,能控制线粒体中细胞色素C等凋亡因子的释放,抑制细胞凋亡,而Bax则介导细胞凋亡。当Bcl-2过量时,形成Bcl-2同源二聚体,细胞受到保护。当Bax过量时,形成Bax同源二聚体,细胞则趋向凋亡,Bcl-2的抗凋亡作用是通过与Bax组成异源二聚体,从而阻止Bax介导凋亡的作用,因此,在凋亡刺激因子(如细胞色素C、凋亡诱导因子、核酸内切酶G)等作用下,这两种蛋白的比例决定了细胞是凋亡还是存活[5]。caspase家族是细胞凋亡的启动者和执行者,其中caspase-3是caspase级联下游一种与细胞凋亡密切相关的蛋白酶[6]。正常情况下,胞质中caspase-3以无活性的酶原形式存在,激活后可引起细胞凋亡,研究表明,心肌缺血/再灌注损伤的心肌中存在大量的凋亡细胞,认为心肌缺血可通过诱导氧化应激状态和促进死亡受体及配体的表达激活caspase-3,引起心肌细胞凋亡[7-9]。Bcl-2可通过干扰细胞色素C的释放而阻断上游caspase-3蛋白酶的激活,抑制细胞凋亡。Bax蛋白作为线粒体膜上离子通道的组成成分,使细胞色素 C得以穿过线粒体膜,激活caspase-9,进一步激活 caspase-3,导致细胞凋亡[10-11]。
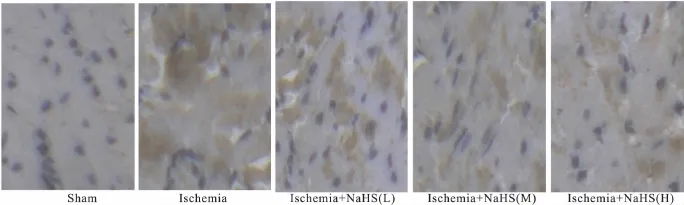
Fig 2 Change of the expression of Bax in myocardium after ischemia in rats
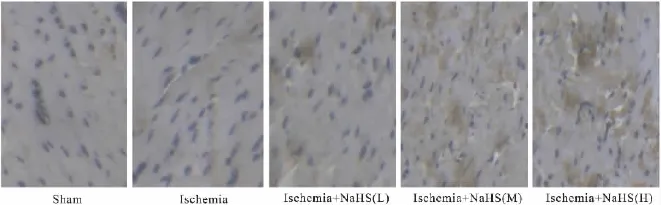
Fig 3 Change of the expression of Bcl-2 in myocardium after ischemia in rats
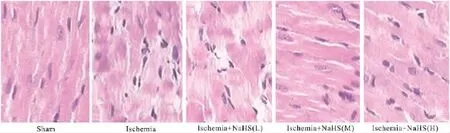
Fig 4 Pathological changes of myocardium by optical microscope after ischemia in rats(×400)
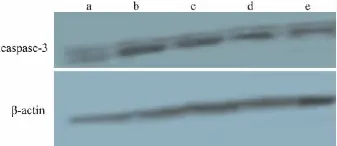
Fig 5 Change of the expression of Caspase-3 in myocardial tissue in rats
本实验结果显示,急性心肌缺血后,心肌损伤明显,caspase-3蛋白表达明显增加,Bcl-2蛋白表达降低,Bax蛋白表达则明显升高,Bcl-2/Bax比值降低。假手术组大鼠心肌细胞可见较弱的caspase-3表达,可能是手术刺激所致。缺血后3 h经 H2S供体NaHS治疗,心肌缺血损伤明显减轻,心肌细胞caspase-3蛋白表达明显降低,Bcl-2蛋白表达明显升高,Bax蛋白表达明显降低,Bcl-2/Bax比值明显升高。因此,在心肌缺血后,H2S减轻心肌缺血损伤、抑制急性心肌缺血损伤引起细胞凋亡的机制可能与上调Bcl-2蛋白表达,下调Bax、caspase-3蛋白表达,升高Bcl-2/Bax比值有关,但是对其他细胞凋亡相关蛋白是否也有影响以及相关的作用机制,尚需进一步深入研究。
[1] Olivetti G,Quaini F,Sala R,et al.Acute myocardial iinfarction in humans is associated with activation of programmed myocyte cell death in the surviving portion of the heart[J].J Mol Cell Cardiol,1996,28(9):2005 -16.
[2] 刘 芳,张建新,李兰芳,等.硫化氢对急性心肌缺血大鼠心肌线粒体损伤的影响[J].中国应用生理学杂志,2011,27(2):158-62.
[2] Liu F,Zhang J X,Li L F,et al.Effects of hydrogen sulfide on myocardial mitochondrial injury during acute myocardial ischemia in rats[J].Chin J Appl Physiol,2011,27(2):158 - 62.
[3] 刘 芳,张建新,李兰芳,等.硫化氢对大鼠急性心肌缺血损伤心肌功能的影响[J].中国药理学通报,2010,26(10):1334-8.
[3] Liu F,Zhang J X,Li L F,et al.Effects of hydrogen sulfide on cardial function induced by acute myocardial ischemia in rats[J].Chin Pharmacol Bull,2010,26(10):1334 -8.
[4] Babu P P,Suzuki G,Ono Y,et al.Attenuation of ischemia and/or reperfusion injury during myocardial infarction using mild hypothermia in rats:an immunohistochemical study of bcl-2,bax,Bak and TUNEL[J].Pathol Int,2004,54(12):896 -903.
[5] McCintock D S,Santore M T,Lee V Y,et al.Bcl-2 family memders and functional electron transport chain regulate oxygen deprivation-induced cell death[J].Mol Cell Biol,2002,22(1):94 -104.
[6] 李 琴,郭云良,李 霞,等.胡黄连苷对大鼠脑缺血/再灌注损伤Caspase-3和PARP表达的影响[J].中国药理学通报,2010,26(3):342 -5.
[6] Li Q,Guo Y L,Li X,et al.The interference of picrosideⅡ on the expression of Caspase-3 and PARP folowing cerebral ischemia reperfusion injury in rats[J].Chin Pharmacol Bull,2010,26(3):342-5.
[7] 尹瑞兴,卡扎里,刘唐威,等.普罗布考对缺血/再灌注心肌细胞凋亡的作用[J].中国临床康复,2004,8(24):5202-4.
[7] Yin R X,Ka Z L,Liu T W,et al,Effect of Probucol on the cardiomyocyte apoptosis during ischemia and reperfusion[J].Chin J Clin Rehabil,2004,8(24):5202 -4.
[8] 史婷婷,白建平,梁月琴,等.芹菜素对大鼠缺血/再灌注心肌细胞凋亡及相关蛋白 Bcl-2、Bax、Caspase-3表达的影响[J].中国药理学通报,2011,27(5):666 -70.
[8] Shi T T,Bai J P,Liang Y Q,et al.Effect of apigenin on the cardiomyocyte apoptosis in rats with ischemia and reperfusion and the expression of Bcl-2,Bax,Caspase-3[J].Chin Pharmacol Bull,2011,27(5):666 -70.
[9] 张羽冠,宋宏宇,李 蓥,等.蒺藜皂苷预适应对大鼠心肌缺血/再灌注损伤的保护作用[J].中国药理学通报,2010,26(6):714 -8.
[9] Zhang Y G,Song H Y,Li Y,et al.Protective effect of GSTT preconditioning on myocardial ischemia-reperfusion injury in rats[J].Chin Pharmacol Bull,2010,26(6):714 -8.
[10] Voutsadakis I A.Apoptosis and the pathogenesis of lymphoma[J].Acta Oncol,2000,39:151 -6.
[11] Schon E A,Manfredi G.Neuronal degeneration and mitchondrial dysfunction[J].Clin Invest,2003,119(3):303 -12.