具有非对映选择性还原6-氰基-(5R)-羟基-3-羰基己酸叔丁酯活性的微生物菌株筛选与鉴定
2012-07-27毛芳芳王亚军魏积福郑裕国
毛芳芳, 王亚军, 罗 希, 魏积福, 郑裕国
(浙江工业大学 生物工程研究所 生物转化与生物净化教育部工程中心,浙江 杭州 310014)
冠状动脉心脏病是世界上造成死亡最主要的疾病之一。世界卫生组织统计数据显示,每年死于冠状动脉心脏病的人数超过760万。流行病学研究证实冠状动脉心脏病与高胆固醇血症有很大的关系。许多降胆固醇药物被成功开发并上市[1],其中阿托伐他汀钙最畅销,2008年销售额达到300亿美元[2]。6-氰基-(3R,5R)-二羟基己酸叔丁酯是合成阿托伐他汀钙的关键手性前体[3],传统的6-氰基-(3R,5R)-二羟基己酸叔丁酯化学合成法不仅使用昂贵的硼烷类试剂和正丁基锂,而且要在低于-60 ℃的条件下进行反应,消耗大量的能量和有机溶剂[4~6]。
生物转化与生物催化提供了一种高效、温和、环境友好、选择性高的手性合成方法[7]。羰基还原酶普遍存在于细菌、酵母及真菌中,为生物不对称还原酮酯制备光学纯β-羟基酯提供了一条有效的途径,已成功应用于化学制品、食品、农用化学品和制药工业等来制备手性醇[8]。然而,大多数天然羰基还原酶催化的不对称还原都遵守Prelog法则,具有反Prelog法则的立体选择性羰基还原酶十分稀少,其精确机理也尚不清楚[9]。作者筛选得到一株具有非对映选择性还原6-氰基-(5R)-羟基-3-羰基己酸叔丁酯活性的菌株X25 ,对其进行鉴定,并考察了其催化性能。合成机理见图1。
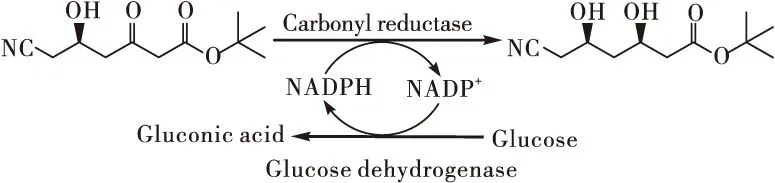
图1 羰基还原酶不对称还原6-氰基-(5R)-羟基-3-羰基己酸叔丁酯制备6-氰基-(3R,5R)-二羟基己酸叔丁酯
1 实验
1.1 试剂
6-氰基-(3R,5R)-二羟基己酸叔丁酯标准品,Toronto化学制品研究公司;6-氰基-(5R)-羟基-3-羰基己酸叔丁酯,浙江新东港药业股份有限公司;蛋白胨、酵母膏、琼脂,市售生化试剂;其它试剂均为分析纯。
1.2 培养基
富集培养基(g·L-1):葡萄糖50.0,黄豆芽100.0 (称取100.0 g黄豆芽,加水煮沸30 min后纱布过滤),6-氰基-(5R)-羟基-3-羰基己酸叔丁酯11.4,pH值自然。
斜面培养基(g·L-1):葡萄糖50.0,黄豆芽100.0 (称取100.0 g黄豆芽,加水煮沸30 min后纱布过滤),琼脂20.0,pH值自然。
发酵培养基(g·L-1):葡萄糖20.0,酵母膏20.0,NaCl 1.0, KH2PO42.5,(NH4)2HPO42.5,MgSO40.030, 6-氰基-(5R)-羟基-3-羰基己酸叔丁酯0.2% (体积分数),pH值7.0。培养基灭菌冷却后添加6-氰基-(5R)-羟基-3-羰基己酸叔丁酯,以诱导提高羰基还原酶活性。
酶活定义:在30 ℃、pH值7.0条件下,每分钟催化生成1 μmol 6-氰基-(3R,5R)-二羟基己酸叔丁酯所需的酶量定义为一个酶活单位。
1.3 菌株的筛选
用于菌株筛选的土样采集于全国各地。称取1.0 g土样,分散到10.0 mL 0.85%(质量浓度)生理盐水中,移取2.0 mL土壤悬浮液接种至盛有28.0 mL富集培养基的250 mL摇瓶中,28 ℃、150 r·min-1培养至培养基浑浊。移取2.0 mL培养液接种至28.0 mL无菌富集培养基中,在上述条件下培养至培养基浑浊。连续富集3次后稀释涂固体平板,30 ℃培养至长出清晰的单菌落,挑取单菌落接种至斜面培养基,30 ℃培养36 h后于4 ℃冰箱中保存。
斜面接种于发酵培养基中,30 ℃培养48 h后取20 mL发酵液离心收集菌体检测还原酶活性。挑选活力和选择性最好的菌株X25,对其进行分离纯化鉴定。鉴定过的菌株用20%(体积分数)甘油保存于-80 ℃低温冰箱中。
1.4 菌株鉴定
利用Biolog自动微生物鉴定系统考察菌株X25对65种不同碳源的代谢情况。将菌株接种于酵母平板培养基,28 ℃恒温培养2 d,用无菌棉签将平板上的菌体转移并分散于无菌水中,混匀,制成菌悬液,用浊度计调整透光率至47%。分别移取菌悬液至Biolog YT微孔鉴定板,每孔100 μL。将微孔鉴定板放在28 ℃培养箱中,分别培养24 h、48 h和72 h后置于Biolog读数仪上读取结果。
分子鉴定首先提取X25的基因组DNA,利用引物pITS1:5′-TCCGTAGGTGAACCTGCGG-3′和pITS4:5′-TCCTCCGCTTATTGATATGC-3′,在PTC-200型PCR仪 (Bio-Rad,USA)上进行扩增。扩增条件如下:95 ℃,4 min;94 ℃ 50 s,55 ℃ 1 min,72 ℃ 1.5 min,35个循环;72 ℃,10 min。扩增产物用琼脂糖凝胶电泳检测,并用AxyPrep DNA 凝胶回收试剂盒回收目的DNA。根据T/A克隆步骤(Takara,日本)将得到的目的基因与pMD18-T载体连接[10]。将重组的质粒导入感受态E.coliJM109[11],然后在含有50 μg·mL-1氨卞青霉素的LB平板上生长。将阳性克隆记为E.coliJM109/pMD18-T-X25,并电泳检测。E.coliJM109/pMD18-T-X25于37 ℃在含有氨卞青霉素的LB平板上培养过夜,收集菌体,用AxyPrep质粒DNA小量试剂盒提取质粒后对基因序列进行检测。Blast所获得的序列用于和GenBank 数据库中的基因序列进行对比。18S rDNA全序列用CLUSTAL W ver.1.81 A软件包排序,用MEGAversion 2.1软件包中的 Kimura2-Parameter Distance 模型计算进化距离,用Neighbour-Joining法构建系统发育树,1000次随机抽样,计算自引导值,以评估系统发育树的置信度。
1.5 转化条件
取0.5 gP.guilliermondiiX25静息细胞分散于10 mL含20 g·L-1葡萄糖的磷酸缓冲溶液(pH值7.0,50 mmol·L-1)中,30 ℃预热2.0 min后加入6-氰基-(5R)-羟基-3-羰基己酸叔丁酯 (终浓度10 g·L-1)。混匀,于30 ℃反应10 h,转化过程中每隔2 h取样0.8 mL,用100 μL HCl灭活,然后用同样浓度的100 μL NaOH溶液中和,12 000 r·min-1离心10 min,上清液经0.45 μm微滤膜过滤。取澄清滤液测定生成的6-氰基-(3R,5R)-二羟基己酸叔丁酯浓度和残余6-氰基-(5R)-羟基-3-羰基己酸叔丁酯浓度。
1.6 分析检测
6-氰基-(5R)-羟基-3-羰基己酸叔丁酯、6-氰基-(3R,5R)-二羟基己酸叔丁酯及其非对映异构体用LC-20AD型高效液相色谱仪(岛津)检测。色谱条件为:大连依利特Hypersil ODS2 C18柱 (4.6 mm×250 mm,2.5 μm),流动相为乙腈-水(1∶3,体积比),流速1.0 mL·min-1,柱温30 ℃。
2 结果与讨论
2.1 菌株的鉴定
对筛选得到的菌种进行酶活和非对映选择性检测,发现菌株X25作用6-氰基-(5R)-羟基-3-羰基己酸叔丁酯的羰基还原酶活性最强、非对映选择性最高,产物构型符合反Prelog法则。菌株X25细胞呈卵状或瓜子状,细胞大小(1.4~2.5) μm×(1.4~5.0) μm,在平板上形成圆形、乳白色、不透明、中间凸起、表面光滑的菌落(图2)。Biolog鉴定结果见表1。
由表1可知,菌株X25能够较好地利用42种碳源,对其它23种碳源不能利用或利用能力较弱。基于Biolog鉴定系统分析结果,菌株X25与PichiaguilliermondiiA标准菌株相似,相似性指数为1.000。

表1 菌株X-25对Biolog YT板上65种碳源的利用能力
注:+,阳性;-,阴性;B,交界。

图2 菌株X25在豆芽汁平板上的菌落形态
提取菌株X25的18S rDNA,测序后,从Gen-Bank数据库挑取与X25 18S rDNA 序列相似的序列,并用MegAlign 软件(DNASTAR公司,美国)绘制进化发育树(图3)。将获得的序列与GenBank中的数据进行相似性分析,结果发现菌株X25与Pichiaguilliermondii(FJ 969194.1)同源性最高 (100%/607 bps,18S rDNA)。因此,菌株X25属于Pichia属的Guilliermondii种,中文名称为季也蒙毕赤酵母。基于生理生化特征与18S rDNA分子鉴定,菌株X25被鉴定为季也蒙毕赤酵母。该菌株保存于中国典型培养物保藏中心(CCTCC),菌种保藏号CCTCC M 2011386。

图3 菌株X25的系统进化发育树
2.2 P.guilliermondii X25发酵动力学
将P.guilliermondiiX25接种于常用毕赤酵母培养基,每隔2 h取样分析发酵液羰基还原酶活性,结果见图4。
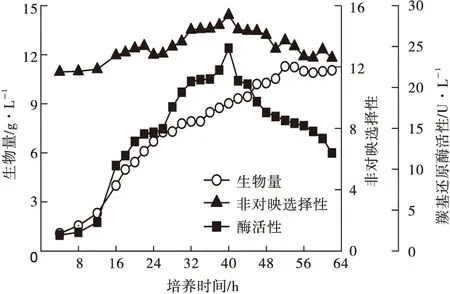
图4 培养时间对P.guilliermondii X25生物量、羰基还原酶活性和非对映选择性的影响
由图4可知,培养时间对P.guilliermondiiX25羰基还原酶活性、非对映选择性和生物量影响显著,培养40 h后,P.guilliermondiiX25 发酵液羰基还原酶活性达到峰值,约24.79 U·L-1。在整个培养进程中,非对映选择性介于11.7~15.4之间,表明P.guilliermondiiX25具有较好的非对映选择性。
2.3 温度、pH值对P.guilliermondii X25静息细胞羰基还原酶活性的影响
温度、pH值对P.guilliermondiiX25静息细胞羰基还原酶活性的影响见图5。

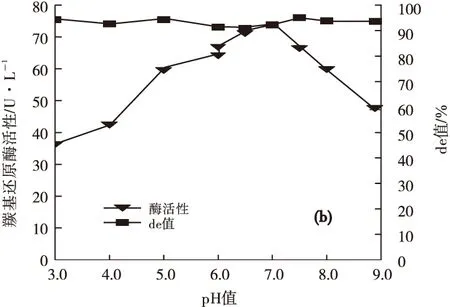
图5 温度(a)、pH值(b)对P.guilliermondii X25静息细胞羰基还原酶活性的影响
由图5可知,在温度22~43 ℃范围内,P.guilliermondiiX25静息细胞表现出较好的非对映选择性,产物de值在90%左右,35 ℃时P.guilliermondiiX25静息细胞羰基还原酶活性达到最高,约44.3 U·L-1,温度超过37 ℃时,酶活性急剧下降(图5 a);在pH值5.0~8.0范围内,P.guilliermondiiX25静息细胞羰基还原酶具有较好的活性和非对映选择性,在pH值7.0的磷酸缓冲溶液中酶活性最高,达到74.04 U·L-1(图5b)。
2.4 P.guilliermondii X25非对映选择性还原6-氰基-(5R)-羟基-3-羰基己酸叔丁酯
P.guilliermondiiX25非对映选择性还原6-氰基-(5R)-羟基-3-羰基己酸叔丁酯进程曲线见图6。

图6 P.guilliermondii X25非对映选择性还原6-氰基-(5R)-羟基-3-羰基己酸叔丁酯进程
由图6可知,转化1 h时,底物6-氰基-(5R)-羟基-3-羰基己酸叔丁酯转化率为3.4%,产物6-氰基-(3R,5R)-二羟基己酸叔丁酯de值接近100%;随着转化时间的延长,6-氰基-(5R)-羟基-3-羰基己酸叔丁酯浓度显著降低,然而6-氰基-(3R,5R)-二羟基己酸叔丁酯de值随即降至90.4%。这与P.guilliermondiiX25的非对映选择性介于11.7~15.4之间有关,高的底物转化率导致低的6-氰基-(3R,5R)-二羟基己酸叔丁酯de值。
3 结论
从自然环境中筛选获得一株对6-氰基-(5R)-羟基-3-羰基己酸叔丁酯具有羰基还原酶活性的菌株X25,结合表型特征、生理生化特征和分子遗传学鉴定,该菌株属于Pichiaguilliermondii。利用P.guilliermondiiX25静息细胞成功建立了光学纯6-氰基-(3R,5R)-二羟基己酸叔丁酯的生物催化合成工艺,最佳催化条件为35 ℃、pH值7.0;在低底物转化率时,能够制备光学纯6-氰基-(3R,5R)-二羟基己酸叔丁酯。丰富了他汀类药物关键手性侧链的合成技术。鉴于P.guilliermondiiX25羰基还原酶的活性和非对映选择性仍有提升空间,利用现代生物技术对该羰基还原酶进行后续分子改造十分必要。
[1] Pfefferkorn J A,Bowles D M,Kissel W,et al.Development of a practical synthesis of novel,pyrrole-based HMG-CoA reductase inhibitors[J].Tetrahedron,2007,63(34):8124-8134.
[2] Casar Z.Historic overview and recent advances in the synthesis of super-statins[J].Curr Org Chem,2010,14(8):816-845.
[3] Wolberg M,Villela M,Bode S,et al.Chemoenzymatic synthesis of the chiral side-chain of statins:Application of an alcohol dehydrogenase catalysed ketone reduction on a large scale[J].Bioprocess Biosyst Eng,2008,31(3):183-191.
[4] Scheffler J L,Bette V,Mortreux A,et al.Preparation and stereoselective hydrogenation of chiral (4-hydroxy-tetrafuranylidene)carboxylates:A new formal entry to functional anti- and syn-3,5-dihydroxyesters[J].Tetrahedron Lett,2002,43(15):2679-2682.
[5] Everaere K,Franceschini N,Mortreux A,et al.Diastereoselective synthesis of syn-3,5-dihydroxyesters via ruthenium-catalyzed asymmetric transfer hydrogenation[J].Tetrahedron Lett,2002,43(14):2569-2571.
[6] Everaere K,Carpentier J F,Mortreux A,et al.Ruthenium catalyzed asymmetric transfer hydrogenation of beta-ketoesters[J].Tetrahedron-Asymmetry,1998,9(17):2971-2974.
[7] Pfruender H,Amidjojo M,Hang F,et al.Production ofLactobacilluskefircells for asymmetric synthesis of a 3,5-dihydroxycarboxylate[J].Appl Microbiol Biotechnol,2005,67(5):619-622.
[8] Goldberg S,Guo Z W,Chen S,et al.Synthesis of ethyl-(3R,5S)-dihydroxy-6-benzyloxy hexanoates via diastereo- and enantioselective microbial reduction:Cloning and expression of ketoreductase Ⅲ fromAcinetobactersp.SC 13874[J].Enzyme Microb Technol,2008,43(7):544-549.
[9] Nie Y,Xiao R,Xu Y,et al.Novel anti-prelog stereospecific carbonyl reductases fromCandidaparapsilosisfor asymmetric reduction of prochiral ketones[J].Org Biomol Chem,2011,9(11):4070-4078.
[10] Liu Z Q,Sun Z H,Leng Y.Directed evolution and characterization of a novel D-pantonohydrolase fromFusariummoniliforme[J].J Agric Food Chem,2006,54(16):5823-5830.
[11] Chung C T,Niemela S L,Miller R H.One-step preparation of competentEscherichiacoli:Transformation and storage of bacterial cells in the same solution[J].Proc Natl Acad Sci USA,1989,86(7):2172-2175.
