无患子皂苷对自发性高血压大鼠降压及内皮损伤保护作用的实验研究
2012-07-25陈志武龙子江张衍让王雅娟高华武任晨晨
陈 明, 陈志武, 龙子江, 张衍让, 王雅娟, 高华武, 任晨晨
(1.安徽中医学院药理学教研室,安徽合肥230038;2.安徽医科大学基础医学院,安徽合肥230031;3.安徽省化工研究院,安徽合肥230041)
无患子皂苷 (sapindus saponin)是从无患子科植物无患子树的种子无患子假种皮中提取的有效部位。有关无患子的药用在《本草拾遗》、《本草纲目》中均有记载,性味苦平,具有清热、解毒、祛痰等功效。本实验以此作为研究的出发点,通过检测原发性高血压大鼠的尾动脉收缩压等指标考察无患子皂苷的降压效果;通过检测血清IL-1、IL-6、TNF-α水平及血管内皮ICAM-1等炎症因子的表达,考察其对内皮损伤及血管重构的保护机制,为进一步深入研究该类药物的作用机制、完善中医治疗理论提供一定的科学依据。
1 实验材料
1.1 实验药物 无患子的成熟果实,水洗、晾干、去籽、粉碎,加12倍量水煎煮3次,每次1 h。提取液过滤、浓缩,上大孔吸附树脂柱,依次用水、20%乙醇和70%乙醇洗脱,收集70%乙醇洗脱液,减压回收乙醇后以混合溶剂萃取,即得淡棕色粉末,为无患子总皂苷。以常春藤皂苷元为对照品,紫外分光光度法测定,无患子总皂苷质量分数为95.6%,由安徽省化工研究院提供。
1.2 阳性对照药物 卡托普利片 (Captopril Tablets),25 mg/片,上海普康药业有限公司产品,批号:101003。
1.3 实验试剂 白细胞介素1β(IL-1β)、白细胞介素-6(IL-6)、肿瘤坏死因子-α(TNF-α)放免试剂盒,均购于北京华英生物技术研究所,批号:20110328;ICAM-1兔抗鼠多克隆抗体,购于北京中杉金桥生物技术有限公司,批号:14520a。
1.5 实验动物 14周龄自发性高血压大鼠32只,雌雄各半,体质量 (200~250)g,由北京维通利华实验动物技术有限公司提供,实验动物生产许可证号:SCXK(京)2007-001;相同周龄健康Wistar大鼠8只,雌雄各半,体质量 (200~250)g,由南京医科大学动物中心提供,实验动物生产许可证号:SCXK(苏)2008-0004。
1.6 实验设施 安徽医科大学实验动物中心,SPF级,实验动物使用许可证号:SYXK(皖)2011-007。
2 实验方法
2.1 动物分组及给药 取自发性高血压大鼠32只,雌雄各半 (雌性未孕),体质量200~250 g,适应实验室5 d,每天测血压1次,以使大鼠适应环境和检测刺激。然后称质量、编号,随机均分为4组,每组8只,即自发性高血压大鼠模型对照组、阳性对照组 (卡托普利,27 mg/kg)、无患子皂苷低 (27 mg/kg)、高剂量组 (108 mg/kg)。另取8只健康Wistar大鼠作为正常对照组。各药物组大鼠分别按照上述剂量灌胃给药,给药容积为1 mL/100g体质量,正常对照组和自发性高血压大鼠模型对照组大鼠灌胃等容量蒸馏水,给药时间持续8周。
2.2 一般状态观察 期间,观察大鼠的精神、饮水、摄食、排便、毛色、体质量、活动度等情况。大鼠易激惹程度分为Ⅲ级:Ⅰ级指捉持大鼠颈部时无明显反应;Ⅱ级指捉持大鼠颈部时尖叫、惊跳;Ⅲ级指捉持大鼠颈部时咬人或同笼大鼠频繁打斗。
2.3 血压测定 用Bp-6无创血压测量系统测定大鼠尾动脉收缩压。在大鼠安静状态下,连续测收缩压3次,取平均值作为测压结果。观察指标:①单次给药降压效果,测给药前大鼠血压、首次药后30、60、90、120、240 min的血压情况;②连续给药降压情况,分别测定1、4、7、10、13、16、19、22、25、28、35、42、49、56 d 药后 30 min血压 (由单次给药结果可知,无患子皂苷高剂量组在药后30 min开始起效),每天重复测量3次,取所得平均值作为最终的血压值。
2.4 血清及血管内皮炎症因子水平测定 末次药后待血压测定完成后,用20%乌拉坦腹腔麻醉,腹主动脉取血4 mL,静置、分离血清,放免法检测血清 IL-1、IL-6、TNF-α水平,实验方法严格按照试剂盒说明书进行操作。取腹主动脉血管置入福尔马林中固定、脱水透明、包埋切片,免疫组化法检测血管内皮ICAM-1的表达水平,以光镜下观察到内皮细胞胞浆及间质内黄色、棕黄色或棕褐色颗粒状物质为阳性表达,按阳性染色细胞所占比例分为3级:阳性染色细胞占15%~35%为弱阳性反应 (+);阳性染色细胞占36%~75%为阳性反应 (++);阳性染色细胞占75%以上为强阳性反应 (+++)。并用JEDR801D形态学图像分析系统Version6.0进行图像半定量拍照并分析,每张切片随机选取不重叠的5个视野,测定其积分光密度值,取其平均值代表达水平,结果以阳性率和吸光度值表示。
2.5 主动脉血管HE及Masson胶原染色 取胸主动脉血管置入福尔马林中固定,脱水透明、包埋切片。HE染色于×200高倍镜下观察组织形态学变化,并摄片,用Leica光学显微镜采图,并用BI2000图像分析系统对HE染色图片进行图像分析,依次测定血管中膜厚度 (media thickness,MT)及腔径 (luminal diameter,ID)、中膜面积 (medial area,MA)及管腔面积 (luminal area,LA),并计算中膜厚度与腔径比 (MT/LD)、中膜面积与管腔面积比 (MA/LA);Masson胶原染色,用于观察血管平滑肌胶原沉积情况。
设两天线间距满足对消条件D=Tv,其中T为SAR信号脉冲重复周期,v为SAR平台运行速度.假设场景任意点目标Z和散射区域内的任意散射点S,An、Bn分别表示两天线在第n个脉冲时刻的位置,在经历了一个脉冲重复周期T后,a天线到达b天线的n时刻位置,此时两天线在第n+1个脉冲时刻的位置分别为An+1、Bn+1.记b天线在第n+1个脉冲时刻接收的点目标Z回波信号和点S散射波干扰信号分别为sbz(n)、sbj(n),a天线在第n+1个脉冲时刻接收的目标回波信号和干扰信号分别为saz(n+1)、saj(n+1),则两天线分别在saz(n+1)和n+1时刻接收的信号为
3 实验结果
3.1 对自发性高血压大鼠一般状态的影响 正常对照组大鼠进食、饮水、活动情况均正常,反应灵敏,毛色健康有光泽,精神状态良好,未见任何异样反应;自发性高血压大鼠模型组大鼠逐渐表现出被毛蓬松成簇无光泽,食量减少,体质量下降,精神萎靡且易怒,在给药及血压检测过程中,易出现剧烈抵抗、攻击等行为,易激惹程度大部分由Ⅰ级转变为Ⅱ、Ⅲ级;无患子皂苷单次给药后,各组大鼠行为学一般状态观察与模型对照组无明显差别。连续给药2周治疗后,则精神状态明显好转,情绪相对稳定,进食量明显增多,体质量增长较快。每周称取各组大鼠摄食量及体质量一次,自发性高血压大鼠进食量明显减少、体质量减轻,与正常对照组比较有显著性差异 (P<0.05或P<0.01);无患子皂苷低、高剂量组可显著增加自发性高血压大鼠进食量及体质量,与自发性高血压大鼠对照组比较有显著性差异 (P<0.05或P<0.01);见图1、2。

图1 对自发性高血压大鼠每周进食量的影响

图2 对自发性高血压大鼠体质量的影响
3.2 对自发性高血压大鼠的降压效果
3.2.1 单次给药对自发性高血压大鼠尾动脉收缩压的影响实验结果显示:自发性高血压大鼠尾动脉压明显高于正常对照组,与之比较有高度显著性差异 (P<0.01);无患子皂苷各剂量组单次给药30 min后,即对自发性高血压大鼠有明显的降压作用,在药后各时间点,收缩压有明显降低趋势,与自发性高血压大鼠模型组比较有显著性差异(P<0.05或P<0.01),降压作用可持续到药后240 min,与药前血压比较,在药后30、60、90、120、240 min等时间点亦有显著性差异(P<0.05或P<0.01)。见表1,图3。
表1 无患子皂苷单次用药对自发性高血压大鼠尾动脉收缩压的影响(±s,n=8)

表1 无患子皂苷单次用药对自发性高血压大鼠尾动脉收缩压的影响(±s,n=8)
注:模型对照组与正常对照组比较,**P<0.01;各药物组与模型对照组比较,▲P<0.05,▲▲P<0.01;与给药前比较,#P<0.05,##P<0.01。
30 m i n 60 m i n 90 m i n 120 m i n 240 m i n组 别 剂量/(m g·k g-1)收缩压/m m H g(1 m m H g=0.133322 k P a)药前正常对照组 - 125.21±4.46 126.33±4.37 125.32±4.89 124.75 ±5.71 125.29 ±5.14 125.02 ±4.55模型对照组 / 165.06 ±6.92** 163.33 ±5.73** 163.84 ±6.39** 164.78 ±6.17** 164.42 ±4.94 ** 164.58 ±6.23 **阳性对照组 27 161.11 ±11.03 149.59 ±8.90▲▲#140.68 ±9.50▲▲##139.56 ±6.04▲▲##134.81±8.91▲▲## 135.71 ±12.94▲▲##无患子皂苷低剂量组 27 168.48 ±12.28 160.22±9.76 153.15±12.01▲# 155.16±11.57# 159.17 ±11.88 152.21±11.01▲▲##无患子皂苷高剂量组 108 167.39 ±13.09 151.95±16.67# 157.23±17.97 160.05±16.15 152.21 ±18.37 148.84±14.16▲#

图3 无患子皂苷单次用药对自发性高血压大鼠尾动脉收缩压的影响
3.2.2 连续给药对自发性高血压大鼠尾动脉收缩压的影响实验结果显示:自发性高血压大鼠随着年龄的增长,血压逐渐升高,与正常对照组比较有高度显著性差异 (P<0.01),在实验第7天~第56天,与实验前比较有显著性差异 (P<0.05或P<0.01);无患子皂苷可显著抑制自发性高血压大鼠血压升高的病理进展,连续用药后,在不同时间段收缩压及舒张压均有所降低,无患子皂苷低剂量组降压过程出现一定的波动,但高剂量组则表现出较为平稳的降压效果,与模型组比较及用药前比较均有显著性差异(P<0.05或P<0.01)。见表2,图4。
表2 无患子皂苷连续用药8周对自发性高血压大鼠尾动脉收缩压的影响 (±s,n=8)

表2 无患子皂苷连续用药8周对自发性高血压大鼠尾动脉收缩压的影响 (±s,n=8)
注:模型对照组与正常对照组比较,**P<0.01;各药物组与模型对照组比较,▲P<0.05,▲▲P<0.01;与给药前比较,#P<0.05,##P <0.01。
1 d 4 d 7 d 10 d正常对照组 - 125.21±4.46 126.33±4.37 124.56±5.26 124.4组 别 剂量/(mg·kg-1)收缩压/mmHg(1 mmHg=0.133322 kPa)药前6±5.59 125.49±4.68模型对照组 - 165.06±6.92** 163.33±5.73** 169.60±5.11** 171.68±4.67**# 173.38±8.74**#阳性对照组 27 161.11±11.03 149.59±8.90▲▲# 128.73±11.71▲▲##142.10±5.85▲▲## 130.03±13.33▲▲##无患子皂苷低剂量组 27 168.48±12.28 160.22±9.76 141.47±11.65▲▲##163.40±5.87▲▲# 149.28±12.41▲▲##无患子皂苷高剂量组 108 167.39±13.09 151.95±16.67# 151.22±12.23▲▲# 149.97±7.06▲▲## 138.80±4.83▲▲##组 别 剂量/(mg·kg-1)收缩压/mmHg 13 d 16 d 19 d 22 d 25 d正常对照组 - 124.59±3.31 124.93±4.81 125.64±5.62 124.59±4.85 124.35±3.89模型对照组 - 165.94±4.24** 170.81±11.78** 172.52±7.88**# 162.00±14.67** 170.68±5.67**阳性对照组 27 140.90±11.87▲▲##139.73±6.68▲▲## 139.86±8.35▲▲## 138.41±8.77▲▲## 145.12±5.37▲▲##无患子皂苷低剂量组 27 166.11±9.53 157.17±10.08▲ 146.30±3.39▲▲# 164.91±13.31 155.47±13.70▲无患子皂苷高剂量组 108 153.15±10.81▲▲# 141.22±11.10▲▲##145.98±13.30▲▲##150.75±6.11## 149.83±13.31▲▲#组 别 剂量/(mg·kg-1)收缩压/mmHg 28 d 35 d 42 d 49 d 56 d正常对照组 - 125.79±3.59 125.14±2.06 128.89±4.47 126.74±3.51 125.42±3.38模型对照组 - 172.91 ±5.12**# 179.31 ±5.14**## 181.02 ±5.35**## 185.07 ±6.08**## 187.82 ±5.79**##阳性对照组 27 137.52±7.63▲▲## 133.56±5.92▲▲## 132.68±4.86▲▲## 131.49±4.23▲▲## 129.72±3.02▲▲##无患子皂苷低剂量组 27 157.18±9.78▲▲ 156.18±8.43▲▲** 156.59±7.57▲▲** 157.41±10.33▲▲** 154.60±8.29▲▲**无患子皂苷高剂量组 108 155.39±9.77▲▲ 134.93±3.27▲▲## 136.26±3.56▲▲## 134.16±5.64▲▲## 133.29±3.86▲▲##
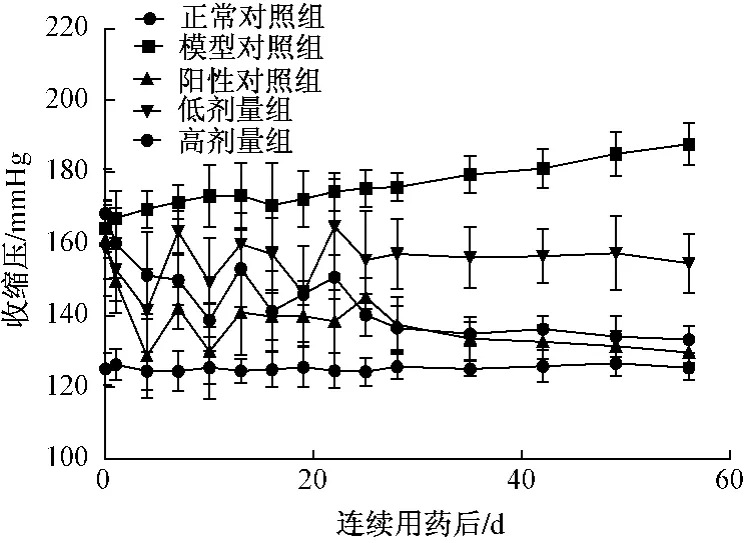
图4 无患子皂苷连续用药8周对自发性高血压大鼠尾动脉收缩压的影响
3.3 对自发性高血压大鼠血清IL-1、IL-6、TNF-α水平的影响 自发性高血压大鼠模型对照组大鼠血清炎症因子IL-1、IL-6、TNF-α水平显著高于正常对照组,与之比较有显著性差异 (P<0.05或P<0.01),连续用药8周后,无患子皂苷可显著降低自发性高血压大鼠炎症因子的血清水平,与模型对照组比较有显著性差异 (P<0.05或P<0.01)。见表3。
3.4 对自发性高血压大鼠腹主动脉内皮细胞内ICAM-1表达的影响 免疫组化法检查结果可见,光镜下观察ICAM-1阳性染色呈棕褐色颗粒状,主要分布在血管内皮细胞细胞浆及间质内。正常对照组大鼠内皮细胞胞浆及间质内仅可见很少量的散在的棕褐色颗粒,呈阴性或者弱阳性表达;自发性高血压大鼠模型组大鼠血管内皮细胞胞浆及间质内分布大量的棕褐色颗粒状物质,表达呈强阳性反应;Sap低剂量组和阳性对照组大鼠血管内皮细胞胞浆及间质内可见一些散在的棕黄色颗粒物质,表达呈阳性反应;Sap高剂量组大鼠血管内皮细胞胞浆及间质内可见少量散在的棕黄色物质,表达呈弱阳性反应。见表4、图5。
表3 对自发性高血压大鼠IL-1、IL-6、TNF-α血清水平影响 (±s)
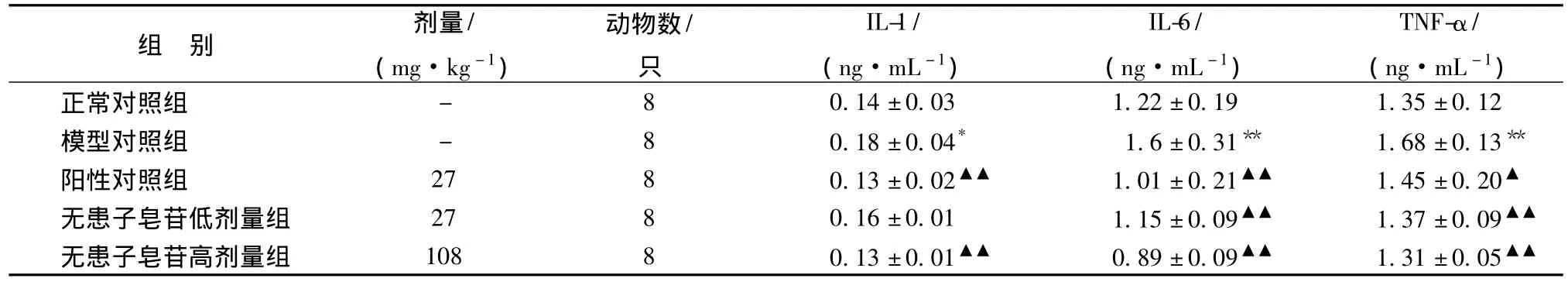
表3 对自发性高血压大鼠IL-1、IL-6、TNF-α血清水平影响 (±s)
注:模型对照组与正常对照组比较,*P<0.05,**P<0.01;各药物组与模型对照组比较,▲P<0.05,▲▲P<0.01。
组 别 剂量/(mg·kg-1)动物数/只IL-1/(ng·mL-1)IL-6/(ng·mL-1)TNF-α/(ng·mL-1)0.14±0.03 1.22±0.19 1.35±0.12模型对照组 - 8 0.18±0.04* 1.6±0.31** 1.68±0.13**阳性对照组 27 8 0.13±0.02▲▲ 1.01±0.21▲▲ 1.45±0.20▲无患子皂苷低剂量组 27 8 0.16±0.01 1.15±0.09▲▲ 1.37±0.09▲▲无患子皂苷高剂量组 108 8 0.13±0.01▲▲ 0.89±0.09▲▲ 1.31±0.05正常对照组 -8▲▲
表4 对自发性高血压大鼠腹主动脉内皮ICAM-1表达的影响 (±s)

表4 对自发性高血压大鼠腹主动脉内皮ICAM-1表达的影响 (±s)
注:模型对照组与正常对照组比较,**P<0.01;各药物组与模型对照组比较,▲▲P<0.01。
吸光度值正常对照组组 别 剂量/(mg·kg-1) 动物数/只 阳性率/%25.375±6.726 0.0500±0.0199模型对照组 - 8 86.000±7.071** 0.1666±0.0348**阳性对照组 27 8 60.875±9.949▲▲ 0.0690±0.0137▲▲无患子皂苷低剂量组 27 8 56.875±9.448▲▲ 0.0821±0.0193▲▲无患子皂苷高剂量组 108 8 30.875±8.509▲▲ 0.0667±0.0216-8▲▲
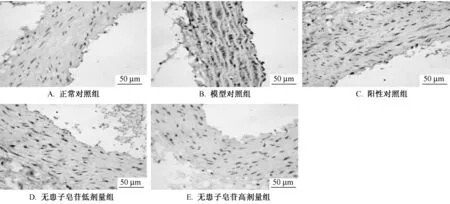
图5 主动脉血管内皮ICAM-1的蛋白表达免疫组化法 (×400)
3.5 对自发性高血压大鼠内皮损伤及血管重构的影响HE染色,镜下观察结果显示:正常对照组大鼠内膜细胞完整,无血栓形成,未见血液及血小板附壁,中膜平滑肌细胞呈纵行规则地排列,未见明显增殖;自发性高血压大鼠模型大鼠内膜细胞损伤明显,可见血液或血小板附壁,血栓形成,有的甚至穿越内皮插入血管壁,中膜平滑肌增殖、肌层增厚明显,且细胞排列紊乱不规则,部分平滑肌细胞核与内膜垂直排列并且有向内膜迁移的趋势;无患子皂苷各剂量组及阳性对照组可不同程度地改善内膜损伤的病理状态,内膜细胞可见轻度损伤,少量血液或血小板附壁,中膜平滑肌增殖不明显,细胞排列轻度紊乱不规则,低、高剂量组改善更为明显。见表6,图6。
表6 对主动脉血管中膜平滑肌增殖情况的影响(±s,n=8)
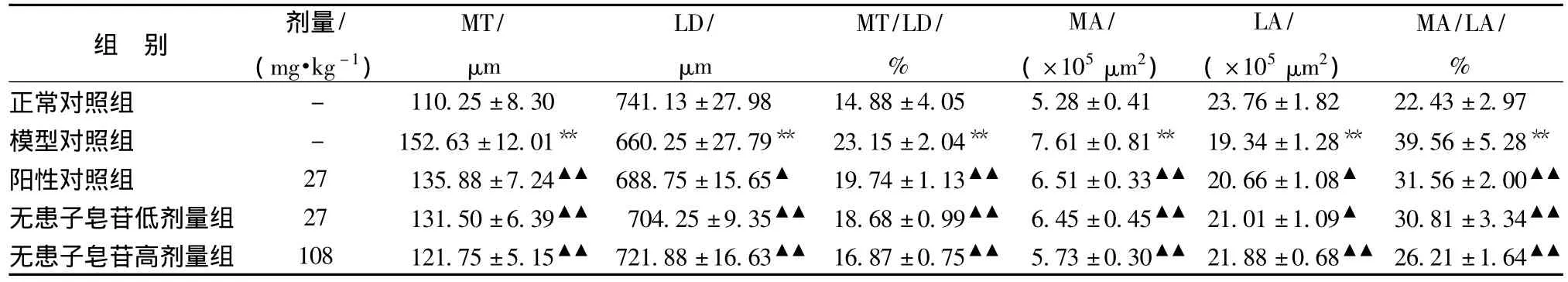
表6 对主动脉血管中膜平滑肌增殖情况的影响(±s,n=8)
注:模型对照组与正常对照组比较,**P<0.01;各药物组与模型对照组比较;▲P<0.05,▲▲P<0.01。
组 别 剂量/(mg·kg -1)MT/μm LD/μm MT/LD/%MA/(×105μm2)LA/(×105μm2)MA/LA/%正常对照组 - 110.25±8.30 741.13±27.98 14.88±4.05 5.28±0.41 23.76±1.82 22.43±2.97模型对照组 - 152.63±12.01** 660.25±27.79** 23.15±2.04** 7.61±0.81** 19.34±1.28** 39.56±5.28**阳性对照组 27 135.88±7.24▲▲ 688.75±15.65▲ 19.74±1.13▲▲ 6.51±0.33▲▲ 20.66±1.08▲ 31.56±2.00▲▲无患子皂苷低剂量组 27 131.50±6.39▲▲ 704.25±9.35▲▲ 18.68±0.99▲▲ 6.45±0.45▲▲ 21.01±1.09▲ 30.81±3.34▲▲无患子皂苷高剂量组 108 121.75±5.15▲▲ 721.88±16.63▲▲ 16.87±0.75▲▲ 5.73±0.30▲▲ 21.88±0.68▲▲ 26.21±1.64▲▲

图6 主动脉血管内皮损伤及中膜平滑肌增殖HE染色 (×200)
Masson染色结果显示:血管中膜平滑肌细胞浆和肌纤维被染成红色,细胞核呈黑蓝色,胶原纤维被染成蓝色。与正常对照组相比,自发性高血压大鼠模型组主动脉血管中膜平滑肌胶原纤维量明显增多,且细胞排列紊乱;无患子皂苷各剂量组及阳性对照组可显著抑制动脉血管平滑肌胶原纤维的异常增殖情况。见图7。

图7 主动脉血管内皮损伤及中膜平滑肌胶原沉积 Masson染色 (×400)
4 讨论
自发性高血压大鼠属于遗传性高血压动物模型。自发性高血压大鼠出生后血压随鼠龄不断升高,幼年自发性高血压大鼠交感活性增高,4周龄时虽然血压正常但已出现心脏质量增加,3~4个月时为高血压确立期,6个月时血压达到最高水平,随后随血压升高进一步出现心血管并发症[3]。因此,目前自发性高血压大鼠模型是应用最为广泛的高血压动物模型,其病理生理机制与人类高血压疾病相似,普遍用于研究高血压疾病病理生理机制及筛选治疗高血压药物。
肿瘤坏死因子 (tumor necrosis factor,TNF)是能够引起肿瘤组织出血坏死、并具有多方面功能的细胞因子。TNF不仅参与免疫调节和炎症反应,而且对心血管系统也产生一定的影响,故其在高血压的病理进程中起到重要的作用[4]。高血压病患者血液循环中TNF浓度[5]以及在体外培养的淋巴细胞TNF诱生水平[6]均显著高于正常人,而水平较高的TNF可通过下列途径影响高血压病的病理进程:TNF通过引起血管内皮细胞的功能障碍及代谢损伤,进而导致血管内皮细胞的凋亡[7];还可促进内皮素 (ET)的表达,而增加的ET即可引起血管的强烈收缩,又可通过促进c-fos和c-myc等原癌基因表达,调控的细胞生长,使得血管内皮细胞增殖,血管壁增厚、管腔变得狭窄[8],从而进一步引起外周阻力增大,血压持续升高。
细胞间黏附分子-1(ICAM-1)属于免疫球蛋白超家族的成员。有研究发现,ICAM-l的异常表达涉及到多种心血管疾病[9]。有报道称机械拉力可使血管内皮细胞的ICAM-l表达增多,从而致使与之连接的粒细胞和单核细胞被激活,因而进一步导致血管病变的发生。ICAM-1表达的增强与内皮的损害、内皮细胞功能的紊乱、高脂血症、肾素-血管紧张素系统的激活、细胞因子的作用、胰岛素抵抗等均有相关性[10]。
有研究表明,某些细胞因子如IL-1、IL-6等可由血管内皮细胞和血管平滑肌细胞分泌,与心血管疾病的发生、发展有一定的联系,其不仅在血管内的炎症反应及免疫应答中起着重要的介导作用,而且能促进血管平滑肌细胞DNA的合成及增殖,进而与原发性高血压的发生有着密切的关系[11]。
因此,在本实验中以自发性高血压大鼠作为研究对象,研究结果显示自发性高血压大鼠血压显著高于正常对照组大鼠,并且随着鼠龄的增长,血压有逐渐升高的趋势,符合人类原发性高血压疾病的特点;自发性高血压大鼠炎症因子IL-1、IL-6、TNF-α的血清水平及血管内皮ICAM-1表达显著高于正常对照组大鼠,进一步研究结果显示自发性高血压大鼠血管内皮损伤、中膜平滑肌显著增厚,导致了动脉血管的重构,因此证实了慢性炎症状态与主动脉内皮损伤及血管重构的相关性。实验受试药物无患子皂苷低(27 mg/kg)、高 (108 mg/kg)剂量组单次及连续给药均可显著降低自发性高血压大鼠血压值,对抗自发性高血压大鼠血压逐渐升高的病理进程,抑制循环血液及血管内皮内炎症因子的表达水平,从而对高血压内皮损伤及血管重构的病理状态有较好的改善作用。
无患子皂苷对自发性高血压大鼠有显著的降压作用,并对主动脉内皮损伤及血管重构具有显著的改善作用,其机制可能与其抑制炎症因子IL-1、IL-6、TNF-α及ICAM-1的表达,改善自发性高血压大鼠血管内皮慢性炎症状态有关。
[1]World Health Organization,Internationl Society of Hypertension Writing Group.2003 World Health Organization(WHO)/International Society of Hypertension(ISH)statement on management of hypertension[J].J Hypertens,2003,21(11):1983-1992.
[2]Badr K,Wainwright C L.Inflammation in the cardiovascular system:here,there and everywhere[J].Curr Opin Pharmacol,2004,4(2):107-109.
[3]徐叔云.药理实验方法学[M].3版.北京:人民卫生出版社,2002:953.
[4]Ferrei N R,Zhao Y J,Takazawa H,et al.Tumor necrosis factor angiotension interaction and regulation of blood press[J].Hypertens,1997,15(12):1481-1485.
[5]于 欣,杨 震,徐方芳,等.高血压肾损害患者TNF-α水平的变化研究[J].新医学,2010,41(12):783-785.
[6]蒋波勇,任晓华.原发性高血压患者外周血单个核细胞炎症因子水平的变化[J].中国卫生检验杂志,2010,20(12):3358-3360.
[7]金惠铭,刘清行,张国平,等.TNF引起的微血管内皮细胞功能障碍及其分子机制[J].中国病理生理杂志,2000,16(10):940-943.
[8]陈昕琳,顾仁樾,章怡祎.丹参多酚酸B对动脉粥样硬化大鼠炎症细胞因子的影响[J].上海中医药大学学报,2011,25(1):63-65.
[9]Kiarash A,Pagano P J,Taveh M,et al.Upregulated expression of rat heart intercellular adhesion molecule-1 in angiolensinⅡbut not phenylephrine-induce hypertension[J].Hypertension,2001,37(1):58-65.
[10]Blacher J,Guerin A P,Pannier B.Impact of aortic stiffness on survival in end stage renal disease[J].Circulation,2005,99(18):2434-2439.
[11]Gojova A,Brun V,Esposito B,et al.Specific abrogation of transforming growth factor-beta signaling in T cells alters atherosclerotic lesionsize and composition in mice[J].Blood,2007,102(12):4052-4058.
