不同年生人参中8种酶活力的比较研究
2012-07-25王思明林艳玲连树林
王思明, 赵 雨, 张 惠, 陈 雨, 林艳玲, 连树林
(1.长春中医药大学中医药与生物工程研发中心,吉林长春130117;2.长春中医药大学附属医院,吉林长春130117)
人参Panax ginseng C.A.Mey.为中国传统中药材,药用历史悠久。人参具有大补元气、复脉固脱、补脾益肺、生津安神的功效[1]。人参生长年限是影响和判断人参品质的重要因素之一。不同年生人参在药理作用上有所差异[2]。酶是具有催化功能的蛋白,在植物生长中起着催化和调节的作用。对不同年生人参中酶活力比较可反映其生理代谢水平。氧化还原酶和水解酶为国际酶学委员会(I.E.C)规定的六大类酶中的两类。氧化还原酶是能催化底物发生氧化还原反应的酶的总称,其中过氧化物酶 (POD)、过氧化氢酶 (CAT)、多酚氧化酶 (PPO)[3]和抗坏血酸过氧化物酶 (APX)是植物有氧呼吸作用三羧酸循环末端氧化系统中的关键酶,与活性氧代谢有关。水解酶是催化底物发生水解反应的酶的总称,淀粉酶 (AMY)、酯酶(EST)、酸性磷酸酯酶 (ACP)和碱性磷酸酯酶(ALP)分别参与植物的糖代谢、脂类代谢和磷代谢等。本实验对不同年生人参中该8种酶进行活力测定,为了解人参品质与生长年限的关系、确定采收期及质量鉴定提供理论依据。
1 实验材料
1.1 材料 实验用人参购于吉林省抚松县,经长春中医药大学中药鉴定教研室姜大成教授鉴定,均为五加科植物Panax ginseng C.A.Mey.,符合中国药典2010年版一部的规定。
1.2 仪器与试剂
1.2.1 仪器 UV—2550紫外分光光度计 (日本岛津公司);AL204型电子天平 (上海梅特勒-托利多仪器有限公司);5804 R冷冻型台式高速离心机(德国艾本德公司);DS2l型高速组织捣碎机 (上海标本模型厂)。
1.2.2 试剂 过氧化氢 (北京化工厂);焦儿茶酚 (天津市光复精细化工研究所);抗坏血酸 (北京鼎国生物技术有限责任公司);愈创木酚 (天津市光复精细化工研究所);3,5-二硝基水杨酸(DNS)(国药集团化学试剂有限公司);酒石酸钾钠 (天津市光复科技发展有限公司);固蓝B盐(长春鼎国生物有限公司);乙酸-α-萘酯 (国药集团化学试剂有限公司);α-萘酚 (国药集团化学试剂有限公司);对硝基苯磷酸二钠 (PNPP)(上海晶纯试剂有限公司)。所用试剂均为分析纯。
2 方法
2.1 样品制备 将样品洗净后以料液比1∶4在已预冷的磷酸二氢钠和磷酸氢二钠缓冲液(pH7.4)中研磨,4℃浸提20 min后过滤,滤液以10000 r/min离心20 min后所得上清液即为粗酶液,于4℃保存备用。
2.2 过氧化物酶 (POD)活力测定[4]取磷酸盐缓冲液150 mL,愈创木酚84 mL,加热溶解,待冷却后加入30%H2O257 μL,混合均匀后37℃预热。取出3 mL混合液加入1 mL酶液,在470 nm处测定POD第0、1、2 min时的吸光度。POD活力以单位时间内 (1 min)每克样品使A470变化0.01为1个酶活力单位。
2.3 过氧化氢酶 (CAT)活力测定[5]取酶液0.2 mL,磷酸缓冲液1.5 mL,蒸馏水1 mL,于37℃水浴预热10 min后加入0.1 mol/L的H2O20.3 mL,在240 nm处测定CAT第0、1、2 min时的吸光度。CAT活力以单位时间内 (1 min)每克样品使A240减少0.1为1个酶活力单位。
2.4 多酚氧化酶 (PPO)活力测定[6]取缓冲液1.5 mL,加入焦儿茶酚溶液1 mL,在37℃水浴锅中预热10 min,再加入0.5 mL酶液,于525 nm处测定PPO第0、30、60 s时的吸光度。PPO活力以单位时间内 (1 min)每克样品使A525变化0.01为1个酶活力单位。
2.5 抗坏血酸过氧化物酶 (APX)活力测定[6]分别取水浴预热10 min后的缓冲液2 mL,1.8 mmol/L AsA 0.5 mL,酶液0.1mL,0.36 mmol/L H2O20.5 mL,在290 nm处测定APX第0、1、2 min时的吸光度。APX活力以单位时间内 (1 min)每克样品反应产生1 μmol AsA为1个酶活力单位。
2.6 淀粉酶 (AMY)活力测定[7]取酶液1 mL,加入1%淀粉溶液l mL于40℃水浴预热5 min,加入DNS 2 mL,在沸水浴中加热5 min,迅速冷却后加蒸馏水定容至20 mL,以第一次水浴前加入DNS试剂作为对照,在540 nm处测定AMY的吸光度。根据麦芽糖标准曲线查出相应吸光度的麦芽糖含有量。AMY活力以单位时间内 (1 min)每克样品催化反应所得1 mg麦芽糖为1个酶活力单位。
2.7 酯酶 (EST)活力测定[8]将0.1moL pH6.5的磷酸缓冲溶液1 mL,酶液1 mL,蒸馏水1 mL混合为 A液。将 1.25 mol/L乙酸-α-萘酯溶液0.1 mL,0.25 mol/L的固蓝B盐溶液0.9 mL混合为B液。将A液与B液分别于40℃恒温水浴下保温10 min,取出后即刻混匀,在524 nm处测定EST第0、1、2、3 min时的吸光度。根据α-萘酚标准曲线查出相应吸光度的α-萘酚含有量。EST活力以单位时间 (1 min)内每克样品与底物反应所得1 μg的α-萘酚为1个酶活力单位。
2.8 酸性磷酸酯酶 (ACP)活力测定[9]取PNPP 0.5 mL,乙酸缓冲液2.3 mL在37℃预热10 min,加入酶液0.2 mL,37℃准确保温10 min,加入NaOH 2 mL终止酶反应,以先加入NaOH后再加酶液作为空白,在405 nm处测吸光度。根据对硝基酚标准曲线查出相应吸光度的对硝基酚含有量。ACP活力以单位时间内 (1 min)每克样品反应产生1 nmol对硝基酚为1个酶活力单位。
2.9 碱性磷酸酯酶 (ALP)活力测定[10]取PNPP 0.5 mL,碳酸缓冲液1.5 mL在37℃预热10 min,加入酶液0.5 mL,37℃准确保温5 min,加入NaOH 1 mL终止酶反应,以先加入NaOH后再加酶液作为空白,在405 nm处测吸光度。根据对硝基酚标准曲线查出相应吸光度的对硝基酚含有量。ALP活力以单位时间内 (1 min)每克样品反应产生1 μmol对硝基酚为1个酶活力单位。
3 结果
实验结果如表1,可看出4年生人参的8种酶活力均低于5、6、7年生人参。
表1 4、5、6、7年生人参8种酶活力值 (±s,n=3)Tab.1 Eight kinds of enzyme activity in 4,5,6,7 years old ginseng(x ±s,n=3)
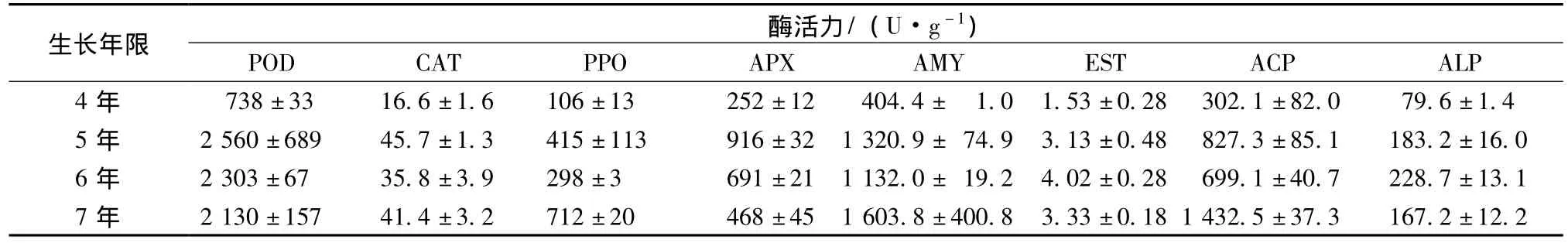
表1 4、5、6、7年生人参8种酶活力值 (±s,n=3)Tab.1 Eight kinds of enzyme activity in 4,5,6,7 years old ginseng(x ±s,n=3)
生长年限酶活力/(U·g-1)POD CAT PPO APX AMY EST ACP ALP 4年 738±33 16.6±1.6 106±13 252±12 404.4± 1.0 1.53±0.28 302.1±82.0 79.6±1.45年 2560±689 45.7±1.3 415±113 916±32 1320.9± 74.9 3.13±0.48 827.3±85.1 183.2±16.06年 2303±67 35.8±3.9 298±3 691±21 1132.0± 19.2 4.02±0.28 699.1±40.7 228.7±13.17年 2130±157 41.4±3.2 712±20 468±45 1603.8±400.8 3.33±0.181432.5±37.3 167.2±12.2
不同年生人参POD、APX活力由大到小为5年﹥6年﹥7年﹥4年 (如图1);PPO、AMY、ACP活力由大到小为7年﹥5年﹥6年﹥4年 (如图3、4);CAT、ALP、EST活力大小顺序各不相同,如图2、5、6。
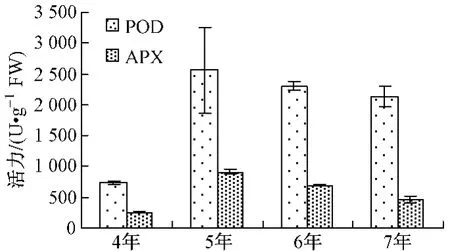
图1 不同年生POD、APX活力Fig.1 POD and APX activity
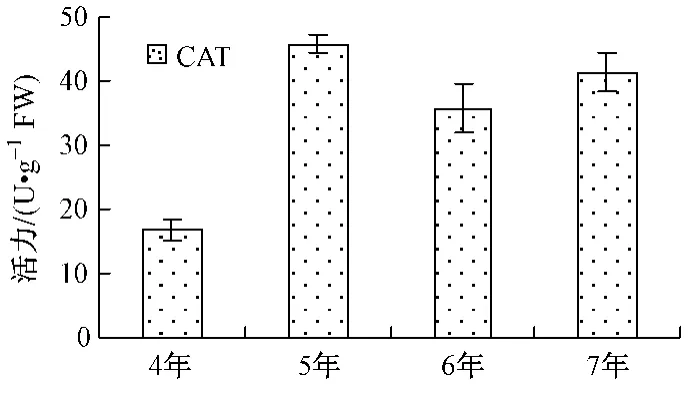
图2 不同年生CAT活力Fig.2 CAT activity
5年生人参以POD、CAT和APX活力最高,分别约是活力最低年生人参的3.47、2.75、3.63倍;6年生人参以ALP、EST活力最高,分别约是活力最低年生人参的2.87、2.63倍;7年生人参以PPO、AMY和ACP活力最高,分别约是活力最低年生人参的6.72、3.97、4.74倍。其中,7年生人参的PPO、ACP活力明显高于其它年生人参。
4 讨论
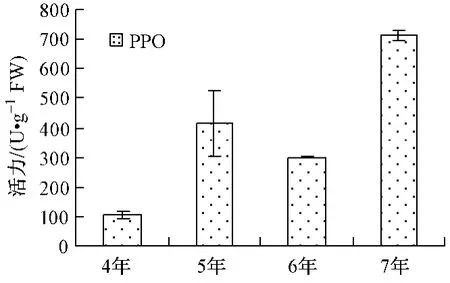
图3 不同年生PPO活力Fig.3 PPO activity
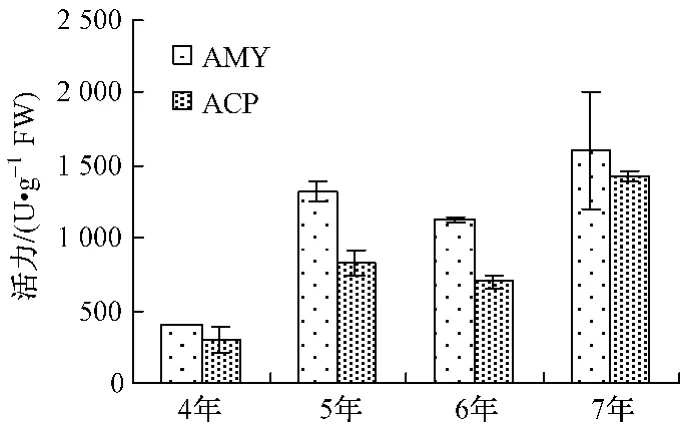
图4 不同年生AMY、ACP活力Fig.4 AMY and ACP activity
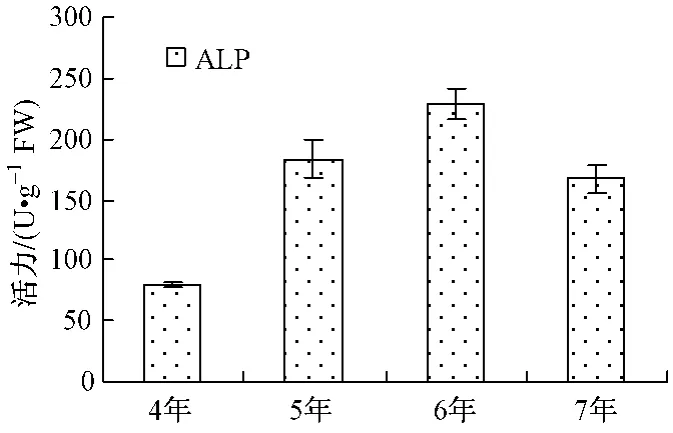
图5 不同年生ALP活力Fig.5 ALP activity
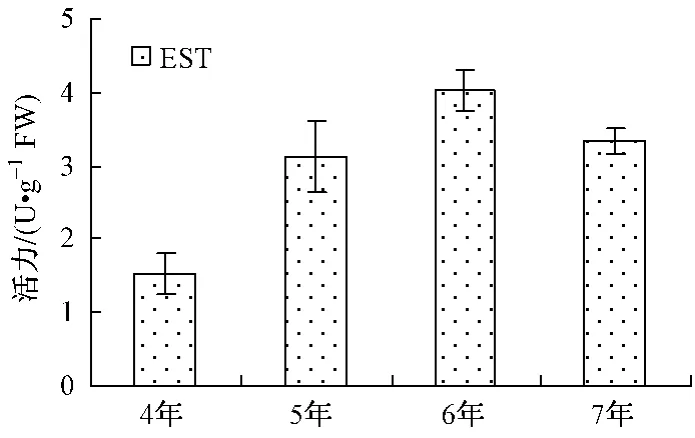
图6 不同年生EST活力Fig.6 E-ST activity
人参为多年生草本植物,通常3年开花,5~6年结果,不同年生的人参其生长发育规律存在差别。Soldati等[11]对生长在日本和朝鲜的1~6年人参100多个样品分析,发现人参皂苷的含有量随生长年限的增长而不断升高,第5年夏末趋于稳定。肖新月[12]等对不同生长年限的人参中8种主要皂苷成分的分析研究表明,随着生长年限增加,2~6年的全须参 (园参)中 Rg、Re、Rb、Rf、Rh、Rc含有量有所增加,可将5年生长期看作是园参有效物质积累到高限的转折点。
本实验从酶学角度观察了人参生长发育的特点,发现4年生人参中8种酶活力均小于5、6、7年生人参,说明4年生人参的总体代谢水平低于5、6、7年生人参,处于形态建成快速生长期,从5年开始,生长规律发生变化,人参中代谢水平趋于稳定,可将5年生长期看作是人参生长的转折点。这与其它研究的观点相符合,也说明人参采收以5、6年生人参为主是有一定科学依据的。
POD、CAT和APX都是植物抗氧化系统的关键酶,参与植物的活性氧代谢,在对维护植物活性氧代谢平衡,保护其免受氧化毒害方面起到重要作用。5年生人参中该3种酶活力高,说明其活性氧代谢水平高,植物呼吸作用强,也说明5年生人参处于同化作用的高峰期。7年生人参中PPO活力较6年生人参活力显著升高,可能与底物浓度变化有关。ACP与ALP是非特异性磷酸水解酶,可作用于多种底物,与植物中磷的代谢密切相关。7年生人参ACP活力的显著升高和ALP活力的显著下降说明磷代谢途径发生变化。EST是催化酯类化合物水解的酶系,可以在水分子的参与下,将脂肪酸酯切割成酸类与醇类,从而为植物合成其它营养物质提供中间产物。6年生人参的EST酶活力高于4、5、7年生人参,说明它的酯类化合物分解代谢快,也就是说明6年生人参的营养储存形式发生了变化。
[1]幺宝金,赵 雨,杨世慧,等.人参总蛋白的提取工艺研究[J].中药材,2009,32(2):293-295.
[2]彭明勇,李 艳.人参不同生长年限的药理作用的比较[J].中外医疗,2008,28:72,78.
[3]彭世清.植物多酚氧化酶的研究进展[J].热带农业科学,2000,85(3):61-65.
[4] 张志安.植物生理学实验指导[M].北京:中国农业科学技术出版社,2004.143-145.
[5]杨兰芳,庞 静,彭小兰,等.紫外分光光度法测定植物过氧化氢酶活性[J].现代农业科技,2009,20:364-366.
[6] 范淑琴,梁淑文.现代植物生理学实验指南[M].北京:科学出版社,1999.316-318.
[7] 郝建军,康宗利,于 洋.植物生理学实验技术[M].北京:化学工业出版社,2007:104-106.
[8]侯明迪.植物酯酶法快速测定有机磷农药残留的研究[J].食品科学,2002,23(7):111-115.
[9] 王 琰.生物化学和临床生物化学检验[M].北京:清华大学出版社,2005:151-153.
[10]俞建英.生物化学实验技术[M].北京:化学工业出版社,2005:255-258.
[11]Soldati F,Tanaka O.Panax ginseng:relation between age of plant and content of ginsenosides[J].J Planta Med,1984,51(4):35l
[12]肖新月,尹继飞,张南平.不同生长年限的人参中8种主要皂苷成分的分析研究[J].药物分析杂志,2004,24(3):238-244.
