胃肠安丸组方中枳壳大黄配伍的化学成分研究
2012-07-25张静泽高文远
王 磊, 张静泽, 高文远*, 刘 振
(1.天津大学药物科学与技术学院,天津300072;2.天津中新药业集团股份有限公司乐仁堂制药厂,天津300380)
中药复方发挥作用的物质基础归根到底是化学成分,其药味配伍后化学成分质与量的变化,使中药材在配伍后表现为各种药理学效应及体内代谢过程的改变。如附子与甘草在配伍后主要成分甘草酸与乌头碱形成水不溶性络合物而减少了附子中毒性成分的溶出[1],同时与甘草单味药材煎煮相比,附子与甘草配伍后甘草中黄酮类成分的提取率提高了约1.5倍[2]。甘草黄酮有效对抗乌头碱所引起的大鼠室性心率失常,且其乌头碱体内代谢过程也由于与甘草的配伍而发生改变。由此可见,中药复方配伍研究从阐述其组成药味性味与功效关系逐渐发展为深入阐明药材配伍前后化学成分、药效及体内代谢过程的变化,对了解中药复方复杂体系真正作用物质基础及发挥治疗效应的机制具有非常重要的意义。
枳壳和大黄均为中医处方中常用中药材,其配伍后化学成分的变化未见相关文献报道。枳壳大黄的配伍也是中药胃肠安丸中的重要组成药味,前期对胃肠安丸甲醇提取物中黄酮类成分柚皮苷[3]以及5种蒽醌类成分[4]进行了定量分析。本实验探讨了胃肠安丸组成中的枳壳与大黄两味药材在配伍后其中主要化学成分组成的变化,并对枳壳中4种黄酮类成分及大黄中5种蒽醌类成分进行定量分析,以期揭示枳壳与大黄配伍后对化学成分的影响,为进一步研究中药复方胃肠安丸作用物质研究奠定基础。
1 仪器与试剂
1.1样品与试剂 胃肠安丸由天津中新药业集团股份有限公司乐仁堂制药厂生产 (批号为WCAWD109002)。
对照品:芦荟大黄素、大黄酸、大黄素、大黄酚、大黄素甲醚、柚皮苷、橙皮苷 (定量测定用,中国药品生物制品检定所提供,批号:110756-200310、0757-200206、110756-200110、1107996-200310、1107580-200409、110722-200610、110721-201014);芸香柚皮苷 (定量测定用,尖峰天然产物有限公司,批号:20091122);新橙皮苷 (定量测定用,天津一方科技有限公司,批号:10081102)。
乙腈、甲醇为色谱纯,冰醋酸、三氯甲烷为分析纯 (天津康科德医药化工有限公司)。
枳壳、大黄药材由天津乐仁堂药厂提供,经天津大学药物科学与技术学院高文远教授鉴定为枳壳正品Aurantii Fructus,大黄正品Rhei Radix et Rhizoma。
1.2 仪器 高效液相色谱仪 (Waters2414型高效液相色谱仪;Waters2998紫外-可见检测器);微量分析天平 (CP225D,Sartourius Co.);Kromasil色谱柱 (250 mm×4.6 mm,5 μm);微量进样器(25 μL,Hamilton)
2 方法与结果
2.1 色谱条件
2.1.1 指纹图谱分析条件 流动相为A乙腈-B1%醋酸水,梯度洗脱条件见表1;柱温35℃;体积流量1 mL/min;检测波长254 nm。
2.1.2 枳壳中黄酮苷测定条件 流动相为乙腈-0.5%醋酸水溶液(20∶80)等度洗脱;柱温35℃;体积流量1 mL/min;检测波长280 nm。各对照品对应色谱峰理论塔板数不小于4000。

表1 流动相梯度洗脱程序Tab.1 Gradient elution process of mobile phase
2.1.3 大黄中蒽醌测定条件 流动相为A甲醇-B0.5%醋酸水溶液,梯度洗脱,0~20 min,A为65%~85%;柱温35℃;体积流量1 mL/min;检测波长254 nm。各对照品对应色谱峰理论塔板数不小于4000。
2.2 对照品溶液配制
2.2.1 黄酮混合对照品溶液配制 分别精密称取芸香柚皮苷、柚皮苷、橙皮苷、新橙皮苷对照品适量,置于25 mL量瓶中,加甲醇溶解并稀释至刻度,摇匀得芸香柚皮苷 103 μg/mL、柚皮苷657 μg/mL、橙 皮 苷 68 μg/mL、新橙皮苷 406 μg/mL的对照品溶液,分别吸取各对照品溶液0.2、1、2、3、4 mL混合均匀,甲醇定容至10 mL,作为混合对照品贮备液,备用。
2.2.2 蒽醌混合对照品溶液配制 分别精密称取芦荟大黄素、大黄酸、大黄素、大黄酚、大黄素甲醚对照品适量,置于25 mL量瓶中,加甲醇溶解并稀释至刻度,摇匀得到芦荟大黄素64 μg/mL、大黄酸 94 μg/mL、大 黄 素 104 μg/mL、大 黄 酚141 μg/mL、大黄素甲醚33 μg/mL的对照品溶液,分别吸取各对照品溶液0.1、0.25、0.5、1、2 mL混合均匀,甲醇定容至10 mL,作为混合对照品贮备液,备用。
2.3 供试品溶液的制备
2.3.1 胃肠安丸供试品溶液的制备 精密称定胃肠安丸粉末约1.0 g,置100 mL具塞三角瓶中,加甲醇50 mL,称定质量,加热回流1 h,放冷,再称定质量,用甲醇补足失质量,滤过后备用。
2.3.2 枳壳供试品溶液的制备 精密称定枳壳药材粉末0.2 g,按照2.3.1项下制备方法制得枳壳供试品溶液,精密吸取本供试品溶液5 mL加甲醇定容于10 mL量瓶中,作为测定用供试品溶液。
2.3.3 大黄供试品溶液的制备 精密称定适量大黄药材粉末0.1 g,按照2.3.1项下制备方法制得大黄供试品溶液。精密吸取本供试品溶液5 mL加甲醇定容于10 mL量瓶中,作为测定用供试品溶液。
2.3.4 枳壳大黄供试品溶液的制备 按照胃肠安丸中枳壳大黄药材配伍比例,精密称定枳壳大黄药材 (2∶1)粉末,按照2.3.1项下制备方法制得枳壳大黄供试品溶液。
2.4 样品HPLC指纹图谱比较分析
按照2.1.1项下指纹图谱测定条件对胃肠安丸、枳壳、大黄、枳壳-大黄配伍及缺大黄、枳壳阴性组方甲醇提取物供试品进行HPLC分析,实验结果见图1。图1中所示在本实验分析条件下胃肠安丸甲醇提取物中的50余个色谱峰得到了较好的分离,通过与枳壳、大黄药材以及缺药材阴性提取物色谱图比较发现,胃肠安丸甲醇提取物中的主要成分来自枳壳和大黄。枳壳与大黄配伍后HPLC色谱图结果显示,配伍前后化学成分仅为单味药材化学成分叠加并无新成分生成,所含主要成分在量上存在一定差异,因此对枳壳和大黄中的两类主要成分黄酮类及蒽醌类成分进行定量分析。

图1 胃肠安丸、枳壳大黄及其配伍甲醇提取物HPLC指纹图谱Fig.1 Typical HPLC-UV chromatograms of weichang'an Pills,Aurantii Fructus,Rhei Radix et Rhizoma,and the compatibility of them
2.5 主要成分测定方法学考察
2.5.1 线性关系考察 分别按照2.1.2项和2.1.3项下黄酮苷和蒽醌类成分色谱分析条件,精密吸取混合对照品溶液配制成一系列不同浓度的混合对照品溶液,按上述色谱条件测定,液相色谱图如图2、3所示,分别记录峰面积。以枳壳中4种黄酮苷及大黄中5种蒽醌对照品质量浓度 (X)为横坐标,相应峰面积积分值 (Y)为纵坐标分别进行线性回归,所得线性回归方程及相关参数如表2所示,本实验测定条件下各成分在线性范围内对照品浓度与峰面积呈良好线性关系。
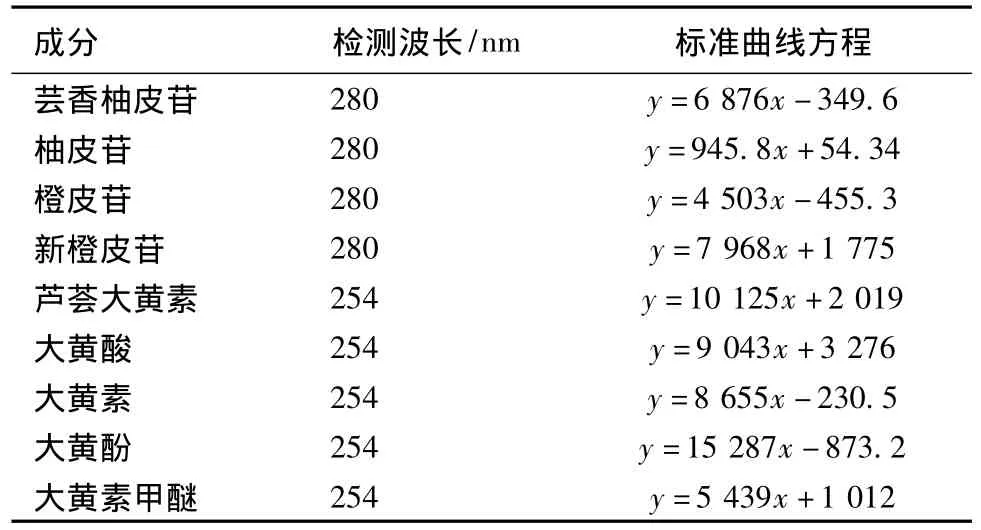
表2 9种对照品标准曲线方程及相关参数Tab.2 Calibration data of nine reference substances
2.5.2 精密度试验 按2.1.2项及2.1.3项下色谱条件,黄酮及混合蒽醌类成分对照品溶液分别连续进样6次,每次20 μL,考察精密度,记录混合对照品各组分峰面积值,分别计算芸香柚皮苷、柚皮苷、橙皮苷、新橙皮苷、芦荟大黄素、大黄酸、大黄素、大黄酚、大黄素甲醚的RSD值。
2.5.3 重复性试验 按照供试品溶液制备方法配制溶液,分别精密称取5份枳壳与大黄配伍药材,制备枳壳大黄配伍提取物,按2.1.2项和2.1.3项下色谱条件,依法测定考察方法重复性,记录混合对照品各组分峰面积值,计算RSD值。
2.5.4 稳定性试验 同一份供试品溶液避光室温放置,在0、2、4、8、12、24 h分别进样20 μL考察稳定性按照2.1.2和2.1.3项下色谱条件,依法测定考察测定成分在实验分析条件下的稳定性,记录供试品中各测定成分峰面积,计算RSD值。
2.5.5 加样回收率试验 精密称取已知含有量枳壳大黄配伍样品,共6份,分别置上述具塞三角瓶中,按照供试品溶液配制方法进行制备后,精密吸取供试品溶液5 mL分别加入1 mL黄酮苷对照品溶液(加入量分别为芸香柚皮苷103 μg;柚皮苷657 μg;橙皮苷68 μg;新橙皮苷406 μg)以及蒽醌对照品溶液0.2 mL(加入量分别为芦荟大黄素32 μg;大黄酸19 μg;大黄素52 μg;大黄酚70 μg;大黄素甲醚16 μg)后加甲醇定容至10 mL量瓶中。按照

图2 枳壳大黄配伍前后黄酮类成分测定HPLC色谱图Fig.2 Typical HPLC-UV chromatograms of compatibility of Aurantii Fructus and Rhei Radix et Rhizoma

图3 枳壳大黄配伍前后蒽醌类成分测定HPLC色谱图Fig.3 Typical HPLC-UV chromatograms of compatibility of Aurantii Fructus and Rhei Radix et Rhizoma
2.1.2项和2.1.3项下色谱条件,依法测定,记录峰面积,计算回收率。
以上方法学考察实验结果见表3。结果表明该分析条件下仪器精密度,方法重复性及回收率良好,且供试样品溶液在24 h内室温放置稳定性良好,采用该方法测定结果准确可靠。
2.6 样品测定 取枳壳大黄粉末按2.3项下供试品溶液制备方法分别制成枳壳、大黄、枳壳大黄供试品溶液,每组制备三份。精密吸取供试品溶液20 μL,注入高效液相色谱仪,进行测定,按照标准曲线分别计算,结果见表4。

表3 测定方法精密度、重复性及稳定性试验结果Tab.3 Precisions,reproducibility and stability of references and samples
3 讨论
前期研究表明胃肠安丸甲醇提取物对肠运动具有双向调节作用,主要表现在其能够促进正常小鼠小肠推进率,而预先采用新斯的明致泻小鼠,胃肠安对肠运动的异常亢进具有明显的抑制作用[5]。利用HPLC分析了胃肠安丸甲醇提取物中主要成分,结果显示主要成分中以药材枳壳、大黄中的成分所占比例较大。枳壳中主要含有黄酮及其苷类、香豆素、生物碱及挥发油类等成分[6-7],其中以黄酮及其苷类为主要成分;大黄中则主要以蒽醌类成分为主,尚含有鞣质、二苯乙烯苷类化合物[8]。枳壳大黄配伍后化学成分种类繁多,实验结果表明,在乙腈-0.5%梯度洗脱条件下,多数成分达到基线分离,达到良好的分离效果。枳壳中黄酮苷类成分的紫外吸收最大值在283 nm,蒽醌类成分在250 nm左右,因此实验中选定两个波长进行检测,在280 nm条件下对枳壳中黄酮类进行测定,在254 nm条件下测定蒽醌类成分含量,各成分吸收响应好,杂质干扰较少。本实验对胃肠安丸中黄酮苷和蒽醌类成分进行了初步的研究,虽为揭示胃肠安丸中该两类化学成分提供了一定信息,但胃肠安中其它药味等配伍对其化学成分的变化与否还有待进一步深入研究。

表4 主要成分测定结果Tab.4 Contents of references in the samples.
枳壳水煎剂及辛弗林对肠平滑肌收缩起明显抑制作用[9],而大黄中蒽醌类化合物是具有泻下作用的成分[10,11]。枳壳与大黄配伍后枳壳中的4种黄酮类成分含有量均有不同程度的增加。董玄等[12]利用HPLC方法测定了不同产地枳壳中柚皮苷、橙皮苷、新橙皮苷,本研究中增加了枳壳中芸香柚皮苷定量测定,比较了枳壳中4种黄酮苷类成分在配伍前后的变化,同时,比较了大黄中蒽醌类成分配伍前后的改变情况,从游离蒽醌含有量变化可见,枳壳与大黄配伍后游离型大黄酸含有量增加最为显著,增加了5.17倍,同时游离型大黄酚及大黄素甲醚的含有量分别增加了2.39、2.13倍。而结合型蒽醌含有量变化并不明显,蒽醌类化合物总量由2.39%增加到3.3%。
[1]杨 明,刘小彬,黄庆德.附子甘草配伍减毒增效机理探析[J].时珍国医国药,2003,4(4):197-198.
[2]张爱华,彭国平,文红梅,等.甘草与附子配伍煎液的甘草黄酮含量测定[J].中成药,1999,21(4):196-198.
[3]凌宁生,杨 瑾,律兆荣,等.HPLC法测定胃肠安丸中柚皮苷[J].中草药,2005,36(12):1815-1816.
[4]张静泽,高文远,王 磊,等.中药胃肠安丸中5种蒽醌类成分的定量分析[J].中成药,2010,32(10):1716-1720.
[5]Hu J,Gao W Y,Ling N S,et al.Antidiarrhoeal and intestinal modulatory activities of Wei-Chang-An-Wan extract[J].J Ethnopharmacol,2009,125:450-455.
[6]Zhou D Y,Qing X,Xue X Y,et al.Identification of O-diglycosyl flavanones in Fructus aurantii by liquid chromatography with electrospray ionization and collision-induced dissociation mass spectrometry[J].J Pharmaceut Biomed,2006,42:441-448.
[7]Zhou D Y,Qing X,Xue X Y,et al.Rapid qualitative and quantitative analyses of flavanone aglycones in Fructus aurantii by HPLC ion-trap MS[J].J Sep Sci,2007,30:858-867.
[8]Ye M,Han J,Chen H B,et al.Analysis of phenolic compounds in rhubarbs using liquid chromatography coupled with electrospray ionization mass spectrometry[J].J Am Soc Mass Spectrom,2007,18:82-91.
[9]官福兰,王汝俊,王建华.枳壳及辛弗林对兔离体小肠运动的影响[J].中药药理与临床,2002,18(2):9-11.
[10]Leng Peschlow E.Acceleration of large intestine transit in rats by sennosides and related compounds [J].J Pharm Pharmcol,1986,38(5):369-373.
[11]Sasaki K,Yamuchi K,Kuwano S.Metaboli activation of sennoside a in mice[J].Planta Med,1979,37(2):370-378.
[12]董 玄,高文远,李凤阁,等.RP-HPLC法测定枳壳药材中柚皮苷、橙皮苷、新橙皮苷[J].中草药,2009,40(增刊):283-284.
