野山参中7种人参皂苷的测定
2012-07-25蔡国琴张英华邓捷圆
张 静, 张 聪*, 胡 馨, 蔡国琴, 张英华, 邓捷圆
(1.上海中医药大学,上海201203;2.上海市中药研究所,上海201204)
野山参Panax ginseng C.A.Mey.为五加科人参属植物,具有大补元气、益肺、生津、安神等功效[1]。野山参是我国的传统名贵药材,其药用历史源远流长。现代药物学研究已证明人参皂苷(ginsenosides)是其主要活性成分,因此含人参皂苷量的多少是评价人参内在质量的重要指标[2]。本研究采用高效液相色谱法对野山参中的7种主要人参皂苷成分进行了测定,有利于更全面、有效地控制野山参药材的质量。
1 仪器和试药
1.1 仪器 Agilent 1200系列高效液相色谱仪 (美国安捷伦公司),包括 G1322A真空脱气机、G1311A四元泵、G1329A自动进样器、G1316A柱温箱和G1314B DAD检测器;超声波清洗器 (JIE 360型,上海杰理科技有限公司)。
1.2 药品和试剂 人参皂苷对照品Rg1、Re、Rf、Rb1、Rc、Rb2、Rd购自中国药品生物制品检定所。野山参样品由上海雷允上神象分公司提供,由副主任中药师李跃雄、吴咏梅鉴定,为五加科Araliaceae植物Panax ginseng C.A.Meyer的干燥根茎,并为野生者。乙腈和甲醇为色谱纯 (Fisher,USA),正丁醇为分析纯,水为Millipore纯水。
2 方法和结果
2.1 溶液的配制
2.1.1 对照品溶液的制备 精密称取人参皂苷对照品 Rg1、Re、Rf、Rb1、Rc、Rb2、Rd,分别为 1.22、1.62、0.43、 2.50、0.93、 1.01、 0.52 mg/mL, 置5mL量瓶中,加甲醇溶解并定容至刻度,摇匀,即得质量浓度分别为 0.244、0.324、0.086、0.500、0.186、0.202、0.104 mg/mL的混合对照品溶液,置于4℃冰箱保存。
2.1.2 野山参药材样品溶液的制备 精密称取野山参药材粉末 (过三号筛)约1.0 g,置索氏提取器中,加70 mL三氯甲烷水浴回流3 h,弃去三氯甲烷液,药渣挥干溶剂,连同滤纸移入100 mL锥形瓶中,精密加入水饱和正丁醇60 mL,密塞,放置过夜,超声处理15 min,滤过,弃去初滤液,精密量取滤液30 mL,置蒸发皿中蒸干,残渣加甲醇溶解并转移至5 mL量瓶中,加甲醇稀释至刻度,摇匀,滤过,取续滤液,即得。
2.2 色谱条件
2.2.1 色谱条件Ⅰ 用于测定人参皂苷Rg1、Re。流动相为乙腈-水 (21∶79),等度洗脱;柱温30℃;检测波长203 nm;体积流量1 mL/min,进样量10 μL。色谱图见图1。
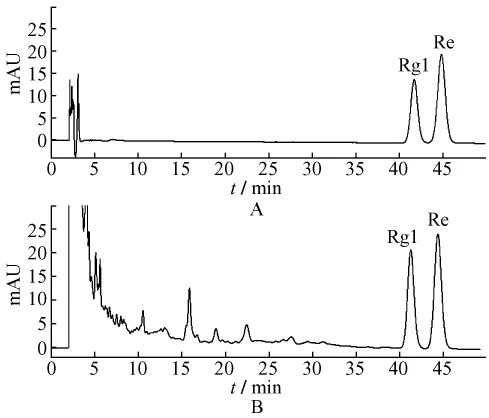
图1 色谱条件Ⅰ下对照品 (A)与样品 (B)图谱Fig.1 References(A)and sample(B)spectrum of test methodⅠ
2.2.2 色谱条件Ⅱ 用于测定人参皂苷Rf、Rb1、Rc、Rb2、Rd。流动相A为乙腈,流动相B为水梯度洗脱,0~25 min(28%A),25~35 min(28% ~30%A),35~45 min(30% ~32%A),45~60 min(45% ~60%A);Eclipse Plus C18色谱柱 (4.6 mm×250 mm,5 μm);柱温30℃;检测波长203 nm;体积流量1 mL/min,进样量10 μL,见图2。
3 方法学考察
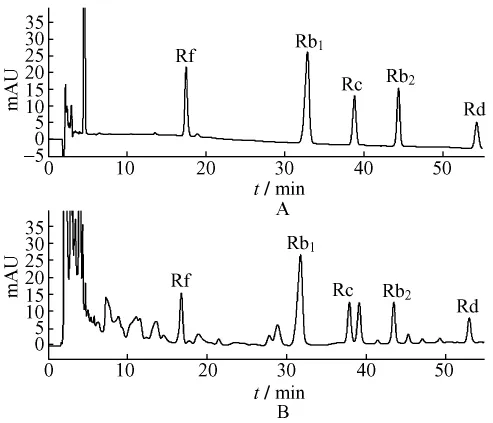
图2 色谱条件Ⅱ下对照品 (A)与样品 (B)图谱Fig.2 References(A)and sample(B)spectrum of test methodⅡ
3.1 线性关系考察 分别取混合对照品溶液1、2、4、8、12 μL进样,按色谱条件Ⅰ测定;分别取混合对照品溶液1、2、4、8、12 μL进样,按色谱条件Ⅱ测定,以进样量 (μL)为横坐标,含药量 (μg)为纵坐标,绘制工作曲线。结果 Rg1、Re、Rf、Rb1、Rc、Rb2、Rd的回归方程分别为 :Y=273.79X-6.8464,r=0.9999;Y=241.81X+33.911,r=0.9999;Y=287.97X+0.1368,r=0.9999;Y=204X+6.0269,r=0.9999;Y=202.65X-1.1632,r=0.9999;Y=194.52X-1.5755,r=0.9999;Y=246.03X+0.5252,r=0.9999。线性范围分别为1.50~18.02 μg,2.02~ 24.24 μg,0.25 ~ 3.05 μg,1.34 ~ 16.08 μg,0.70 ~8.42 μg,0.71 ~8.50 μg,0.30 ~3.57 μg。
3.2 精密度试验 取8号样品溶液,按色谱条件Ⅰ测定,重复进样5次测定,结果人参皂苷Rg1、Re色谱峰面积的RSD值均小于2%;按色谱条件Ⅱ测定,重复进样5次测定,结果人参皂苷Rf、Rb1、Rc、Rb2、Rd色谱峰面积的RSD值均小于3%。
3.3 重复性试验 取8号样品,平行制备5份样品溶液,按色谱条件Ⅰ测定,结果人参皂苷Rg1、Re的RSD值均小于3%;按色谱条件Ⅱ测定人参皂苷 Rf、Rb1、Rc、Rb2、Rd 的 RSD 值均小于3%。
3.4 稳定性试验 取8号样品同一溶液,按色谱条件Ⅰ和Ⅱ分别于0、2、4、8、10、12 h测定色谱峰面积,结果人参皂苷Rg1、Re、Rf、Rb1、Rc、Rb2、Rd色谱峰面积的RSD均小于3%。
3.5 加样回收率试验 精密称取已知含有量的同一批次野山参样品1 g共9份,每3份为1组,分别按样品中各人参皂苷 Rg1、Re、Rf、Rb1、Rc、Rb2、Rd含有量的80%、100%、120%精密加入对照品溶液,按2.1.2项下制备,分别按色谱条件Ⅰ和Ⅱ进样分析,记录色谱峰,各人参皂苷回收率的结果为97.06%、98.37%、98.71%、98.88%、100.43%、98.80%,RSD分别为 0.51%、1.88%、2.13%、0.98%、1.43%、0.61%、1.73%。
4 样品测定
按2.1.2项下方法制备18批野山参药材样品溶液,按2.2项下色谱条件进样分析,结果见表1。
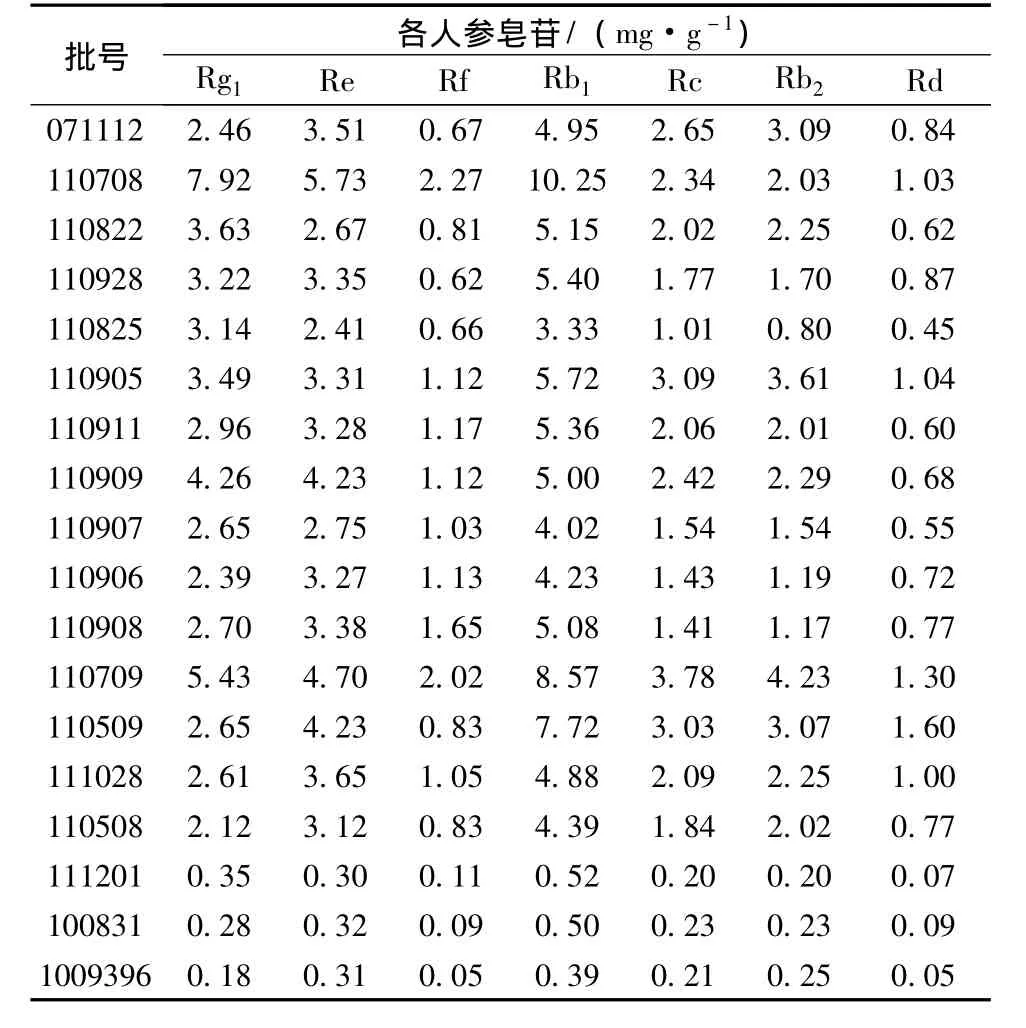
表1 18批野山参样品中7种人参皂苷的测定结果 (n=2)Tab.1 Determination results of ginsenosides in wild ginseng(n=2)
5 讨论
5.1 超声提取部分的正交试验 对于超声提取,本实验选择L9(34)表,考察了3个因素,每个因素3个水平;溶剂种类考察了甲醇、70%乙醇、水饱和正丁醇;溶剂体积考察了50、60、70 mL;超声时间考察了15、30、45 min。结果表明水饱和正丁醇的提取效率最高,体积以60 mL最佳,而超声时间的影响不大,所以采用以1 g样品中加入水饱和正丁醇60 mL提取15 min作为最佳前处理条件。正交试验结果见表2。
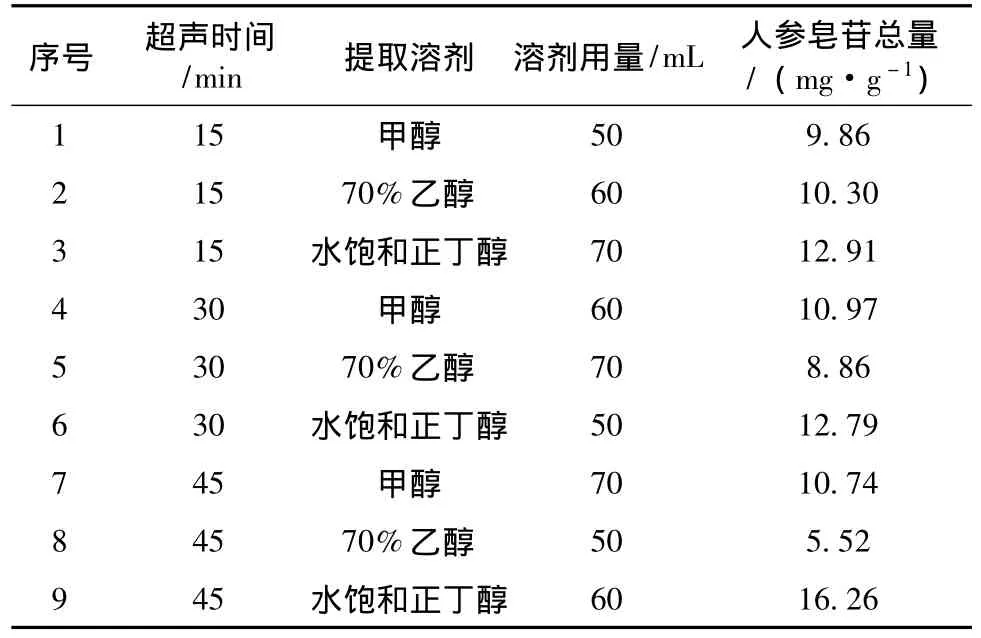
表2 正交试验结果Tab.2 Results of orthogonal experiment
5.2 提取方法的选择 参考2010年版《中国药典》,考察了正丁醇超声之前采用三氯甲烷回流除杂,结果发现除杂后得到的总皂苷含有量18.26 mg/g,低于直接用正丁醇超声得到的18.33 mg/g,但考虑到脂溶性成分对人参皂苷分离的影响,最终选择了三氯甲烷回流法[3-4]。另外还考察了C18小柱对提取的影响,发现效果不明显,所以未采用C18小柱对样品进行除杂。
5.3 液相条件的选择
5.3.1 色谱柱的选择 考察了Eclispe Plus C18柱(4.6 mm × 250 mm,5 μm)、Eclispe XDB C18柱(4.6 mm × 150 mm,5 μm)和 Zorbax C18柱(4.6 mm×250 mm,5 μm)3种不同规格的柱子,结果发现,虽然短柱可以缩短分析时间,但不能获得良好的分离度,所以选择 Eclispe Plus C18柱(4.6 mm ×250 mm,5 μm)。
5.3.2 流动相的选择 比较了甲醇-水、乙腈-水和90%乙腈-水系统,乙腈-水的分离效果最好[5-7]。由于人参皂苷类成分的最佳紫外吸收波长为203 nm,接近末端吸收,在流动相中加入甲酸或乙酸等含羰基的有机酸会明显造成基线波动,而加入磷酸对整体分离情况没有明显影响,最终选择乙腈和纯水作为最佳流动相[8]。
5.3.3 流动相比例的选择 选择合适的流动相比例是分离的关键,由于很难使多种人参皂苷在同一流动相系统中达到良好的分离[9],同时,Rg1、Re极性非常相似,曾有多篇单独分离这两种成分的报道[10-12],因此本实验单独将这2种人参皂苷采用一种流动相比例,其他5种人参皂苷采用梯度洗脱方法,使其均达到良好的分离度。
本实验对18个批次的野山参药材中7种皂苷成分进行了测定,方法学考察表明,重复性、稳定性、精密度和加样回收率的范围均符合相关标准。结果表明,在本研究介绍的供试品制备方法和色谱条件下,人参皂苷 Rg1、Re、Rf、Rb1、Rc、Rb2、Rd分离良好,所建立的方法稳定可靠,可以用来对野山参进行质量控制。
[1]国家药典委员会.中华人民共和国药典:2010年版一部[S].北京:中国医药科技出版社,2010:8.
[2]Jin Chaodong.Review of the analysis methods of chemical constituents in Radix Ginseng[J].Chin Tradit Herb Drugs,1996,27(10):631.
[3]张崇禧,鲍建才,李向高,等.HPLC法测定人参、西洋参和三七不同部位中人参皂苷的含量[J].药物分析杂志,2005,25(10):1190-1194.
[4]杨先启,卓开华,陈 军,等.HPLC法测定RRLC法分离分析人参中的人参皂苷Rg1、人参皂苷Re和人参皂苷Rb1[J].药物分析杂志,2008,28(7):1144-1146.
[5]肖新月,尹继飞,张南平,等.不同生长年限的人参中8种主要皂苷成分的分析研究[J].药物分析杂志,2004,24(3):238-244.
[6]李 闯,王 义,张美萍,等.人参不同部位皂苷成分的HPLC测定[J].杏林中医药,2010,30(4):347-349.
[7]曹俊岭,李祖伦,付 强,等.人参中8种皂苷的HPLC测定[J].中药材,2006,29(10):1038-1040.
[8]赵 亮,吕 磊,纪松岗,等.高效液相色谱法快速测定人参中8种主要皂苷类成分的含量[J].第二军医大学学报,2008,12(29):1507-1510.
[9]Hu Ping,Luo Guoan,Wang Qing,et al.The retention behavior of ginsenosides in HPLC and its application to quality assessment of Radix Ginseng[J].Arch Pharm Res,2008,10:1265-1273.
[10]王 旭,邬国庆,张小茜.HPLC法测定进口西洋参中人参皂苷 Rbl、Re、Rgl的含量[J].中国实验方剂学杂志,2004,10(6):27-29.
[11]欧阳庆.HPLC法测定参雄温阳胶囊中人参皂苷Rg1、Re的含量[J].中国药师,2010,13(2):215-217.
[12]张雪光,俄丽丹,孙 巍,等.高效液相色谱法测定人参片中人参皂苷Rg1和人参皂苷Re的含量[J].药品检测,2003,12(10):42-43.
