槲皮素对糖尿病大鼠肾脏组织的保护作用及其调控机制的研究
2012-07-25周方敏黄振步
周方敏 来 芳 黄振步
糖尿病肾病(DN)是指糖尿病微血管病变导致的肾小球硬化,又称糖尿病肾小球硬化症,是糖尿病最常见的并发症,也是引起终末期肾病(ESRD)的主要原因之一。研究表明,周期素激酶抑制剂P27增多在DN肾功能损害中起重要作用[1]。槲皮素作为具有多种生物活性的黄酮类化合物,对糖尿病和慢性肾衰竭大鼠肾功能具有保护作用,可减少糖尿病大鼠的蛋白尿[2-3],但机制不甚明确。为了进一步探求槲皮素对DN的保护作用机制及进一步明确P27在肾小管上皮细胞表达的意义,本研究拟对槲皮素对DN肾小管上皮细胞表达P27的影响进行体外研究。报道如下:
1 材料与方法
1.1 药物与试剂 链脲佐菌素和槲皮素均为美国Sigma公司产品;盐酸贝那普利为北京诺华有限公司产品(批号:X1036);大鼠抗P27多克隆抗体(产品编号:BA0273)、DAB显色试剂盒均购自武汉博士德生物工程有限公司;即用型免疫组化Elivision TM plus试剂盒(产品编号:KIT-9901)、EDTA抗原修复液(产品编号:MVS-0098)均购自福州迈新生物技术开发有限公司。
1.2 实验动物 健康SD大鼠,雄性,清洁级,体重180~200g,50只,购于上海西普尔-必凯实验动物有限公司,由温州医学院实验动物中心提供。实验期间,动物房室温控制在25~28℃,湿度45%,明暗周期12h/12h。
1.3 实验动物模型制备及分组 参考Yokozawa等[4]报道的方法制备模型:用0.3%戊巴比妥钠溶液以1ml/100g腹腔注射麻醉,常规备皮消毒,从距左脊肋骨1.5cm处作斜向外方切口背部切口,长约2cm,逐层剪开皮肤、肌肉、筋膜,暴露左肾,剥离肾包膜,止血钳夹住肾动脉、输尿管并结扎,剪下左肾,分层缝合腹膜、肌肉、皮肤,并在伤口处滴0.01ml庆大霉素,以预防术后伤口感染。2周后,按55mg/kg单次腹腔注射链脲佐菌素。72h后尾尖取血,测空腹血糖,将血糖≥16.7mmol/L、尿量大于对照组的50%作为糖尿病肾病动物模型建立标准,成功制备40只模型大鼠。分组:①假手术组(SO组,n=10),SO组只暴露左侧肾脏后再放回腹腔,关闭腹腔,分层缝合;②模型组(M组,n=10);③槲皮素组(Q组,n=10):槲皮素100mg/(kg·d)灌胃;④盐酸贝那普利组(B组,n=10):盐酸贝那普利20mg/(kg·d)灌胃。假手术组和模型组灌服等量生理盐水,连续给药共8周。
1.4 观察指标及方法
1.4.1 体重、肾重及肾重/体重比 每周称量体重,观察并记录,取材时称肾重,并计算肾脏肥大指数[KHI=右侧肾重(g)/体重(g)]。
1.4.2 尿微量白蛋白和β2-微球蛋白 代谢笼中收集24h尿液标本,采用ELISA法检测尿微量白蛋白和β2-微球蛋白。
1.4.3 生化指标检测 采用全自动生化分析仪检测血清尿素氮、肌酐水平。
1.4.4 肾脏组织形态学检查 取同一肾组织,常规固定,石蜡切片,HE染色,在普通光镜下观察肾脏组织形态学改变情况。
1.4.5 免疫组织化学法检测P27的表达 取同一肾组织,采用Elivison二步法,按试剂盒说明书要求操作。结果判断:免疫组织化学方法染色后,将所制切片在光学显微镜下观察,细胞核/胞浆呈现明确的黄色或棕黄色染色为阳性表达,细胞核蓝染的为苏木素复染的阴性细胞。在200倍镜下,用图像分析系统测量其吸光度值,每张切片随机检测5个视野,然后计算出平均吸光度值,以平均吸光度值作为P27表达水平的半定量参数。
2 结果
2.1 各组大鼠肾重、肾肥大指数的情况(表1)由表1可见,与SO组相比,M组、Q组、B组的肾重明显增加(t值分别为5.72、5.87、6.01,P<0.01),肾肥大指数亦明显增加(t值分别为13.60、10.14、9.31,P<0.01),提示模型制备成功;与M组相比,Q组、B组的肾重较轻,但差异不明显(t值分别为0.45、0.26,P>0.05),肾肥大指数明显减小(t值分别为3.16、2.56,P<0.05)。
表1 各组大鼠肾重、肾肥大指数的比较 ±s)
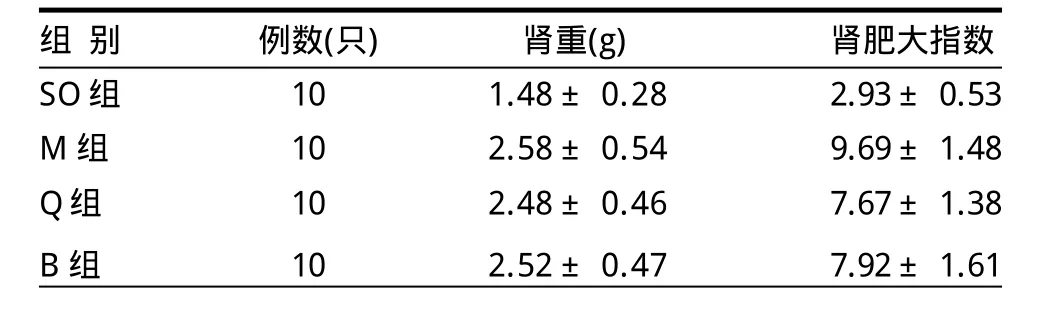
表1 各组大鼠肾重、肾肥大指数的比较 ±s)
组 别 例数(只)肾重(g)肾肥大指数SO组 10 1.48±0.28 2.93±0.53 M组 10 2.58±0.54 9.69±1.48 Q组 10 2.48±0.46 7.67±1.38 B组 10 2.52±0.47 7.92±1.61
2.2 各组大鼠β2-微球蛋白和尿微量白蛋白情况(表2)由表2可见,与SO组相比,M组、Q组、B组的β2-MG水平升高(t值分别为13.41、10.05、9.33,P<0.01),UAlb水平亦明显升高(t值分别为6.90、2.50、2.62,P<0.05);与M组相比,Q组、B组的β2-MG明显下降(t值分别为3.78、3.48,P<0.01),UAlb水平亦明显下降(t值分别为4.15、3.97,P<0.01)。
表2 各组大鼠β2-MG、UAlb的比较 ±s)
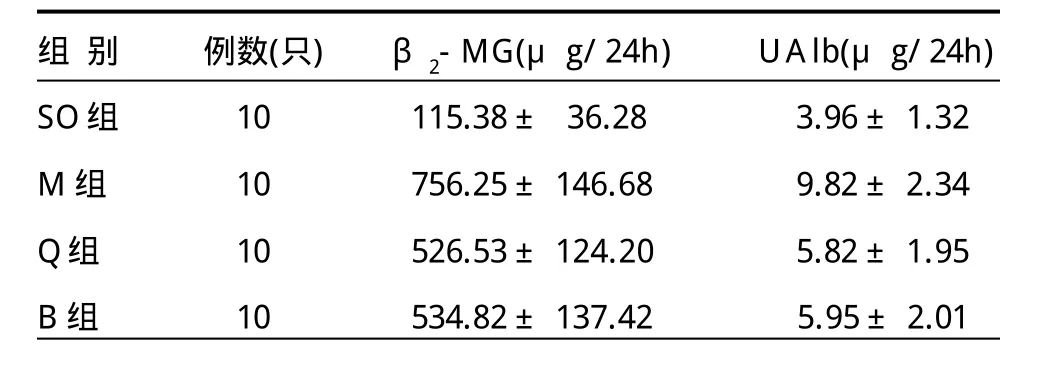
表2 各组大鼠β2-MG、UAlb的比较 ±s)
组 别 例数(只)β2-MG(μg/24h)UAlb(μg/24h)SO组 10 115.38± 36.28 3.96±1.32 M组 10 756.25±146.68 9.82±2.34 Q组 10 526.53±124.20 5.82±1.95 B组 10 534.82±137.42 5.95±2.01
2.3 各组大鼠Scr、BUN的情况(表3)由表3可见,与SO组相比,M组、Q组、B组的Scr水平升高(t值分别为14.01、7.36、8.59,P<0.01),BUN水平亦明显升高(t值分别为8.62、7.14、8.52,P< 0.01)。与M组相比,Q组、B组的Scr水平下降(t值分别为4.91、4.71,P<0.01);与M组相比,Q组BUN水平下降明显(t=2.51,P<0.05),而B组BUN水平下降不明显(t=1.63,P>0.05)。
表3 各组大鼠Scr、BUN的比较 (±s)
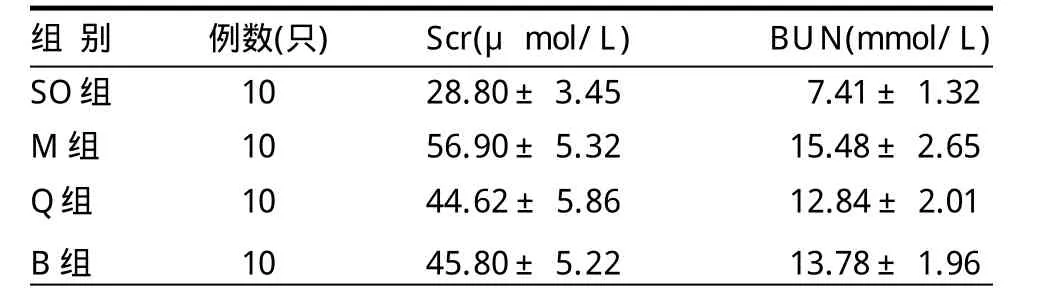
表3 各组大鼠Scr、BUN的比较 (±s)
组 别 例数(只)Scr(μ mol/L)BUN(mmol/L)SO组 10 28.80±3.45 7.41±1.32 M组 10 56.90±5.32 15.48±2.65 Q组 10 44.62±5.86 12.84±2.01 B组 10 45.80±5.22 13.78±1.96
2.4 各组大鼠肾脏组织形态学的情况 光镜下观察:SO组见肾小球结构清晰,未见增大及萎缩,球囊壁光滑,细胞外基质与系膜细胞分布正常,毛细血管腔清晰,系膜细胞无增生,基底膜无增厚。模型组肾小球面积增大,肾小球肿胀,肾小囊变窄,基底膜增厚,系膜增宽,系膜细胞增生,部分肾小管上皮细胞出现肥大、空泡变性,管腔变窄,部分小血管玻璃样变性。B组和Q组亦出现上述病理改变,但与模型组相比均有不同程度的减轻。
2.5 各组大鼠P27表达的比较(表4)由表4可见,与SO组相比,M组P27表达明显增加(t=7.71,P<0.01),Q组、B组P27表达增加不明显(t值分别为1.65、1.88,P>0.05);与M组相比,Q组、B组的P27表达明显下降(t值分别为3.59、3.63,P<0.01)。
表4 各组大鼠P27表达的比较 ±s)

表4 各组大鼠P27表达的比较 ±s)
组别 例数(只)P27 S0组 10 2.72±0.48 M组 10 5.56±1.06 Q组 10 3.52±1.45 B组 10 3.58±1.36
3 讨论
DN是糖尿病最常见的严重微血管并发症,是糖尿病死亡的主要原因之一。大量的临床研究均证实血管紧张素转换酶抑制药可用于治疗DN,对糖尿病患者肾脏起到保护作用,可以延缓其肾功能的进一步恶化[5]。故本次研究以ACEI的代表药物——贝那普利作为对照,探讨槲皮素对DN的治疗作用及其机制,为其临床应用提供理论依据。
肾脏肥大是DN早期的特征性改变,也是预示后期肾功能减退的一个形态学指标。肾脏肥大主要是指肾脏体积增大,包括肾小球体积增大和肾小管细胞肥大,尤以后者为著,约占整个肾脏体积的90%。有研究发现[6],高血糖、肾脏血流动力学的紊乱均可以刺激肾脏固有细胞,通过各种方式合成及释放相关细胞因子,影响肾脏固有细胞的增殖周期和细胞外基质(ECM)的合成,肾脏细胞肥大主要与周期素激酶抑制剂P27表达关系密切。
P27是一种分子量为27KD的热稳定蛋白,属于非特异性激酶抑制剂(CKI)家族一员,可抑制许多不同的Cyclins/CDK复合物的活性,使细胞不能通过G1期,G1期过度延长抑制细胞增殖,而对细胞周期进行调控。P27水平的高低对细胞是处于静止期或进入细胞周期具有重要的作用。在细胞增殖过程中,P27是细胞周期G1/S期转换过程的关键。研究发现,P27对肾脏细胞增殖、肥大、分化、凋亡等均具有重要的调控作用[7],糖尿病高血糖状态刺激并上调P27表达,由于细胞中周期调节蛋白依赖性激酶(CDK)抑制剂P27表达的增加,可结合并灭活G1期时相相应细胞周期素与CDK复合物,导致CDK活性下降,阻止G1期向S期转变,细胞分裂停滞于G1期,表现为细胞蛋白质/DNA比值病理性增高、细胞肥大、ECM合成增多、基膜增厚,继而导致肾小球硬化、肾小管萎缩及间质纤维化等一系列不可逆病理改变。因此,调控P27功能可明显减轻糖尿病肾病的发生与发展。
本文结果显示,P27阳性细胞主要为胞浆呈棕褐色,假手术组P27阳性表达较少,模型组P27阳性表达明显增多,结合模型组高血糖、肾重大、肾脏肥大指数高,提示高糖刺激下P27表达增加,已知P27为CKD制性蛋白,可直接抑制多种CDK表达和活性,而P27的过强表达使细胞停顿于G1期,引起蛋白合成增加,从而致早期糖尿病肾病的细胞周期停顿及细胞肥大。因此,推断糖尿病肾病早期肾脏肥大至少部分与肾皮质P27蛋白表达增加有关,说明P27是一种十分重要的细胞周期负调节蛋白,与糖尿病肾病的发生、发展密切相关,在糖尿病肾病大鼠肾损害中起重要作用。与模型组相比,槲皮素组P27表达明显减少,结合肾重、肾脏肥大指数等指标,提示槲皮素可能通过抑制P27的表达,从而减弱对CKD活性的抑制,促使细胞越过S期而逆转细胞肥大。由此推断,通过下调P27表达,抑制肾脏细胞的过度增殖与肥大,进而减少ECM分泌,延缓DN的进展,从而发挥肾保护作用可能是槲皮素防治糖尿病肾病的机制之一。
[1]Wolf G,Schroeder R,Zahner G,et a1.High glucose induced hypertrophy of mesangial cells requires P27(kip1),an inhibitor of cyclin-dependent kinases [J].Am J Pathol,2001,158(3):1091-1100.
[2]梅小斌,高从容,崔若兰,等.槲皮素降低肾小球周期素激酶抑制剂p27水平改善糖尿病肾病[J].上海医学,2003, 26(4):246-248.
[3]李列平,李雄,彭自全,等.槲皮素对大鼠慢性肾功能衰竭及促红细胞生成素水平的影响[J].中国医院药学杂志, 2004,24(7):412-414.
[4]Yokozawa T,Nakagawa T,Wakaki K,et al. Animal model of diabetic nephropathy[J].Exp Toxicol Pathol,2002,53(5):359-363.
[5]Zhang HJ,Xiao J,Chen ML,et al.Study of treating diabetic nephropathy with benazapril and valsartan[J]. Sichuan Journal of Physiological Sciences,2009,31(3):114-116.
[6]姜晓宇,袁伟杰.细胞周期调节蛋白与肾脏疾病[J].国外医学·遗传学分册,2003,26(2):67-69.
[7]Bischoff SC.Quercetin:potentials in the prevention and therapy of disease [J].Curr Opin Clin Nutr Metab Care,2008,11(6):733-740.
