腺苷酸激活蛋白激酶在大鼠酒精性肝病中的表达减少
2012-07-18周东方周俊英
周东方,魏 峰,周俊英
(河北医科大学第三医院感染科,河北石家庄 050051)
酒精性肝病(alcoholic liver disease,ALD)是长期大量饮酒所致的肝脏损害性病变,其病理改变包括酒精性脂肪肝、酒精性脂肪性肝炎、酒精性肝纤维化及酒精性肝硬化[1]。ALD发病过程中存在脂质代谢紊乱,脂肪在肝脏堆积[2]。腺苷酸激活蛋白激酶(AMP-activated protein kinase,AMPK)被称为细胞的“代谢感受器”,参与多种代谢过程[3]。本研究拟通过观察AMPK及其相关下游激酶在肝脏中的表达情况,探讨AMPK在ALD发病过程的意义。
1 材料与方法
1.1 材料
清洁级雄性Wistar大鼠,体质量200±20 g(由河北医科大学动物实验中心提供,合格证号708020)。AMPK-α2羊多克隆抗体(Santa Cruz生物技术有限公司);乙酰辅酶A羧化酶(Acetyl-CoA carboxylase,ACC)兔多克隆抗体(Abcam生物技术有限公司);固醇调节原件结合蛋白(sterol regulatory element-binding proteins,SREBP)1c兔多克隆抗体(北京博奥森生物技术有限公司);Taq DNA聚合酶(北京天根生物科技有限公司);AMV反转录酶(Promega公司);AMPK、ACC、SREBP、β-actin引物由上海捷瑞生物工程有限公司合成。
1.2 方法
1.2.1 动物模型的建立及分组:随机分出10只为正常对照组,其余动物采用逐渐增加乙醇浓度和剂量的方法每日上午9时灌胃(乙醇浓度30% ~60%,剂量5~9 g/kg),分别于 4、8、12和16 周末禁食12 h后股动脉放血处死动物10、9、8和8只,分离血清低温保存,新鲜肝组织冰冻切片;取部分肝脏左叶以10%中性甲醛固定;另取肝组织立即-80℃冰冻备检[4]。
1.2.2 检测指标:1)生化指标:测定肝功能ALT、AST、CHE 及血脂 TG、TC、HDL、LDL、VLDL 水平,应用OLYMPUS AU-600全自动生化分析仪检测。2)病理学检查:新鲜肝组织冰冻切片行苏丹Ⅳ染色,余肝组织标本常规苏木素-伊红染色,光镜下观察肝组织普通病理变化。3)免疫组织化学染色法:采用PV法检测AMPK-α2、ACC及SREBP-1c蛋白表达。肝组织蜡块以3 μm厚度连续切片,常规脱蜡至水,进行抗原修复,滴加一抗,4℃冰箱过夜,阴性染色用PBS代替一抗,滴加辣根酶标记的二抗,置于37℃温箱孵育30 min,光镜下DAB显色;苏木精复染,0.1%盐酸分化,氨水返蓝,常规脱水,透明,中性树胶封片。一抗工作浓度:AMPK-α2:1∶100;ACC:1∶80;SREBP - 1c:1∶100。在光镜下按染色程度(0~3分为阴性着色、淡黄色、浅褐色、深褐色)、阳性范围进行评分(1~4分为0% ~25%、26% ~50%、51% ~75%、76% ~100%),最后将分数相加。4)RT-PCR法:测定AMPK、ACC及SREBP mRNA的表达(表1)。
1.3 统计学分析
用SPSS13.0统计软件分析实验数据,进行多组间方差分析,以均数±标准差(±s)表示。相关性分析用Pearson直线相关分析法。

表1 AMPK、ACC及SREBP的引物序列及反应条件Table 1 The primers sequence and reactive conditions of AMPK、ACC and SREBP
2 结果
2.1 血清学指标的变化
各且与正常对照组比较,随着造模时间的延长,ALT和AST水平逐渐升高,CHE水平逐渐降低(P<0.05,P<0.01)(图1);TG、TC和LDL水平逐渐升高,HDL水平逐渐降低(P<0.05或P<0.01)(图2)。

图1 大鼠血清ALT、AST及CHE的测定结果Fig 1 Serum level of ALT、AST and CHE of the rats
2.2 肝组织病理
各实验组肝组织脂肪变性明显,肝小叶内出现炎性坏死灶,至模型16周组大鼠肝细胞呈弥漫性小泡性脂肪变性,窦周纤维化,汇管区纤维组织增生并有纤维间隔形成(图3)。

图2 大鼠血清TG、TC、LDL、VLDL and HDL的测定结果Fig 2 Serum TG、TC、LDL、VLDL and HDL of the rats
2.3 免疫组织化学染色
随着造模时间的延长AMPK-α2阳性表达逐渐减弱,主要表达于肝细胞胞质内 (图4);ACC阳性表达逐渐增强,主要表达于肝细胞胞质内 (图5);SREBP阳性表达逐渐增强,主要表达于肝细炎性坏死灶,至模型16周组大鼠肝细胞呈弥漫性小泡性脂肪变性,窦周纤维化,汇管区纤维组织增生并胞胞质或胞核内。与正常对照组比较(P<0.05)(图6,7)。

图3 大鼠肝组织HE染色Fig 3 The liver tissue of rats(HE×400)


图6 大鼠肝组织SREBP-1c的表达Fig 6 SREBP-1c expression of the rat liver(immunohisto-chemical staining×400)

图7 免疫组织化学法检测大鼠肝组织AMPK、ACC、SREBP的表达Fig 7 AMPK、ACC and SREBP of the rat liver by immunohisto-chemical method
2.4 RT-PCR
随着造模时间延长,AMPK mRNA表达量逐渐减少;随着造模时间的延长,ACC、SREBP mRNA的表达逐渐增加。与正常对照组比较P<0.05(图8,9)。肝组织中 AMPK的相对表达量与 ACC及SREBP的相对表达量均呈负相关(P<0.01)。
3 讨论
本研究显示应用乙醇灌胃的方法可以成功制备大鼠ALD模型,该模型肝脏病变如脂肪变性、炎性反应和纤维化等可以反映临床ALD的基本病变[5]。病理染色显示随着血清TG、TC、LDL、VLDL逐渐升高,HDL逐渐降低,肝组织脂肪变性逐渐加重,提示乙醇灌胃可以造成大鼠脂质代谢紊乱。喂食乙醇1周后大鼠肝小叶Ⅲ带出现氧含量减少。肝组织缺氧的最早损害主要是通过中断线粒体呼吸链的递氢环节导致线粒体的供能障碍,使ATP减少和耗尽、氧自由基大量形成和脂肪酸氧化受阻,造成脂肪沉积于肝细胞,形成脂肪肝[6]。
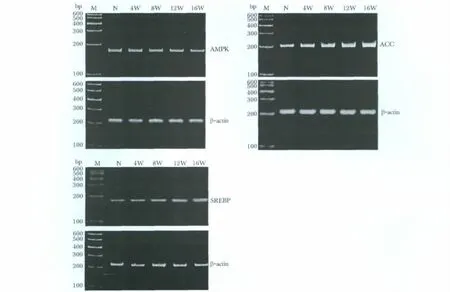
图8 RT-PCR法检测大鼠肝组织AMPK、ACC、SREBP mRNA/β-actin mRNA的表达Fig 8 AMPK、ACC、SREBP mRNA/β-actin mRNA expression of the rat liver with the RT-PCR method

图9 RT-PCR检测大鼠肝组织 AMPK、ACC、SREBP mRNA的表达Fig 9 AMPK、ACC and SREBP mRNA of the rat liver by RT-PCR
AMPK存在于线粒体内,属于丝/苏氨酸蛋白激酶家族成员,由α、β和γ 3个亚单位组成,α亚单位是AMPK的主要催化部位,其中α2主要分布于肝脏、骨骼肌和心脏。AMPK的活性主要受细胞中AMP/ATP比值的调节,AMPK发生磷酸化并激活其下游的多种靶分子,当AMP/ATP比值升高或降低分别调节分解代谢和合成代谢。ACC存在于胞质中,是脂肪酸合成的限速酶,同时又是AMPK的下游靶分子,AMPK能磷酸化ACC的79位点苏氨酸而使其失活[7]。SREBP是一类位于内质网和核被膜上的膜连接蛋白,是参与脂肪合成基因的主要转录调节因子,主要在肝脏和脂肪细胞表达,AMPK抑制SREBP靶基因的表达,同时ACC又是SREBP的靶基因,因此AMPK可能在调节脂肪酸和胆固醇代谢中发挥着重要作用,其作用机制为通过激活AMPK,促进 ACC发生磷酸化而失活,并减少SREBP的表达,下调其靶基因在肝细胞内的表达,从而抑制肝内的脂肪合成过程,进一步降低脂肪在肝脏中过度沉积所引起的脂毒性[8-9]。采用免疫组织化学染色发现SREBP-1c阳性着色由胞质转移至胞核,可能是由于 SREBP裂解激活蛋白,将SREBP-1c从内质网护送到高尔基复合体,从而进行裂解,经过2步裂解后,SREBP-1c片段从膜上游离出来,进入细胞核与固醇调节元件结合,调节脂代谢相关酶基因的转录。
本研究显示,随着造模时间的延长,肝组织病变加重,肝组织AMPK表达减少而ACC和SREBP的表达逐渐增加,且与AMPK呈现明显的负相关性,提示ALD发病过程中AMPK表达减少,对ACC、SREBP活化的抑制作用减弱,导致脂质合成增多,氧化分解减少,造成脂肪堆积,参与ALD发病机制的“第一次打击”,可能是造成肝脏损伤的重要因素之一。
[1]中华医学会肝病学分会脂肪肝和酒精性肝病学组.酒精性肝病诊疗指南[J].中华肝脏病杂志,2006,14:164-166.
[2]周俊英,姚树坤,甄真,等.环氧合酶-2在酒精性肝病中表达增强[J].基础医学与临床,2007,27:68-71.
[3]Ha SK,Kim J,Chae C.Role of AMP-activated protein kinase and adiponectin during development of hepatic steatosis in high-fat diet-induced obesity in rats[J].Compathol,2011,145:88 -94.
[4]周俊英,林琳,王玮,等.酒精性肝病大鼠模型肝组织中的硝化应激指标表达增强[J].基础医学与临床,2010,30:773-774.
[5]王玮,周俊英,赵彩彦,等.脂联素及其受体在酒精性肝病大鼠肝组织中的表达下降[J].基础医学与临床,2010,30:170-174.
[6]Arteel GE.Alcohol-induced oxidative stress in the liver:in vivo measurements[J].Methods MolBiol,2008,447:185-197.
[7]Li L,Wu LL,Wang C,et al.Adiponectin modulates carnitine palmitoyltransferase-1 through AMPK signaling cascade in rat cardiomyocytes[J].Regul Peptide,2007,139:72-79.
[8]Huypens P,Quartier E,Pipeleers D,et al.Metformin reduces adiponectin protein expression and release in 3T3-L1 adipocytes involving activation of AMP activated protein kinase[J].Eur J Pharmacol,2005,518:90 -95.
[9]Sozio MS,Liangpunsakul S,Crabb D.The role of lipid metabolism in the pathogenesis of alcoholic and nonalcoholic hepatic steatosis[J].Semin Liver Dis,2010,30:378 -390.
