赤藓糖醇对变异链球菌作用机制的实验研究
2012-07-17姚军张佳丽
姚军 张佳丽
(福建医科大学附属口腔医院 儿童牙科,福州 350002)
赤藓糖醇是一种具有极低热量值[1]的糖醇类食品,目前对赤藓糖醇的研究多集中在其低热量、高耐受性等方面,还未将赤藓糖醇广泛的应用于防治龋病方面。国内外研究表明:赤藓糖醇可以抑制变异链球菌的生长[2-4],具有防龋的作用[5]。但关于赤藓糖醇对变异链球菌的抑菌机制尚未完全明了。本实验通过测定在蔗糖和赤藓糖醇条件下变异链球菌所在的液体培养基中乳酸脱氢酶(lactate dehydrogenase,LDH)的活性,以及在扫描电镜(scanning electron microscope,SEM)下观察赤藓糖醇作用后变异链球菌表面的形态变化,了解赤藓糖醇对变异链球菌表面结构的影响,从而探讨赤藓糖醇的抑菌机制。
1 材料和方法
1.1 菌株和主要试剂
变异链球菌国际标准株ATCC25175(四川大学华西口腔医学院龋病研究室惠赠),双蒸水(福建医科大学附属口腔医院中心实验室制造),蔗糖(分析纯,分子式C12H22O11,相对分子质量为342.29,广东省化学试剂工程技术研究开发中心),赤藓糖醇(分子式C4H10O4,相对分子质量为122.12,山东省保龄宝生物股份有限公司),木糖醇(分子式C5H12O5,相对分子质量为152.15,天津市福晨化学试剂厂)。TPY液体培养基(1.5%胰蛋白胨、0.4%酵母提取物、1%葡萄糖、0.6%磷酸二氢钾、0.2%碳酸钠、0.2%氯化钠、0.2%磷酸氢二钾、双蒸水)调节pH值到7.0,高压灭菌。TPY固体培养基(液体培养基中加入1.25%琼脂)高压灭菌。
1.2 主要实验仪器
厌氧培养箱(上海新苗医疗器械制造有限公司),超净工作台(上海力申科学仪器有限公司),电子分析天平(北京赛多利斯仪器系统有限公司),SEM(飞利浦公司,荷兰),台式冷冻高速离心机(Heraeus公司,德国)。
1.3 实验方法
1.3.1 变异链球菌的复苏和纯化 将在甘油中保存的变异链球菌标准株接种至TPY固体培养基内,37℃厌氧(80%N2、10%CO2、10%H2)条件下培养24 h。取上述复苏的标准株单个菌落接种于TPY固体培养基内,相同条件下培养24 h。
1.3.2 LDH活性测定 将实验分为蔗糖组、木糖醇组和赤藓糖醇组,浓度均为8%,每组3个试管。各取200μL菌液分别加入含上述成分的TPY液体培养基(各20mL)中,各组均置入37℃厌氧环境(80%N2、10%CO2、10%H2)中培养24 h后,3 500·min-1离心10min,用微孔滤膜(0.22μm)过滤除去细菌后取其上清液,用全自动生化分析仪分别测定各个试管上清液中LDH的活性,其原理是基于酶对光的选择性吸收,即分光光度法。酶的活性用光密度值来表示,也反映了各试管中酶的浓度。
1.3.3 蔗糖和赤藓糖醇作用前后变异链球菌形态学的SEM观察 将实验分为2组,分别为8%蔗糖组和8%赤藓糖醇组,细菌的培养条件如上。在试管中放入1 cm×1 cm大小的盖玻片,每管加入菌液100μL及添加有蔗糖或赤藓糖醇的TPY培养基4mL。在37℃厌氧环境(80%N2、10%CO2、10%H2)中培养8 h后,小心弃菌液,取出盖玻片,2%戊二醛固定1 h,乙醇梯度脱水30min[6],干燥,喷金,SEM下观察细菌形态。
1.4 统计学分析
采用SPSS 13.0统计软件进行分析,对以上结果进行多样本均数多重比较的统计分析。
2 结果
2.1 赤藓糖醇对变异链球菌LDH的影响
变异链球菌分别在蔗糖、木糖醇和赤藓糖醇的TPY培养基中培养24 h后,上清液中LDH的含量分别为(0.2±0.1)、(3.2±0.1)、(3.2±0.1)IU·L-1。在蔗糖组,上清液中LDH的量与其他两组相比差异有统计学意义(P<0.05),但这种差异在临床实验中却很小;木糖醇组与赤藓糖醇组相比较,上清液中LDH的量差异无统计学意义(P>0.05)。
2.2 蔗糖和赤藓糖醇作用前后变异链球菌形态学的SEM观察结果
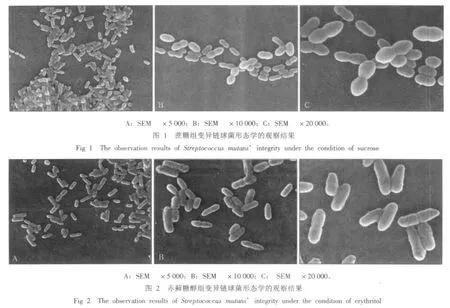
在蔗糖和赤藓糖醇作用后,SEM下观察变异链球菌的表面形态结果见图1、2。由图1、2可见,在5000倍镜下,蔗糖组细菌分布总体较稠密,有部分区域呈团块状,赤藓糖醇组细菌分布总体较为稀疏。在10 000、20 000倍镜下,蔗糖组和赤藓糖醇组中均可见变异链球菌外形清晰,细菌表面光滑,无缺损,没有内容物溢出的迹象。
3 讨论
赤藓糖醇的防龋功能已经被初步证实,其抑制变异链球菌的作用也已经得到初步的肯定,但关于其抑菌机制尚未完全明了,可以从以下几个方面推测考虑。
3.1 对细胞壁和细胞膜结构的影响
细胞壁和细胞膜都是细菌的重要结构,细胞壁能维持细胞的正常形态和进行物质交换,保持细胞内的高渗压;而细胞膜位于细胞壁内层,由脂质双分子层和蛋白质组成,具有渗透屏障和选择性物质运输等功能。一旦细胞壁和细胞膜的完整性遭到破坏,细胞内容物就会大量溢出,所以可以用细菌的培养上清液中细胞内酶的含量来作为判断细胞壁和细胞膜是否完整的一个重要的指标。
LDH是变异链球菌等细菌内的固有酶,该酶总以高浓度存在于细胞内,是变异链球菌代谢过程中一种重要的酶。LDH可以通过其催化作用,调节菌斑酸的代谢,维持菌斑生态平衡,并对抗由环境中糖浓度突然增加而引起的菌细胞死亡[7]。因为这些酶主要存在于细胞内,而在培养基内较少,所以本实验通过测定变异链球菌培养上清液中LDH的浓度来判定赤藓糖醇对该细菌细胞壁以及细胞膜的影响。实验结果显示:加入赤藓糖醇后培养上清液中LDH的浓度比加入蔗糖时高,但这种差异很小,在临床实验中几乎可以忽略,这提示只有极少量变异链球菌的细胞壁和细胞膜的完整性被破坏。扫描电镜下也见在蔗糖或赤藓糖醇条件下,大多数变异链球菌的表面形态并没有很大的不同,细菌表面光滑,无缺损,并没有看见有内容物的溢出。可以推测,赤藓糖醇对变异链球菌的抑制作用主要不是通过对变异链球菌细胞壁或者细胞膜的直接破坏来实现的。
3.2 干扰细菌内正常的生理代谢
根据木糖醇抑制细菌作用的机制来推测其抑菌机制主要为以下几个方面:首先变异链球菌的磷酸烯醇式丙酮酸依赖性磷酸转移酶系统(phosphoenolpyruvic acid-phosphotransferase system,PEP-PTS)可以将赤藓糖醇转移至细菌体内,同时对该酶的占用也抑制了细菌对葡萄糖的吸收转运。其次,赤藓糖醇在细菌体内被磷酸化的产物堆积,抑制变异链球菌的生长。再次,赤藓糖醇可能会在细菌体内产生“磷酸—脱磷酸”这种无效的循环,导致大量的磷酸烯醇式丙酮酸(phosphoenolpyruvic acid,PEP)被消耗,而PEP是合成三磷酸腺苷的原料和PEP-PTS系统的能量来源,这就导致了细菌生长的抑制。最后可以从分子生物学角度探究。研究发现:木糖醇可以干扰变异链球菌的蛋白合成及热休克蛋白-60、70的表达,进而影响变异链球菌的生长[8]。还可从对变异链球菌分子蛋白合成影响方面来探索赤藓糖醇的抑菌机制。
3.3 阻止其他营养物质进入菌体
赤藓糖醇的存在抑制了变异链球菌对葡萄糖的转运吸收,因为其占用了转运葡萄糖的转移酶。另一方面当葡萄糖被吸收时,易被变异链球菌的特异性葡糖基转移酶、果糖基转移酶转化为胞外多糖,形成葡聚糖和果聚糖。其中不溶性葡聚糖具有黏性,能抵抗口腔细菌的降解,是构成菌斑基质的主要成分。它能促进细菌在牙面的集聚,促进菌斑的形成。而且其可以改变菌斑的基质结构,使菌斑成为多孔性结构,有利于葡萄糖溶液渗透进入菌斑-釉质交界面并被细菌发酵产酸,增加菌斑的致龋性[9]。赤藓糖醇不能被利用产生不溶性葡聚糖,也就不能形成这种多孔性的结构,不利于营养物质的进入。
赤藓糖醇对变异链球菌的抑制机制还处在初步探索阶段,本实验只是初步证明赤藓糖醇对变异链球菌细胞壁和细胞膜并没有很强的破坏作用,其具体的抑菌机制还需更深入的探讨研究。
[1]刘建军,赵祥颖,田延军,等.低热值甜味剂赤藓糖醇的研究现状及应用[J]. 中国酿造,2006,25(12):1-3.Liu Jianjun,Zhao Xiangying,Tian Yanjun,et al.Current research situation and application of erythritol as low-cal sweetener[J].China Brewing,2006,25(12):1-3.
[2]Mäkinen KK,Isotupa KP,Kivilompolo T,et al.Comparison of erythritol and xylitol saliva stimulants in the control of dental plaque and mutans streptococci[J].Caries Res,2001,35(2):129-135.
[3]Mäkinen KK,Isotupa KP,Kivilompolo T,et al.The effect of polyol-combinant saliva stimulants on S.mutans levels in plaque and saliva of patientswith mental retardation[J].Spec Care Dentist,2002,22(5):187-193.
[4]Kawanabe J,Hirasawa M,Takeuchi T,et al.Noncariogenicity of erythritol as a substrate[J].Caries Res,1992,26(5):358-362.
[5]杨海军.赤藓糖醇的发展及应用[J].中国食品添加剂,2004,15(1):100-102.Yang Haijun.The development and application of erythritol[J].China Food Additives,2004,15(1):100-102.
[6]Kim JE,Kim HE,Hwang JK,et al.Antibacterial characteristics of Curcuma xanthorrhiza extract on Streptococcus mutans biofilm[J].JMicrobiol,2008,46(2):228-232.
[7]周学东.口腔生物化学[M].成都:四川大学出版社,2002:253-255.Zhou Xuedong.Oral biological chemistry[M].Chengdu:Sichuan University Press,2002:253-255.
[8]Hrimech M,Mayrand D,Grenier D,et al.Xylitol disturbs protein synthesis,including the expression of HSP-70 and HSP-60,in Streptococcus mutans[J].Oral Microbiol Immunol,2000,15(4):249-257.
[9]Ruottinen S,Karjalainen S,Pienihäkkinen K,et al.Sucrose intake since infancy and dental health in 10-year-old children[J].Caries Res,2004,38(2):142-148.
