超表达OsSsr1基因增强烟草耐盐性
2012-07-16肖姗姗常闪闪刘凤权
封 伟,肖姗姗,常闪闪,刘凤权,邵 敏
(南京农业大学植物保护学院/农作物生物灾害综合治理教育部重点实验室,江苏南京210095)
土壤盐渍化是影响农业生产的一个全球性问题。在世界范围内,灌溉土地的1/3受到盐分胁迫,并且过量的灌溉及降雨的缺乏等一系列因素加剧了盐渍化程度,使土地盐渍化面积逐年增加,已经成为农业可持续发展的制约因素[1]。当前,研究植物盐胁迫分子机制,寻找提高植物耐盐胁迫方法、培育耐盐植株,成为科学研究的一个热点[2]。
OsSsr1基因是一个未知功能基因。本实验室将Harpin蛋白编码基因hrf1基因转入水稻获得的转基因系NJH12具有对干旱等非生物胁迫和生物胁迫的耐性[3]。在NJH12的表达谱中,发现OsSsr1基因表达上调2.8倍,可能与植物的逆境胁迫反应有关(未发表数据)。本研究利用农杆菌介导法将来自水稻Os-Ssr1基因转入烟草,发现OsSsr1的超表达促进了脯氨酸的积累和活性氧清除能力的提高,从而增强了转基因烟草对NaCl的耐受能力。
1 材料与方法
1.1 材料
转基因受体烟草:本氏烟(Nicotiana benthamiana)。
植物双元表达载体pVec8由江苏省农科院杨杰副研究员提供。在pVec8的BamHI和KpnI两个酶切位点间加入水稻OsSsr1基因,构建载体pVOsSsr1(图1),并将其导入土壤根癌杆菌LBA4404(Agrobacterium tumefaciens LBA4404),用于转化烟草。
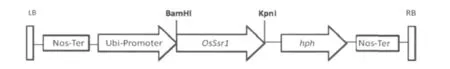
图1 烟草转基因载体pVOsSsr1示意图Fig.1 Schematic diagram of plant expression plasmid pVOsSsr1
1.2 方法
1.2.1 RT-PCR和 PCR- Southern分析 用Trizol Reagent(Invitrogen)提取烟草总RNA[4]。根据OsSsr1的cDNA 序列设计引物OsSsr1-F2:5'- TGTTCATTGCCGGAGTTACCAAGTA -3';OsSsr1 -R2:5'- TTCAACCACGC CCAAGTCCAT-3',用于 RT- PCR 反应用One Step RNA PCR Kit(Takara,大连)进行RT- PCR 扩增,反应体积为50 μL,RNA 量1 μg,10 μM 的上下游引物各 2 μL,RNA 酶抑制剂 40 U,10 × Buffer 5 μL,25 mM的MgCl210 μL,10 mM 的 dNTP Mixture 5 μL,MAV 反转录酶5 U。反应条件:50℃,30 min;94℃,2 min;94℃,30 s;48℃,30 s;72℃,1 min;30个循环;延伸72℃,7 min。RT-PCR产物经1%琼脂糖电泳分离后转至尼龙膜上,用上述进行RT-PCR的引物及PCR DIG探针合成试剂盒(Roche公司)标记相应的cDNA为探针,按照Engler-Blum[5]描述的方法进行Southern杂交,检测尼龙膜上的PCR产物。
1.2.2 转基因烟草的获得 通过土壤根癌杆菌介导的方法,由潮霉素筛选,分化后获得T0代转基因植株,并进行分子验证留取阳性植株。通过RT-PCR和PCR-Southern对T1代转基因植株的目的基因进行验证,剔除假阳性植株。
无菌条件下将两个T1代转基因株系T1-3,T1-4的种子装入灭菌1.5 mL EP管中。加入1 mL 30%的双氧水,放入摇床中180 rpm,28℃消毒10 min。用灭菌水冲洗5次以上,并将转基因种子转入含有40 mg/L潮霉素的1/2 MS培养基上,26℃,16 h光照/8 h黑暗条件下培养。本氏烟野生型(WT)种子经消毒后,放入不含潮霉素的1/2 MS培养皿中,相同条件下培养。将生长两周的幼苗移栽到由蛭石固定的花盆中,浇Hoagland营养液。在温室培养3周,在此期间提取转基因烟草的基因组进行PCR筛选。
1.2.3 盐胁迫处理 两周龄幼苗盐胁迫处理:将幼苗转入加有0.2 M NaCl的1/2 MS培养基上,28℃培养3天。再将幼苗转入不含NaCl的1/2 MS培养基上培养10 d观察拍照。
五周龄植株胁迫处理:把 Hoagland营养液培养的T1-3,T1-4和 WT烟草用0.15 M NaCl处理12 d,分别在处理过程的第3、6、9、12 d取样,采用李合生等[6]的方法,测定烟草叶片中丙二醛(MDA)含量、脯氨酸含量及超氧化物歧化酶(SOD)和过氧化物酶(POD)活性的测定。
2 结果与分析
2.1 转基因烟草的检测
对2个具有潮霉素抗性株系的T1代植株(T1-3,T1-4)及野生型植株(WT)进行RT-PCR检测结果表明(图2),潮霉素抗性植株得到与目的片段(547 bp)大小一致的产物,而野生型植株则无条带。
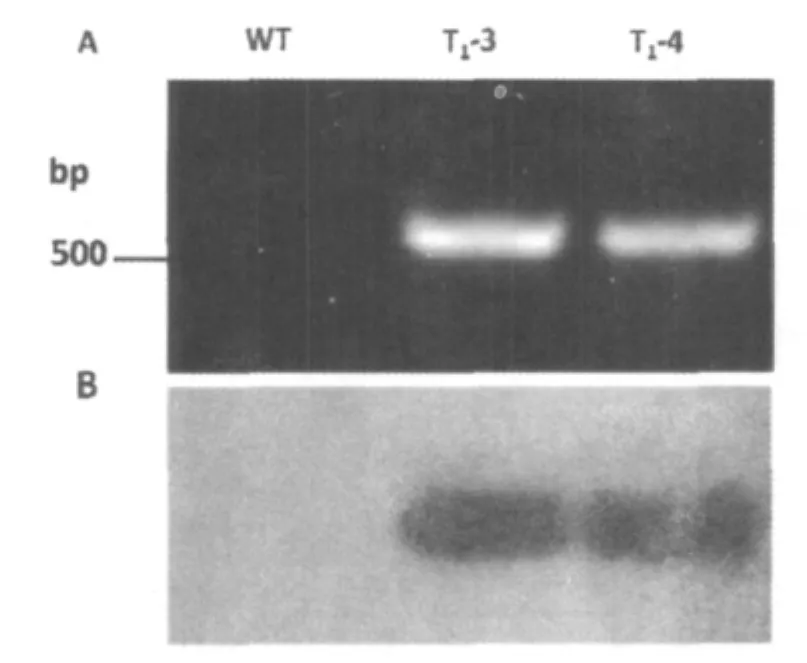
图2 转基因烟草的RT-PCR(A)和PCR-Southern(B)杂交检测Fig.2 RT -PCR(A)and Southern blot analysis(B)of transgenic tobacco plants WT,wild-type;T1-3、T1-4,transgenic tobacco lines
为进一步明确扩增产物是否为目的基因片段,将电泳分离的PCR产物进行PCR-Southern杂交,结果表明PCR扩增得到的特异片段是目的基因的扩增产物,进而说明外源基因已整合到烟草基因组中,并遗传到T1代。
2.2 转基因烟草的耐盐性测定
烟草在高浓度盐的胁迫中,叶片都受到损伤而呈现不同程度的黄化、白化,甚至整株死亡。在10天的恢复后从图3(A)中看出,转基因烟草的两个株系(T1-3,T1-4)大部分有新叶生出,而野生型植株全部白化死亡。经过统计转基因株系T1-3存活率78%,T1-4存活率62%;野生型烟草(WT)全部死亡。这一结果说明转基因烟草具有耐盐胁迫的能力。

Fig.3 Salt tolerance in transgenic tobacco plants(A)and survival rate(B)WT,wild-type;T1-3、T1-4,transgenic tobacco lines
2.3 盐胁迫下转基因烟草和野生型烟草脯氨酸含量的变化
植物在干旱、盐胁迫下,与环境形成较高的渗透压。较高的渗透压能导致细胞组分的破坏,而渗透调节物质能够有效抑制渗透胁迫对细胞功能造成的危害[7]。脯氨酸是植物在胁迫下容易积累的一种相容渗透调节剂,它能够提高细胞内渗透势、保护细胞蛋白质结构,减少环境胁迫对细胞的伤害[8]。从图4可看出,转基因烟草和野生型烟草脯氨酸含量都明显上升,但是转基因烟草的中脯氨酸含量的积累明显高于野生型烟草。盐胁迫12 d后,转基因烟草中脯氨酸含量分别是胁迫前的23.75(T1-3)和19.5(T1-4)倍,而野生型烟草中脯氨酸含量只是胁迫前的下的11.6倍,转基因烟草中脯氨酸含量极显著高于野生型烟草(P <0.01)。

图4 盐胁迫对烟草叶片游离脯氨酸含量的影响Fig.4 Effects of salt stress on free proline content of tobacco leaves WT,wild -type;T1 -3、T1 -4,transgenic tobacco lines
2.4 盐胁迫烟草叶片MDA含量的影响
植物在逆境时,植物器官特别是膜的结构发生变化,功能随之发生变化,产生大量自由基,使植物产生膜脂过氧化作用。积累的膜脂过氧化物分解的产物为丙二醛(malondialdehyde,MDA)[9]。MDA的积累最终造成细胞膜功能的伤害和植物正常生长受到抑制。因此MDA含量被广泛认为是膜脂过氧化的指标,表示细胞膜脂过氧化程度和植物对逆境反应的强弱[10]。
图5中,随着处理时间的延长,烟草MDA的含量呈上升趋势,但转基因烟草上升较慢。盐胁迫处理12天后,转基因烟草叶片 MDA含量分别增加38.46%(T1-3)和37.04%(T1-4),分别是非胁迫下的1.38和1.37倍;而野生型烟草叶片增加了108.33% ,是盐胁迫前的2.08倍;转基因烟草叶片中 MDA含量明显低于野生型烟草。这一结果说明,在盐胁迫下,转OsSsr1基因烟草膜脂过氧化程度远低于野生型烟草,维持了植物正常生理代谢、保证转基因烟草耐盐的特性。

图5 盐胁迫对烟草叶片MDA含量的影响Fig.5 Effects of salt stress on MDA content of tobacco leaves WT,wild -type;T1 -3、T1 -4,transgenic tobacco lines
2.5 盐胁迫下转基因烟草和野生型烟草SOD和POD含量的变化
超氧化物歧化酶(superoxide dismutase,SOD)是细胞内的重要保护酶,能催化超氧阴离子自由基的歧化反应,从而清除超氧阴离子自由基,减少其对膜结构和功能的破坏,该酶的活性与植物的抗逆性密切相关[11,12]。从图6(A)可以看出:在正常生长条件下,转基因烟草中SOD的活性略低于野生型烟草,而在盐胁迫处理后,转基因烟草和野生型烟草SOD活性升高了,且在处理后第9天达到最大值:野生型烟草SOD活性上升了130.96%,是胁迫前的2.31倍;转基因的两个株系分别上升了 303.85%(T1-3)和314.05%(T1 -4),分别是胁迫前的4.04 和4.14倍。
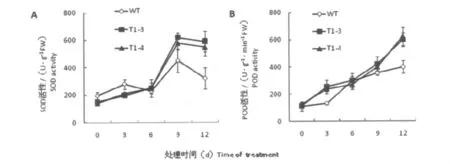
图6 盐胁迫对烟草叶片中SOD(A)和POD(B)活性影响Fig.6 Effects of salt stress on SOD(A)and POD(B)activity of tobacco leaves WT,wild-type;T1-3、T1-4,transgenic tobacco lines
过氧化物酶(peroxidase,POD)是防止膜脂过氧化的主要酶。从图6(B)中可以看出,盐胁迫处理前,转基因烟草和野生型烟草的POD含量基本相同;而随着胁迫处理时间的延长,尽管两种烟草的POD含量都呈上升趋势,但转基因烟草的POD活性明显升高更快。处理12天后,野生型烟草POD活性上升290.1%,是胁迫前的3.63倍;两个转基因系 POD活性则上升429.43%(T1-3)和380.77%(T1-4),分别是胁迫前的5.29、4.81 倍。
这些数据说明OsSsr1基因的在烟草中的表达提高了细胞内SOD和POD活性,增强了转基因烟草清除活性氧的能力。
3 讨论
Harpin蛋白编码基因转化植物,能够提高多种植物抗旱性等非生物胁迫耐性[3,13]。本文通过土壤根癌杆菌介导的方法,把从转hrf1基因水稻的转录谱中挑选了一个表达量上调的基因OsSsr1转入烟草,提高了烟草植株在盐胁迫下脯氨酸的积累水平和活性氧清除能力,从而增强了转基因植株的耐盐性。
脯氨酸的积累既能增加胞内溶质浓度、防止细胞过度脱水,也能与渗透条件下急剧增加的氧自由基发生反应,使之转变为其他物质,清除活性氧的危害[14]。转基因烟草与野生型烟草相比,积累的脯氨酸显著增多,使转基因株系在盐胁迫下能够维持与外界的渗透压,保护植物细胞的正常功能代谢,抑制渗透胁迫对细胞功能造成的危害。说明OsSsr1基因的表达提高了转基因株系在盐胁迫条件下合成渗透调节剂的能力,从而提高了植物的耐盐性。植物在盐胁迫下会产生大量的活性氧,活性氧的升高诱发脂质过氧化链式反应,破坏生物膜上酶的空间结构及生物膜的通透性,致使细胞死亡[15,16]。逆境条件下产生的活性氧对植物的伤害程度及植物对逆境的抵抗能力与其体内的SOD、POD活性有关,其活性越高,植物的抗逆性越强[17]。本研究中,在盐胁迫下,转基因系和野生型烟草体内的MDA含量虽都有不同程度的升高,但转基因株系体内的MDA的延长积累速率明显低于野生型。与此相应,转OsSsr1基因株系在盐胁迫下SOD和POD活性的升高速率明显快于野生型植株,说明OsSsr1基因的表达提高了转基因株系的活性氧清除能力,减缓了盐胁迫对植物的伤害。
本研究初步证实,OsSsr1基因在烟草中的表达能够增强烟草植株的耐盐性,这说明是该基因可能在植物对盐胁迫的响应中起重要作用,但OsSsr1在植物应对盐胁迫的信号通路中的具体作用,还需要进一步研究。
[1]Ashraf M,Foolad M R.Roles of glycine betain and proline in improving plant abiotic stress resistance[J].Environmental and Experimental Botany,2007,59:206 -216
[2]Wang WG,Vinocur B,Altman A.Plant responses to drought,salinity and extreme temperatures:towards genetic engineering for stress tolerance[J].Planta,2003,218:1 -14
[3]Zhang L,Xiao S,Li W,et al.Overexpression of a Harpin - encoding gene hrf1 in rice enhances drought tolerance[J].Journal of Experimental Botany,2011,doi:10.1093/jxb/err131
[4]Chomczynski P,Sacchi N.Single-step method of RNA isolation by acid guanidinium thiocyanate-phenol- chloroform extraction[J].Analytical Biochemistry,1987,162(1):156 -159
[5]Engler- Blum G,Meier M,Frank J,et al.Reduction of background problems in nonradioactive Northern and Southern blot analyses enables higher sensitivity than 32 P - based hybridizations[J].Analytical Biochemistry,1993,210(2):235 -244
[6]李合生.植物生理生化实验原理和技术[M].北京:高等教育出版社,2000.195-263
[7]德 英,赵来喜,穆怀彬.PEG6000渗透胁迫下应用电导法对披碱草属种质幼苗抗旱性初步研究[J].中国农学通报,2010,26(24):173-178
[8]Hong ZL,Lakkineni K,Zhang ZM,et al.Removal of feedback inhibition of D1-pyrroline-5-carboxylate synthetase results in increased proline accumulation and protection of plants from osmotic stress[J].Plant Physiology,2000,122:1129 -1136
[9]Gigon A,Matos A R,Laffray D,et al.Effect of Drought Stress on Lipid Metabolism in the Leaves of Arabidopsis thaliana(Ecotype Columbia)[J].Annals of botany,2004,94(2):345 -351
[10]陈 贵,胡文玉,谢甫绨,等.提取植物体内MDA的溶剂及MDA作为衰老指标的探讨[J].植物生理学通讯,1991,27(1):44-46
[11]Rizhsky L,Liang H,Mittler R.The water-water cycle is essential for chloroplast protection in the absence of stress[J].The Journal of Biological Chemistry,2003,278(40):38921 -38925
[12]Allen RD,Webb RP,Schake SA.Use of transgenic plants to study antioxidant defenses[J].Free Radical Biology and Medicine ,1997,23(3):473-479
[13]Oh CS,Beer SV.AtHIPM,an ortholog of the apple HrpN-interacting protein,is a negative regulator of plant growth and mediates the growth- enhancing effect of HrpN in Arabidopsis[J].Plant Physiology,2007,145:426 -436
[14]Floyd RA,Nagy I.Formation of long-lived hydroxyl free radical adducts of proline and hydroxyproline in a Fenton reaction[J].Biochimica et Biophysica Acta,1984,790(1):94 -97
[15]Attipalli R R,Kolluru V C,Munusamy V.Drought- induced responses of photosynthesis and antioxidant metalbolism in higher plants[J].Journal of Plant Physiology,2004,161(11):1189 -1202
[16]Van Breusegem F,Dat J F.Reactive Oxygen Species in Plant Cell Death [J].Plant Physiology,2006,141:384 -390
[17]沈振国,沈其荣,管红英,等.NaCl胁迫下氮素营养与大麦幼苗生长和离子平衡的关系[J].南京农业大学学报,1994,17(1):22-26
