悬铃木SSR反应体系建立及引物筛选
2012-07-16刘荣宁赵晓改赵振利范国强
刘荣宁,赵晓改,赵振利,范国强*
(1.河南农业大学,河南 郑州 450002;2.河南农业职业学院,河南 中牟 451450)
悬铃木具有耐修剪整形、生长迅速、隔离噪音、抗烟和抗尘的能力,特别对SO2、Cl2等有毒气体有较强的抗性,对城市环境有极强的适应能力,且有“行道树之王”的美称,故世界各国广为种植[1]。SSR标记技术目前已广泛用于基因定位、遗传作图、多态性分析、构建DNA指纹图谱等[1-7]各个领域。SSR标记虽具有试验程序简单、物种及染色体组特异性等优点,但因其扩增过程中有诸多因素的影响,也会产生非特异扩增等问题,从而给研究工作带来不便。目前,SSR 技术已在水稻[9]、玉米[10]、柑橘[11]、樱桃李[12]、泡桐[13]等标记研究中得以应用,但尚未见到有关悬铃木SSR体系建立的相关报道。本实验旨在通过筛选反应体系中各因素的最佳组合,并进行引物筛选检验,建立一套适合悬铃木基因组SSR-PCR扩增反应体系,并为基因定位及克隆研究奠定基础。
1 材料与方法
1.1 试验材料
河南农业大学泡桐研究所林木生物技术实验室在温度(25±2)℃,光强130 μmol·m-2·s-1,光照时间16 h·d-1的条件下,培养35 d的三球悬铃木(Platanus orientalis L.)健康组培苗。
1.2 试验方法
1.2.1 悬铃木基因组DNA的提取 取35 d组培苗的叶片,参照TIANGEN试剂盒说明书提取悬铃木基因组DNA,利用紫外分光光度计及琼脂糖凝胶电泳法检测所提取的DNA浓度和质量,置-20 ℃冰箱保存,用于PCR扩增。
1.2.2 SSR-PCR反应程序设定 SSR扩增程序:SSR-PCR扩增在Biometra扩增仪上进行。反应程序参照曹喜兵等[13]方法。
1.2.3 SSR-PCR基本反应体系 参照曹喜兵等[13]SSR反应体系建立。对影响PCR扩增结果的退火温度、dNTP和引物(5'GCC AGC GAA CTC AAA TCT与3'AAC GAG AAC GAC GAG CG)浓度,Taq酶用量,模板DNA浓度等参数进行梯度试验(表1)。当利用一种参数试验时,其它参数保持不变,以便筛选出5种参数的最佳组合,试验设3次重复。
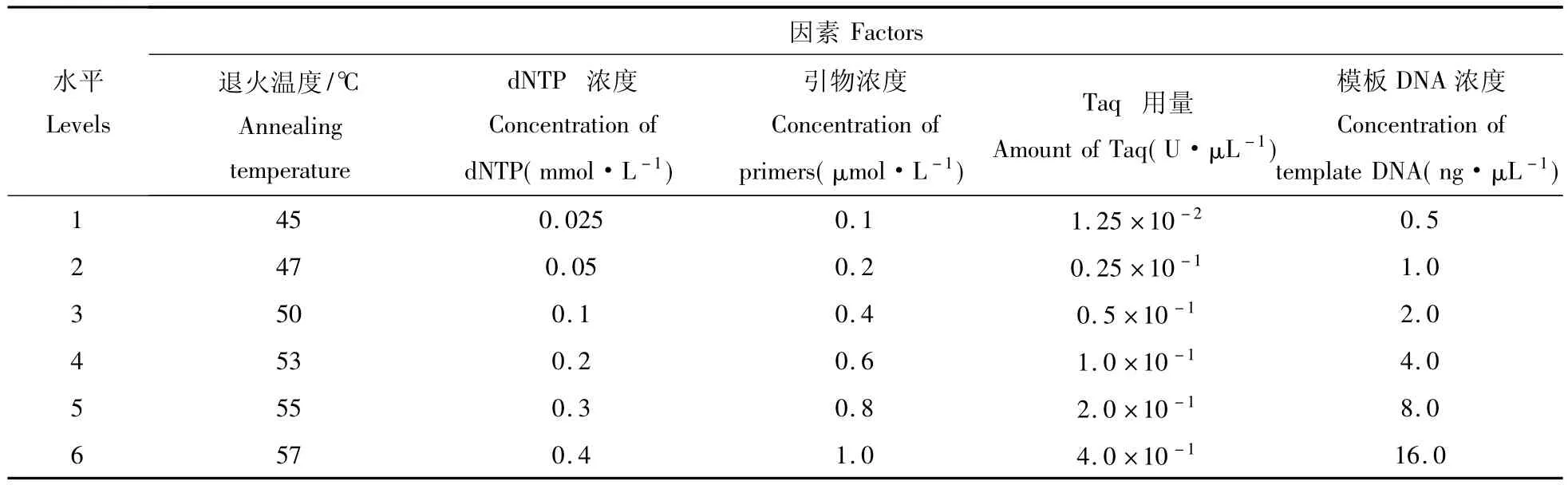
表1 PCR 反应体系中处理因素和水平Table 1 Factor and level of PCR reaction system
1.2.4 PCR产物的电泳及分析 PCR产物采用6%非变性聚丙烯酰胺凝胶电泳。20 μL PCR产物与5.5 μL 加样缓冲液(49 mL 甲酰胺、1 mL 0.5 mol·L EDTA、0.125 g溴酚蓝、0.125 g 二甲苯菁)混合,在95℃变性5 min后,放入4 ℃冰箱冷却待用。电泳时,每泳道上样量为5 μL扩增产物,电泳条件为60 W恒功率,电泳时间为30 min。电泳结束后,凝胶固定、银染、显影,并用UMAX PowerLook2100LX型扫描仪扫描凝胶。
1.2.5 引物筛选 参考常莉[14]从其它木本植物筛选出的417对微卫星引物,由郑州宝赛生物科技有限公司合成。
2 结果与分析
2.1 悬铃木SSR分子标记反应体系
2.1.1 不同退火温度对悬铃木SSR-PCR反应程序的影响 退火温度对SSR-PCR扩增结果(图1)可看出,不同退火温度对悬铃木SSR-PCR扩增产物量影响不同。当退火温度为45、47、50℃时,SSR-PCR扩增出的条带亮度逐渐明显增强;当退火温度为53、55、57℃时,扩增产物电泳条带逐渐减弱。当SSRPCR扩增引物一定时,悬铃木扩增产物量随退火温度逐渐升高而增大,但当退火达到一定温度时,SSRPCR扩增量又随其温度的增高而下降,因此该研究认为针对引物对ORNL-97适宜的退火温度选择为50℃。同时针对不同的引物在进行SSR-PCR反应程序时可根据引物所标出的退火温度进行适当调整,才能达到理想的效果。
2.1.2 不同dNTP浓度对悬铃木SSR-PCR扩增的影响 不同dNTP浓度对悬铃木SSR扩增产物量产生了明显的影响。当 dNTP 浓度分别为0.025、0.05、0.1 和 0.2 mmol·L-1(泳道 1 -4)时,扩增产物电泳后均有谱带出现,但不同dNTP浓度扩增谱带的亮度强度存在着差异。其中,0.2 mmol·L-1扩增出的谱带亮度最强,0.1 mmol·L-1次之,0.05 mmol·L-1较弱,0.025 mmol·L-1最弱。当 dNTP 浓度为0.3 和0.4 mmol·L-1时,扩增产物电泳后逐渐减弱(泳道5和6)。意味着dNTP浓度过低降低SSR-PCR产物的产量,浓度过高又会抑制产物产生,本试验中,dNTP浓度为0.2 mmol·L-1时,SSR-PCR扩增的谱带最清晰,故选择0.2 mmol·L-1作为悬铃木SSR-PCR扩增的最适浓度。
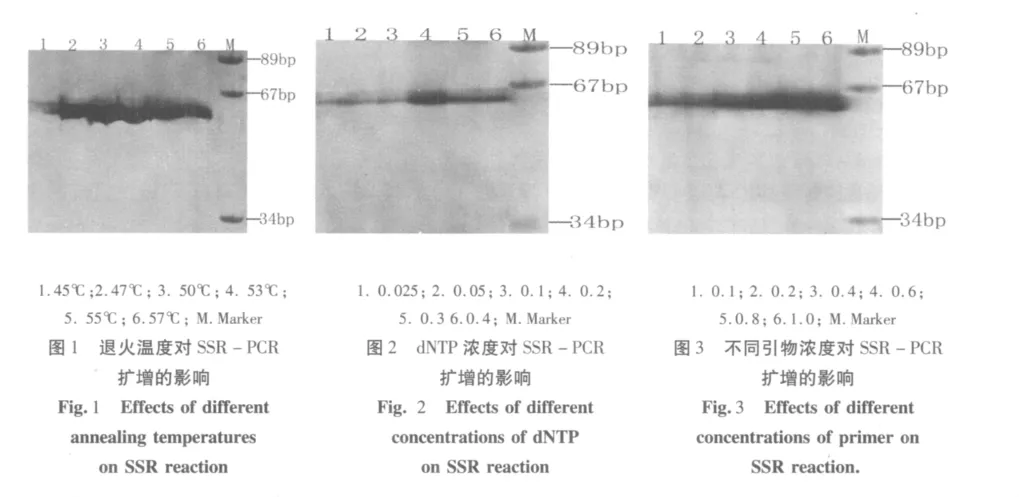
2.1.3 引物浓度对SSR-PCR扩增的影响 由引物浓度对SSR-PCR扩增结果(图3)可以看出,虽然不同引物浓度对SSR扩增产物量的影响不同,但是试验设置的6个浓度均可扩增出电泳谱带。当引物浓度为 0.1、0.2 和0.4 μmol·L-1时,扩增出的谱带明显增强(泳道 2、3 和 4),当浓度分别 0.6 μmol·L-1时,扩增结果最清楚,故选择0.6 μmol·L-1作为悬铃木SSR-PCR扩增的最适浓度。
2.1.4 悬铃木DNA浓度对SSR扩增的影响 不同浓度悬铃木DNA的SSR-PCR扩增结果(图4)表明,当悬铃木DNA为0.5ng·μL-1时,谱带亮度过低(泳道1),在一定范围内模板DNA浓度对泡桐SSR扩增结果影响不显著。虽然悬铃木DNA浓度由1.0升高到16.0 ng·μL-1,但其SSR扩增出的电泳谱带亮度差异不大。因此,从扩增产物的稳定性和节省模板用量等方面考虑,我们选择4.0 ng·μL-1悬铃木DNA作为其SSR-PCR扩增体系的适宜模板浓度。

2.1.5 Taq酶量对SSR扩增的影响 由不同Taq酶量对SSR-PCR扩增结果(图5)的影响可以看出,不同Taq酶量对泡桐SSR扩增产物量产生了较为显著的影响。在SSR-PCR扩增反应体系中,在一定范围内随着Taq酶量的逐渐增加,其扩增产物量也逐渐增大,之后,随着Taq酶量的增加,谱带亮度和清晰度逐渐降低。在SSR-PCR扩增体系中,我们选用0.05U·μL-1为悬铃木SSR-PCR扩增体系的最适Taq酶量。
2.2 引物筛选
根据上述优化体系,从其它木本植物的417对SSR引物中筛选出适合悬铃木SSR扩增的54对引物(表2)。结果表明,选出的54对引物,所扩增的谱带清晰、分辨率高、重现性好、多态性强,是较适宜的扩增体系(图6)。

表2 悬铃木SSR扩增引物Table 2 Primers used in the SSR-PCR of the plant

引物编号Primer Codes核苷酸序列(5’---3’)Nucleotide sequences(5’- - -3’)备注References引物编号Primer Codes核苷酸序列(5’---3’)Nucleotide sequences(5’- - -3’)备注References 19 CGG AGG GTG TGC TGC CGA AGGCC CAG CCC ATA TCT GCT [18] 46 TTC ATC CTA GCT GCT TGC TTTCTC AGC GTC TAC CCC ATC AA [23]20 TAT TTC TAC AAC ATA CCA AAA CGCAT TAC TCA AGC ACA TGC ACG C [23] 47 CTT GTT GCT GCT TCT GCAAC AAA ATA ATA TAA ATG CTC TGC [23]21 CAT CCA TGA TAT CAA ACC AAA TTA GTGT AAT CCA AAC ATA AAA TCC CAA G [23] 48 CAC GGC CCT TAG CTT TAC CTTTTC TGA TGG GGC AAC TG [23]22 ACC TCA ATC ATC ATC ACC ATC TTGCG CTG AAA TGA TCA TAA TGT AG [23] 49 TTG GGC GCC TCT TGC TCG TCT TCAAGC ATG CGT GGT GGT CTC GTC AGC [23]23 TGT ATC CCC TCC TCG GAT AAGGC ATT AAT GGA TGA TGA TGA [24] 50 AGG CCG AGC AAG ATG ACG ACG ATACGT TCG ACA GCG GCT CTT CAA AAG [23],24 AAT TAA CTC CAA CAG CTC CAATG GTT GCT TAA TTC AAT GG [24] 51 GAC GAC ATG ACG AGG GAG GAAGCA CTA TGG GCG CAC TAC ACA [23],25 AAG CAA AGT CCA TAA AAA CGCGGA CGA AGA CGC TCC ATT [25] 52 CCT GCA AGG GTA TTT GGG TTT ACGTTC GTT GGC CCC AAA TAC TTC AAT [23],26 TGC AGG TGA TGT CAT CAC CGAAC CGA ATC CAT GCG TCA CC [23] 53 ATT TAG TTA TGA TCT GGT TTT TAAG CTA TTA TAA TCA TTT CTC ACA [23],27 ACG TAT ATG AAG TTC TTG ATT GCGAC AGA TCA TTA TGA TTA CTA CAG [23] 54 TTT GGC AAA AGA ACA TTG AGA TATA TTG GTA TTA GTT GAA GTT [23],

图6 悬铃木54对引物的SSR扩增图Fig.6 Gel electrophoresis of the SSR products with 54 pairs of the plant
3 结论与讨论
SSR-PCR标记具有多态性高、试验重复性好和共显性遗传的特点,虽然广泛用于农作物品种鉴定、遗传作图、基因定位、植物分类和进化及遗传多样性[2-13]等方面,但对于不同植物SSR标记的技术体系有所不同。该试验采用了先构建基本反应体系,再在基本反应体系中进行单因素梯度优化试验的方法,既节约了成本,又有的放矢的针对每一个因素。本实验对影响SSR扩增效果的退火温度等5个参数的筛选,建立的最适悬铃木SSR-PCR扩增体系为,20 μL的反应体系中,包括悬铃木4.0ng·μL-1DNA,0.2 mmol·L-1dNTP,0.6μmol·L-1引物,0.05 U·μL-1Taq 酶,退火温度为 50 ℃。
影响PCR扩增效果的因素多种多样,引物退火温度就是其中之一[1-14]。在利用SSR分子标记技术开展新植物DNA碱基序列变化研究中,需要进行大量的引物筛选工作。虽然每对引物都有其理论的退火温度,但是适宜的理论退火温度不能得到理想的扩增效果。通用SSR-PCR扩增需要对每一对引物进行适宜退火温度的筛选[1-14,16],工作单调而繁重。因此,本试验采用TD-PCR技术建立起来的悬铃木SSR-PCR分子标记反应体系可以在悬铃木相关研究中兼顾大部分引物对退火温度的要求,使引物筛选工作能够快速准确的进行,从而避免烦琐引物退火温度的筛选工作。至于该反应体系在悬铃木现代生物技术研究中的应用情况将在后续的论文内给予报道。
[1]周业恒,江守和,鲁润龙,等.悬铃木无球果育种的研究[J].园艺学报,1993,20(3):295-298
[2]Zanel,Bargellonitl.Tarnelloegies for microsatellite isolation:a review[J].Molecular Ecology,2002,11:1 -16
[3]Wolfe A D,Xiang Q Y,Kephart S R.Assessing hybridization in natural populations of Penstemon(Scrophulariaceae)using hyper variable inter- simple sequence repeat(ISSR)bands[J].Mol Ecol,1998,7(9):1107 -1125
[4]Lian C L,Zhou Z H,Hogestu T Z.A simple method for developing microsatellite markers using amplified fragments of inter-simple sequence repeat(ISSR) [J].J Plant Res,2001,114:381-385
[5]Culley T M,Wolfe A D.Population genetic structure of the cleistogamous plant species Viola pubescens Aiton(Violaceae),as indicated by all enzymes and ISSR molecular markers[J].Heredity,2001,86:545 -556
[6]Sankar A A,Moore G A.Evaluation of inter-simple sequence repeat analysis for mapping in Citrus and extension of the genetic linkage map[J].Theor Appl Genet,2001,102:206 -214
[7]Weisin K,Atkinsion,Gardner R C.Genomic finger printing by microsatellite- primed PCR:a critical evaluation[J].PCR Methods Appl,1995,4(5):249-255
[8]Joshi S P,Gupta V S,Aggarwal R K,et al.Genetic diversity and phylogenetic relationship as revealed by inter simple sequence repeat(ISSR)polymorphism in the genus Oryza[J].Theor Appl Genet,2000,100:1311 -1320
[9]Wu K S,Tanksley S D.Abundance polymorphisms and genetic mapping of microsatellites in rice[J].Mole Gen Genet,1993,241:2325 -2351
[10]Blairm W,Panaud O,Mccouch S R.Inter-simple sequence repeat(ISSR)amplification for analysis of microsatellite motif frequency and finger printing in rice(Oryza sativa L.) [J].Theor Appl Genet,1999,98:780 -792
[11]姚利华,膝元文.EST-SSR标记及其在果树研究中的应用[J].果树学报,2008,25(2):219-224
[12]李 芳,周 龙,胡建芳.新疆野生樱桃李SSR体系的建立及应用[J].北方园艺,2010,(13):120-123
[13]曹喜兵,范国强,张延召.泡桐SSR分子标记反应体系的建立[J].河南农业大学学报,2009,8(4):368-371
[14]常 莉.利福平处理患丛枝病泡桐幼苗的SSR分析[D].南京:南京林业大学硕士生论文,2008
[15]张 静.利用SSR分子标记研究山杨杂种无性系的遗传多样性[D].沈阳:东北林业大学硕士学位论文,2003
[16]Yamamoto T,Mmum T,Sawamur A,et al.Simple sequence repeats far genetic analysis in pear[J].Euphytica,2002,124:129 -137
[17]Gianfranceschi L,Seglias A N,Tarchini R,et al.Simple sequence repeats for the genetic analysis of apple[J].Theor Apple Genet,2003,107:1315-1320
[18]Liebhard R,Gianfranceschi L,Koller B,et al.Development and characterization of 140 new microsatellites in apple(Malus domestics Borkh)[J].Mol Breed,2002,10:217-241
[19]赵阿风.马尾松无性系指纹图谱构建[D].南京:南京林业大学硕士学位论文,2005
[20]Tuskan G A,Gunter L E,Yang Z M,et al.Characterization of microsatellites revealed by genomic sequencing of Populus trichocarpa[J].Canadian Journal of Forest Research,2004,34:85 -93
[21]刘晓丽.核桃SSR反应体系的优化及群体遗传多样性分析[D].泰安:山东农业大学硕士学位论文,2007
[22]Fu X X,Shijisen.Identification of seeds of Pinus species by microsatellite markers[J].Journal of Forestry Research,2005,16(4):281-284
[23]沈永宝.中国栗属特有种遗传多样性及木本植物种和品种DNA分子鉴定研究[D].南京:南京林业大学博士论文,2002
[24]Aranza M.J,Garcia - mas J,Carbo J.Development and variability analysis of microsatellite markers in peach [J].Plant Breeding,2002,121:87-92
[25]Dirlewanger E,Cosson P,Tavaud M,et al.Development of microsatellite markers in peach(Prunus persica L.)Batsch and their use in genetic diversity analysis in peach and sweet cherry(Prunus avium L.) [J].Theor Appl Genet,2002,105:127 -138
[26]梁海永,刘彩霞,刘兴菊.杨树品种的SSR分析及鉴[J].河北农业大学学报,2005,28,(4):27-31
[27]Saghali M A,Biyashev R M,Yang G P,et al.Extraordinarily polymorphic microsatellite DNA in barley Species diversity,chromosomal locations,and population dynamics[J].Proc Natl Acad Scf,1994,91:5466 -5470
[28]艾呈祥,余贤美,张力思.中国部分板栗品种的SSR标记[J].农业生物技术学报,2007,15(2):283-289
[29]Szewc-mcfadden A K,Kresovich Sbliek S M,et al.Identification of polymorphic,conserved simple sequence repeats(SSRs)in cultivated Brassica species[J].Theor.Appl.Genet,1996,93(4):534 -538
