基质金属蛋白酶-1 shRNA 真核表达载体的构建
2012-07-16朱秀丽朱晓英郭青玉温德升吴军正
朱秀丽,朱晓英,郭青玉,王 静,温德升,吴军正
腺样囊性癌(adenoid cystic carcinoma,ACC)是涎腺最常见的恶性肿瘤之一,约占30%,易发生远处转移,主要发生在肺部。肿瘤细胞的转移是恶性肿瘤的本质表现,MMP-1 是MMPs 家族中表达最高的降解纤维胶原的间质胶原酶,许多肿瘤组织中有MMP-1 的过表达,其表达与侵袭转移及不良预后相关。本研究利用基因克隆技术构建人MMP1 RNA 干扰表达载体,并试验性转染人涎腺腺样囊性癌高转移性ACC-M 细胞株,验证其对MMP1 的沉默作用,为进一步研究MMP1 对肿瘤细胞转移的影响以及MMP1 特异性shRNA 真核表达载体的基因治疗奠定基础。
1 材料和方法
1.1 主要试剂 DNA Marker DL2000、T4 连接酶和限制性内切酶BglⅡ、EcoRⅠ、HindⅢ(Takara 公司,日本);TOP10 大肠杆菌(第四军医大学口腔医院口腔生物教研室保存);质粒抽提试剂盒和胶回收试剂盒(Omega 公司,美国);LipofectamineTM2000 和Trizol(Invitrogen 公司,美国);RevertAidTM First Strand cDNA Synthesis kit(MBI Fermentas 公司,立陶宛),MMP-1 山羊抗人多克隆抗体(Santa Cruz 公司,美国);FITC 标记的山羊抗兔抗体(博士德,中国武汉);辣根过氧化物酶标记兔抗山羊IgG 和DAB显色试剂盒(北京中杉公司);ECL 化学发光检测试剂盒(Santa Cruz 公司,美国)。
1.2 质粒和细胞 pWH1 真核表达载体由第四军医大学生化教研室吴元明构建并惠赠,全长336 bp,具kana/neo 抗性。要表达的shRNA 插入到BglII 和HindIII 之间。人涎腺腺样囊性癌细胞系ACC-2及其肺高转移株ACC-M 由上海第二医科大学附属第九人民医院口腔颌面外科肿瘤生物实验室建立并惠赠,常规培养于100 ml/L 胎牛血清的RPMI1640 培养液,置37 ℃,50 ml/L CO2培养箱中。
1.3 引物的设计与合成 以人MMP-1 cDNA 基因(Genebank ID:NM-002421)序列中的103-121核苷酸为标靶设计两条引物,由上海Sangon 公司合成。序列为:P1:5'-GATCCCCTGTTCTGGGGTGTGGTGTCttcaagagaGACACCACACCCCAGAACATTTTTGG AAA-3' P2:5'-AGCTTTTCCAAAAATGTTCTGGGGTGTGGTGTCtctcttgaaGACACCACACCCCAGAAC AGGG-3'。
1. 4 构建针对人MMP-1 基因的shRNA 表达载体pWH1-MMP1
1.4.1 引物处理 将上述引物用TE(pH 8.0)稀释成0.05 nmol/ml,-20 ℃保存。
1.4.2 酶切 用限制性内切酶BglⅡ和HindⅢ对质粒pWH1 做双酶切。用胶回收试剂盒回收pWH1质粒片段。
1.4.3 连接 反应体系为pWH1 质粒片段4 μl,退火产物4 μl,T4 连接酶1 μl,T4 连接酶buffer 1 μl。16 ℃连接过夜。
1.4.4 转化 将连接产物转化大肠杆菌TOP10 感受态细胞,铺于LB Kana ﹢平板上,37 ℃培养24 h。挑取单克隆并提取质粒。
1.4.5 酶切鉴定 用限制性内切酶EcoR Ⅰ和HindⅢ对候选阳性克隆质粒做双酶切鉴定,阳性克隆质粒命名为pWH1-MMP1。
1.5 转染 对数生长期ACC-M 细胞接种于6 孔培养板,待细胞长满底面约80%时转染细胞。分为3 组:(1)实验组,转染pWH1-MMP1 质粒;(2)空载体组,转染pWH1 质粒;(3)对照组,未转染。转染步骤按LipofectamineTM2000 说明书进行。
1.6 RT-PCR 鉴定细胞MMP1 mRNA 的表达 按照TRIzol®试剂说明书步骤提取实验组、空载体组和对照组细胞总RNA,溶于20 μl DEPC 水中。按照First Strand cDNA Synthesis kit 使用说明书反转录合成cDNA。以人β-actin 内对照进行PCR 反应,反应体系:cDNA 各1 μl,MMP1 和β-actin 的上游引物和下游引物各1 μl、MasterMix 12.5 μl、DEPC处理水补至反应体积25 μl。反应条件:95 ℃预变性1 min;94 ℃40 s、45 ℃40 s、72 ℃40 s,循环26次;7 ℃延伸10 min。取5 ml 反应液在12 g/L 琼脂糖凝胶电泳上进行扩增产物检测分析。引物由上海Sangon 公司合成,序列如下:
人β-actin 引物长度680 bp,sense:5'-ATACGCTGGGATGAGCACTGG,antisense:5'-TCTTTGCGGATGTCCACGTC。人MMP-1 引物长度331 bp,sense:5'-CATGCTTTTCAACCAGGCCC;antisense:5'-ATTCTGTCCCTGAACAGCCC。
1.7 免疫组化方法 制备对数生长期Mc3 细胞爬片,95% 乙醇固定后,0.2% TritonX-100 处理10 min,按SP 免疫组化试剂盒步骤系列处理,DAB 显色。空白对照以PBS 代替一抗。
1.8 Western blot 方法 应用单去污裂解法提取三组细胞总蛋白,Bradford 比色法进行定量后,取等量样本,收集蛋白。10% SDS-PAGE 蛋白电泳。转移至NC 膜后用山羊抗人MMP-1 蛋白抗体进行Western 杂交检测。
1.9 统计学处理 采用SPSS15.0 软件,计量资料采用±s 表示,关于灰度值各组之间的比较采用方差分析,P <0.05 为差异有统计学意义。
2 结果
2.1 pWH1-MMP1 的酶切鉴定结果 用EcoRⅠ和HindⅢ对pWH1-MMP1 进行双酶切鉴定,阳性克隆切下约310 bp 片段,阴性克隆切下约250 bp 片段(图1)。
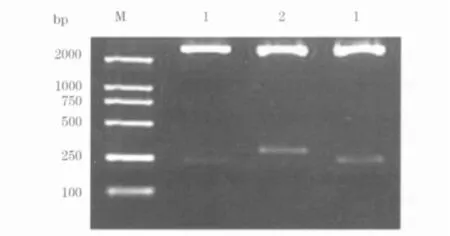
图1 pWH1-MMP1 质粒的酶切鉴定
2.2 RT-PCR 结果 三组细胞的内参对照物β-actin mRNA 的条带无明显差别,而实验组MMP1 条带的亮度明显低于空载体组和对照组,这提示MMP1 mRNA 在实验组细胞中的表达明显降低(图2)。
2.3 免疫组织化学法检测MMP-1 蛋白结果 结果显示,ACC-M 细胞和转染pWH1 胞浆区颗粒状棕黄色着色深而明显,转染pWH1-MMP1 的细胞胞浆区着色淡而浅。每组染色结果随机抽取50 个细胞,采用病理图像分析系统4.0 软件进行灰度值检测,ACC-M 细胞、转染pWH1 的ACC-M 细胞和转染pWH1-MMP1 的ACC-M 细胞胞浆灰度值分别为180.04±11.52、179.24 ±13.25 和120.85 ±12.16(P<0.01),可以看出,RNA 干涉后和亲本细胞ACC-M相比MMP-1 基因的表达水平明显下降(图3)。
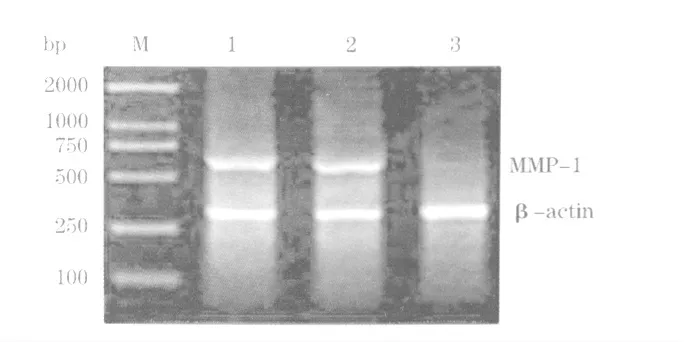
图2 pWH1-MMP1 稳定转染ACC-M 细胞后的RT-PCR 结果

图3 pWH1-MMP1 稳定转染ACC-M 细胞的免疫组化结果
2.4 Western blot 检测MMP-1 蛋白结果 在预期大小位置(57ku)处实验组MMP-1 蛋白表达水平明显低于对照组(图4)。

图4 pWH1-MMP1 稳定转染ACC-M细胞的western blot 结果
3 讨论
在基质金属蛋白酶家族中,MMP-1 是表达最高的降解纤维胶原的间质胶原酶,许多肿瘤组织中有MMP-1 的过表达,其表达与侵袭转移和不良预后相关[1,2]。
Toruner 等[3]应用Affymetrix Hu133A 基因芯片检测了口腔鳞状细胞癌组织的基因表达,发现33 个上调基因,MMP-1 是其中之一,并经RT-PCR 得到验证。Bendardaf 等[4]应用免疫组化法检测了直肠癌中MMP-1 的表达,发现MMP-1 表达低的存活率高。Yamashita 等[5]研究了51 例食管癌,其中94.1%有MMP-1 mRNA 的表达,而在正常黏膜组织中却未检测到MMP-1 的表达,其研究结果提示MMP-1 参与肿瘤侵袭过程,与不良预后有关。Ito等[6]在研究MMP-1 与人胰腺导管腺癌的关系时发现,46 个胰腺癌病例中,72%MMP-1 蛋白染色阳性,原位杂交确认了MMP-1 mRNA 在胰腺癌中的表达,Ito 还检测了2 个胰腺癌细胞系MMP-1 的mRNA 水平,发现MMP-1 阳性患者预后明显不如MMP-1 阴性患者。Inoue 等[7]对103 例胃肠癌病例的研究发现,75.2%MMP-1 表达阳性,其表达与腹膜和淋巴转移显著相关,MMP-1 阳性患者预后不良。Boire 等[8]确定出一种能够与特殊的蛋白酶活化受体(PAR1,与肿瘤侵袭转移相关)反应的酶,即MMP-1,它能够作为分子剪刀活化PAR1,从而刺激癌细胞的入侵和肿瘤的生长。
RNA 干涉(RNAi)技术能够沉默靶基因,具有高度的特异性和高效性,用于多种基因功能的研究、肿瘤的试验性治疗等多项领域[9-12]。本课题组前期研究发现,在高转移的人腺样囊性癌ACC-M 细胞系中发现有高水平的MMP1 基因表达[13],因此考虑MMP1 可能对人腺样囊性癌生物学行为发挥重要的作用。在此基础上,本研究根据siRNA 设计原则,设计合成了MMP-1 shRNA;利用RNAi 质粒pWH1 成功构建了真核表达载体pWH1-MMP1;确立了G418 筛选工作浓度为600 μg/ml;脂质体法转染pWH1-MMP1 到ACC-M 细胞,经G418 筛选,获得稳定转染pWH1 和pWH1-MMP1 的ACC-M细胞。
RT-PCR 鉴定了稳定转染后ACC-M 细胞MMP-1 的表达情况,发现稳定转染的ACC-M 细胞MMP-1 mRNA 几乎不表达。提示所设计的MMP-1 shRNA 符合设计要求,具有靶向特异性,达到了抑制靶基因的效果。
免疫组化法和Western blot 对稳定转染细胞ACC-M 中MMP-1 蛋白表达水平的检测进一步证实了MMP-1 shRNA 经pWH1 载体导入ACC-M细胞后能有效发挥RNAi 的靶基因沉默效应,即特异阻断了MMP-1 在SACC 肺高转移细胞株ACCM 中的表达。
RNAi 技术成功地沉默了MMP-1 基因在ACC-M 细胞中的表达,鉴于MMP-1 基因与肿瘤发生发展的相关性,这一结果为进行以MMP-1 基因为靶点的抗肿瘤研究建立了初步的实验模型。这为进一步研究MMP1 对腺样囊性癌以及其他肿瘤的生物学特性的影响,实验性治疗腺样囊性癌以及其他肿瘤奠定了基础。
[1] Sunami E,Tsuno N,Osada T,et al. MMP-1 is a prognostic marker for hematogenous metastasis of colorectal cancer[J]. Oncologist,2000,5(2):108-114.
[2] Jordan R C,Macabeo-Ong M,Shiboski C H,et al.Overexpression of matrix metalloproteinase-1 and-9 mRNA is associated with progression of oral dysplasia to cancer[J]. Clin Cancer Res,2004,10(19):6460-6465.
[3] Toruner G A,Ulger C,Alkan M,et al. Association between gene expression profile and tumor invasion in oral squamous cell carcinoma[J]. Cancer Genet Cytogenet,2004,154(1):27-35.
[4] Bendardaf R,Lamlum H,Vihinen P,et al. Low collagenase-1 (MMP-1)and MT1-MMP expression levels are favourable survival markers in advanced colorectal carcinoma[J]. Oncology,2003,65(4):337-346.
[5] Yamashita K,Mori M,Kataoka A,et al.The clinical significance of MMP-1 expression in oesophageal carcinoma[J]. Br J Cancer,2001,84(2):276-282.
[6] Ito T,Ito M,Shiozawa J,et al. Expression of the MMP- 1 in human pancreatic carcinoma:relationship with prognostic factor[J]. Mod Pathol,1999,12(7):669-674.
[7] Inoue T,Yashiro M,Nishimura S,et al. Matrix metalloproteinase-1 expression is a prognostic factor for patients with advanced gastric cancer[J]. Int J Mol Med,1999,4(1):73-77.
[8] Boire A,Covic L A,Agarwal A,et al. PAR1 is a matrix metalloprotese-1 receptor that promotes invasion and tumorigenesis of breast cancer[J]. Cell,2005,120(3):303-313.
[9] Lum L,Beachy P A. The Hedgehog response network:sensors,switches,and routers[J]. Science,2004,304(5678):1755-1759.
[10] Liu L T,Chang H C,Chiang L C,et al. Histone deacetylase inhibitor up-regulates RECK to inhibit MMP-2 activation and cancer cell invasion[J]. Cancer Res,2003,63(12):3069-3072.
[11] Lima R T,Martins L M,Guimaraes J E,et al. Specific downregulation of bcl-2 and xIAP by RNAi enhances the effects of chemotherapeutic agents in MCF-7 human breast cancer cells[J]. Cancer Gene Ther,2004,11(5):309-316.
[12] Berns K,Hijmans E M,Mullenders J,et al. A largescale RNAi screen in human cells identifies new components of the p53 pathway [J]. Nature,2004,428(6981):431-437.
[13] 朱秀丽,吴军正,温德升,等. 基因表达谱芯片技术筛选涎腺腺样囊性癌转移相关基因[J]. 实用口腔医学杂志,2006,22(4):512-516.
