猪流感病毒的分离鉴定及生物学特性研究
2012-07-14赵保才岳耀辉马超锋张龙现
刘 琨,张 云,赵保才,胡 慧,黄 磊,岳耀辉,马超锋,张龙现
(1.信阳市动物疾病预防控制中心,河南信阳464000;2.河南农业大学牧医工程学院,河南郑州450002;3.河南省出入境检验检疫局,河南 郑 州450002)
猪流感(Swine influenza,SI)是由猪流感病毒(Swine influenza virus,SIV)引起的一种急性、高度接触性呼吸道传染病,其临床特点为突发高热,流鼻涕,呼吸困难,咳嗽和体重下降[1].该病除直接影响猪的自身抵抗力和生产性能外,还会引起妊娠母猪的流产和死产.同时猪流感还会继发其他病毒和细菌感染,造成更加严重的经济损失[2,3].另外,自然条件下经常发生禽和人流感病毒传播给猪的事件,而SIV也可反传给禽和人,因此具有重大的公共卫生意义[4,5].有关猪流感病毒的研究已有较多报道[6~13].河南是中国养猪大省,为了解河南省猪流感的流行概况,本研究在2009—2010年对河南省多个地区展开了猪流感流行病学调查,并对所获得的分离株进行了亚型鉴定及生物学特性研究,以期为河南省乃至华北地区猪流感的防治提供依据.
1 材料与方法
1.1 材料
1.1.1 样品采集 采自河南新乡、漯河、信阳、商丘等地区的疑似因猪流感死亡猪肺脏样品63份.1.1.2 血清、细胞和试验动物 抗鸡新城疫(ND)阳性血清和犬肾传代细胞(MDCK)由河南农业大学微生物学实验室保存;非免疫鸡胚购自新乡原阳某孵化场;SPF鸡胚购自北京梅里亚维通实验动物技术有限公司.
1.1.3 主要仪器及试剂 智能孵化箱(山东翔宇孵化设备厂);DYY-Ⅲ超净工作台(苏净集团安泰公司);超速冷冻离心机(Thermo公司);PTC-200型PCR仪(美国MJ Reasearch公司);Trizol LS Reagent(Invitrogen);M-MLV反转录酶、RNase抑制剂、Premix EX Taq DNA聚合酶、LA Taq DNA聚合酶(TaKaRa宝生物工程有限公司);小量胶回收试剂盒(Omega公司);1%红细胞悬液;DMEM培养基;双抗溶液:注射用青霉素钠10 000 IU·mL-1(华北制药集团),注射用硫酸链霉素10 000 IU·mL-1(华北制药集团).
1.2 方法
1.2.1 SIV的分离与初步鉴定
1.2.1.1 病料处理 采集病死猪的肺脏组织在无菌条件下剪碎并研磨,用PBS液(含链霉素和青霉素终浓度为3 000 IU·mL-1)制成10%的匀浆,4℃作用5 h,反复冻融3次,4℃ 5 000 r·min-1离心4 min,取上清液备用.
1.2.1.2 鸡胚接种 将经上述方法处理的上清液经尿囊腔接种9日龄非免疫鸡胚,每枚0.2 mL,每个样品接种2枚,35℃条件下孵育96 h.每隔8 h照胚,弃去24 h内死亡鸡胚,收集24~96 h死亡和未死亡鸡胚置4℃过夜,次日无菌收集尿囊液.
1.2.1.3 红细胞凝集(HA)和血凝集抑制(HI)试验 根据《OIE诊断和疫苗标准操作指南》(OIE Standards Commission,2008) 常规微量法进行[6].
1.2.2 SIV的亚型鉴定及命名
1.2.2.1 引物设计及病毒RNA提取 反转录通用引物 Uni12:5’-AGC AAA AGC AGG-3’.PCR 扩增引物分为通用引物和亚型引物2种.其中通用引物和H9亚型引物基于NCBI收录的SIV序列采用Primer 5.0 自行设计,H1,H3,N1,N2 4 种亚型亚型引物参照CHOI等[4]的方法.引物均由上海英潍捷基公司合成,PAGE级纯化,-20℃保存备用.病毒RNA提取参照Invitrogen Trizol LS Reagent试剂盒操作说明进行.
1.2.2.2 病毒cDNA合成及PCR反应条件 反转录反应体系:按照反转录试剂盒(Takara)说明书进行,依次加入各成分后,混合均匀,42℃保温1 h,70℃保温15 min后冰上冷却备用.PCR反应条件:95℃预变性5 min,94℃变性30 s,50~55℃退火30 s,延伸72℃ 2 min,运行30个循环后于72℃延伸10 min.反应结束后取PCR产物5 μL,采用1%琼脂糖凝胶电泳鉴定.
1.2.2.3 SIV命名 根据世界卫生组织(WHO)公布的流感病毒通用命名规则进行命名,S1V分离株名称中包括型别(A,B,C),分离宿主的类别/分离地名称/毒株序号/分离年代(A型流感病毒还需标注HA及NA抗原亚型).
1.2.3 SIV有限稀释克隆 将SIV第4代鸡胚尿囊液进行10-2~10-8稀释.每个稀释度接种 SPF鸡胚后,病毒血凝价达到8log2或8log2以上的最高稀释度的鸡胚尿囊液,即为该SIV分离株的稀释克隆毒株.经无菌检验后用1.5 mL eppendorf分装,置-70℃保存备用.生物学特性研究部分所用流感病毒株均为已纯化的SIV稀释克隆毒株.
1.2.4 SIV 生物学特性研究
1.2.4.1 SIV红细胞凝集谱测定 用新鲜制备的鸡、猪、豚鼠、兔、小鼠、绵羊、牛等动物的1%红细胞悬液与新鲜收获的病毒液进行HA试验,测定红细胞凝集谱.
1.2.4.2 S1V血凝素热稳定试验 将新鲜收获的病毒液分装于1.5 mL eppendorf管,每管0.5 mL,置于 56 ℃ 水浴处理 0,5,10,15,30,60,90,120,150,180,210 min及过夜,处理后迅速放到4℃冰箱5~10 min,分别测其HA效价.
1.2.4.3 脂溶剂敏感性及耐酸性试验 参照等李玉萍等[7]方法,将经乙醚、氯仿、0.1 mol·L-1盐酸溶液及等量生理盐水处理过的病毒液分别接种3枚鸡胚,每枚0.2 mL,35℃孵育96 h,收集24~96 h内死亡或未死鸡胚尿囊液,测定HA效价.如处理组病毒液与对照组病毒液血凝价相差2个滴度以上,则判定病毒对其敏感.
1.2.4.4 鸡胚半数感染量(EID50)和鸡胚半数致死量(ELD50)试验 将新收获的病毒液用生理盐水液l0倍倍比稀释后,接种10日龄SPF鸡胚,每个稀释度接种5枚SPF鸡胚,每枚0.2 mL,并设生理盐水对照组,35℃孵育96 h.每隔6 h照胚1次,弃去24 h死亡的鸡胚,并统计鸡胚死亡数目.收获鸡胚尿囊液,测定HA效价.按Reed-Muench法计算 EID50和 ELD50[8].
1.2.4.5 细胞感染试验 将1 mL新鲜病毒液接种至单层MDCK细胞,在体积分数5%CO2,37℃条件下孵育7 d,定期观察细胞病变.
1.2.4.6 小鼠感染试验 将新鲜病毒液10倍倍比稀释,每一稀释度经滴鼻途径接种1月龄BALB/c小鼠4只,每只0.1 mL,并设生理盐水对照组.每天观察小鼠临床症状至感染后第14天.死亡小鼠采集内脏进行SIV分离鉴定.未死亡小鼠采集血清,进行HI试验.
2 结果与分析
2.1 SIV的分离与初步鉴定
病料上清液首次接种鸡胚后,96 h内无鸡胚死亡.盲传3代后,有3份尿囊液出现血凝性,HI检测表明其均与抗ND阳性血清为阴性反应.3份具有血凝性的尿囊液中的鸡胚胎存在不同程度的全身性出血.
2.2 SIV亚型鉴定及命名
2.2.1 通用引物及亚型引物RT-PCR对SIV鉴定结果 提取3株病毒RNA,用NP基因通用引物进行RT-PCR扩增,电泳结果显示扩增片段与预期片段大小相符,约为510 bp(图1).
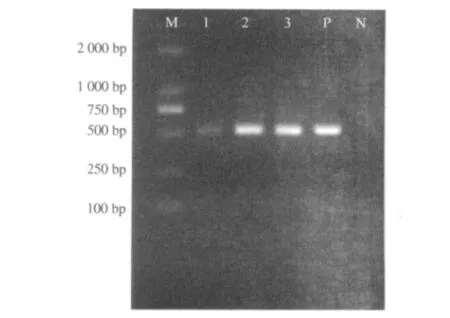
图1 SIV通用引物PCR产物电泳图Fig.1 Identification of products by universal primers of SIV
亚型引物 RT-PCR鉴定结果显示,3株毒株HA基因片段大小均约为1.0 kb,与H1亚型片段大小相符;NA基因片段大小约为500 bp,与N2亚型片段大小相符(图2).PCR产物测序结果进一步显示猪肺脏所获分离株为H1N2亚型SIV.
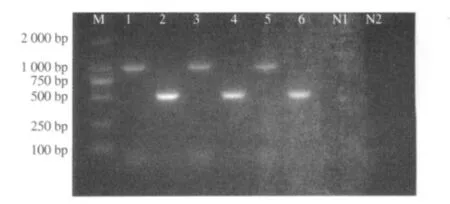
图2 SIV亚型引物PCR产物电泳图Fig.2 Identification of products by subtype primers of SIV
2.2.3 SIV的命名 根据WHO公布的流感病毒通用命名法则,将分离到的3株猪流感病毒统一命名(表1).
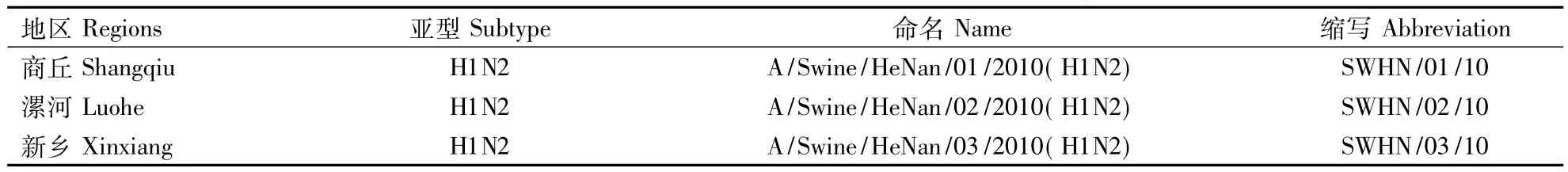
表1 猪肺脏中分离到的SIV命名Table 1 The names of SIV stains in the lung of pig
2.3 SIV生物学特性研究
2.3.1 病毒红细胞凝集谱 A/Swine/HeNan/01/2010(H1N2)和A/Swine/HeNan/02/2010(H1N2)对鸡、小鼠、豚鼠、兔、猪、绵羊和牛红细胞均具有凝集性;但A/Swine/HeNan/03/2010(H1N2)对猪和牛的红细胞无凝集活性(表2).
2.3.2 SIV血凝素热稳定性测定 A/Swine/HeNan/01/2010(H1N2)属于热稳定型,A/Swine/HeNan/03/2010(H1N2)属于中等热稳定型(表3).
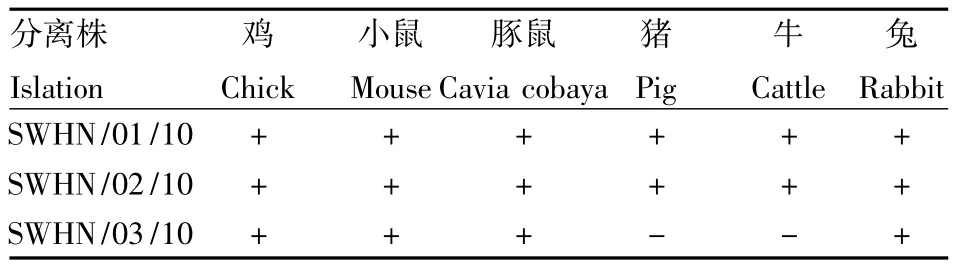
表2 3株SIV红细胞凝集谱Table 2 Heamagglutination spectrum of SIV strains in this study
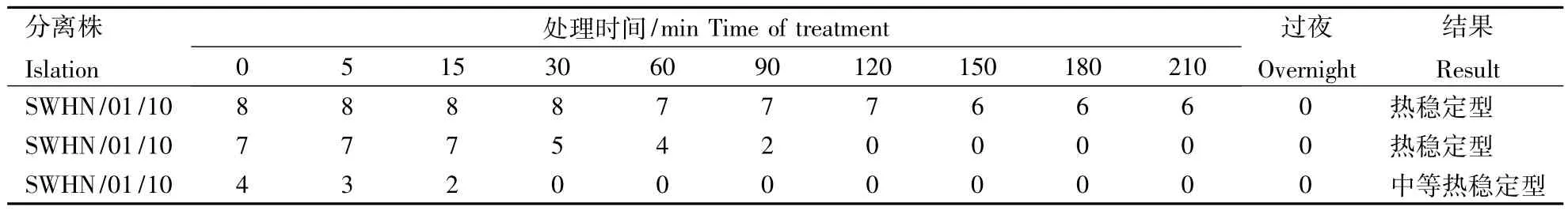
表3 SIV分离株血凝素热稳定性测定结果Table 3 The stability of HA of SIV strains
2.3.3 脂溶剂敏感性和耐酸性试验 将3株分离株按照上述方法经氯仿、乙醚和酸处理后,接种鸡胚,所收获的尿囊液均检测不到血凝价,说明3株分离株对氯仿、乙醚和酸敏感.
2.3.4 SIV分离株EID50和ELD50测定结果 根据Reed-Muench法,A/Swine/Henan/01/2010(H1N2)EID50=10-7.16,ELD50=10-6.54;A/Swine/Henan/02/2010(H1N2)EID50=10-5.86,ELD50=10-2.43;A/Swine/Henan/03/2010(H1N2)EID50=10-3.83,ELD50=10-2.67.
2.3.5 细胞感染试验 3株病毒株接种MDCK细胞后,均能感染细胞并造成细胞拉网脱落等病变.收集细胞液,血凝检测和RT-PCR结果显示,细胞液均具有血凝性,血凝价分别为1∶256,1∶32和1∶16.用NP通用引物进行RT-PCR扩增,结果显示扩增片段约为510 bp,与先前扩增片段大小相符.
2.3.6 小鼠感染试验 A/Swine/Henan/01/2010(H1N2),A/Swine/Henan/02/2010(H1N2),A/Swine/Henan/03/2010(H1N2)在接种小鼠14 d内,小鼠无明显临床症状、无死亡,对照组小鼠正常.剖检后未见明显病理变化,将小鼠肺脏研磨后接种鸡胚,收集的尿囊液无血凝性.小鼠血清与SIVHI试验为阴性结果.
3 小结与讨论
目前,世界范围内猪群中流行的SIV亚型主要有H1N1,H3N2 和 H1N2 3 种[9].对于河南地区,CONG等[10]从河南省有呼吸道症状的猪中分离到H9N2亚型SIV.段廷云[11]从河南地区猪场分离到1株H1N1亚型SIV,并建立了实时荧光定量PCR诊断方法.李春[12]从河南猪病料中分离到1株H1N1亚型流感病毒;赵朴等[13]对河南省5个不同猪场采集病料,分离到3株H3N2亚型SIV.本研究所分离的3株毒株均为H1N2亚型SIV,为首次报道证实在河南地区存在H1N2亚型SIV,该结果对河南省乃至中国的猪流感的防治和监测具有重要的指导意义.
病毒的有限稀释克隆纯化是为了防止没有血凝活性的病毒污染造成鸡胚的非正常死亡,以及排除生物学特性及分子生物学试验中的非特异性反应,因此本研究将分离到的3株SIV毒株进行有限稀释克隆法纯化.其中 A/Swine/Henan/03/2010(H1N2)进行多次有限稀释纯化后,其血凝价仍较低,其原因有待进一步研究.SIV血凝性具有重要的流行病学和生态学意义.A/Swine/Henan/01/2010(H1N2)和A/Swine/Henan/02/2010(H1N2)能够凝集鸡、小鼠、兔、猪、豚鼠、绵羊和牛的红细胞,A/Swine/Henan/03/2010(H1N2)不能凝集猪和牛的红细胞.SIV的血凝性易受温度影响,一般而言,热稳定型毒株在自然条件下存活能力相对较强,将有更多的机会通过不同途径在同一或不同宿主间传播.本研究结果显示A/Swine/Henan/01/2010(H1N2)和A/Swine/Henan/02/2010(H1N2)表现为热稳定型,A/Swine/Henan/03/2010(H1N2)为中等热稳定型.说明前两个毒株对自然条件的抵抗力较高,具有更大的危害性.
EID50和ELD50是反映SIV生物学特性最常考虑的2个指标,与毒株的致病力有一定的关系[8].本试验中毒株A/Swine/Henan/01/2010(H1N2)EID50较高,说明该分离株适应于鸡胚增殖,而A/Swine/Henan/03/2010(H1N2)较低,说明此毒株在鸡胚中不能很好的增殖,制作成疫苗较困难.A/Swine/Henan/01/2010(H1N2)ELD50较高,其对鸡胚有较高的致死性,说明该毒株对鸡胚的致病性较强.
小鼠感染试验中,3个毒株接种小鼠后,均未观察到明显临床症状,精神、采食和饮水均正常.剖检后未见明显病理变化.将小鼠肺脏研磨后接种鸡胚,收集的尿囊液无血凝性,说明SIV毒株未感染小鼠,推测毒株对小鼠无致病性.这与王连想等[8]报道的H1N1感染小鼠结果一致.而SHIN等[14]经鼻腔内接种法给6~8周龄 BALB/c小鼠接种H1N2,H3N1,H3N2不同亚型的 SIV,接种后小鼠均出现精神萎靡不振、畏寒、呼吸短促、被毛松乱等临床症状,并且能从肺脏中分离出病毒,这可能是由于不同亚型或分离株对小鼠的致病性不同造成的.
本试验从河南地区首次分离到3株H1N2亚型SIV毒株并阐述了其生物学特性,该结果对河南省猪群中SIV的防治具有一定的指导意义,而所获SIV分离株各基因片段来源及遗传演化分析等信息对则需进一步深入研究.
[1] CHOI C,HA S K,CHAE C.Detection and isolation ofH1N1 influenza virus from pigs in Korea[J].Vet Rec,2004,154(9):274-275.
[2] 徐利平,杨克礼,梁望旺,等.猪病混合感染对临床诊断的影响[J].安徽农业科学,2007,35(36):11847-11848.
[3] 蔡宝祥.家畜传染病学[M].北京:中国农业出版社,2001:5-6.
[4] CHOI Y K,GOYAL S M,KANG S W,et al.Detection and subtyping of swine influenza H1N1,H1N2 and H3N2 viruses in clinical samples using two multiplex RT-PCR assays[J].2002,102(1):53 -59.
[5] LEE M S,CHANG P C,SHIEN J H,et al.Identification and subtyping of avian influenza viruses by reverse transcripfion-PCR[J].2001,97(1):13 -22.
[6] 李海燕,辛晓光,于康震,等.猪流感病毒的分离与鉴定[J].中国预防兽医学报,2002,24(1):12-17.
[7] 李玉平,徐镔蕊,刘尚高.猪流感病毒的分离鉴定及特性测定[J].中国兽医杂志,2007,43(8):13-15.
[8] 王连想,毕英佐,曹永长等.猪流感病毒广东株的分离鉴定及其特性[J].中国兽医科技,2003,23(2):17- 21.
[9] BROWN I H.The epidemiology and evolution of influenza viruses in pigs[J].Vet Microbiol,2000,74(1):29-46.
[10] CONG Y L,WANG C F,YAN C M,et al.Swine infection with H9N2 influenza viruses in China in 2004[J].Virus Genes,2008,36(3):461 -469.
[11] 段廷云.H1N1亚型SIV河南株的分离鉴定、HA基因的克隆和序列分析及荧光定量PCR诊断方法的建立[D].郑州:河南农业大学,2006.
[12] 李 春.猪流感病毒的分离鉴定和猪流感血清流行病学调查[D].武汉:华中农业大学,2007.
[13] 赵 朴,郑玉姝,贾贝贝,等.猪流感病毒河南株的分离鉴定和生物学特性[J].华北农学报,2010,25(4):107-110.
[14] SHIN J Y,SONG M S,LEE E H,et al.Isolation and characterization of novel H3N1 swine influenza viruses from pigs with respiratory diseases in Korea[J].J Clin Microbiol,2006,44(11):3923 -3927.
