水杨酸对NaCl胁迫下抗虫棉幼苗生长和生理特性的影响
2012-07-14房卫平谢德意李伶俐马宗斌
朱 伟,房卫平,谢德意,李伶俐,马宗斌
(1.河南省农业科学院经济作物研究所,河南郑州450002;2.河南农业大学农学院,河南郑州450002)
棉花是耐盐性较强的作物之一,但土壤盐分过高对棉花生产仍有严重危害[1,2].随着转基因抗虫棉大面积推广,转基因抗虫棉的耐盐问题已被广泛关注,如何提高转基因抗虫棉的耐盐能力已成为棉花生产的重要课题之一[3,4].化学调控是提高作物耐盐性的有效措施之一[5].水杨酸(Salicylic acid,SA)是一种内源信号物质和新型的植物激素,可诱导植物产生抗病性、抗热性、耐寒性和抗旱性[6-9].对 SA 提高长春花[10]、黄瓜[11,12]、水稻[13,14]、玉米[15]、大麦[16]、小黑麦[17]、小麦[18]等抗盐能力已有研究,但抗虫棉方面上鲜有报道.因此,为了解SA在棉花抗盐性中的作用机制,本研究就SA对NaCl胁迫下抗虫棉幼苗生长和生理特性进行了研究,以期为盐碱地的抗虫棉生产提供有益信息.
1 材料与方法
1.1 试验材料
试验材料为转基因杂交抗虫棉豫杂35,由河南省农业科学院经济作物研究所提供.
1.2 幼苗培养与试验处理
用分析纯NaCl配制质量分数分别为30,60,90 g·kg-1的盐溶液,以蒸馏水为对照,将经硫酸脱绒后粒选的、饱满健康的棉花种子,用质量分数10%次氯酸钠浸泡10 min消毒,用蒸馏水洗净,经消毒处理后置于装有240 g沙土的培养皿(直径为12 cm),每皿50粒,分别加入30 mL不同质量分数的 NaCl溶液,然后分别加入0,0.2,0.4,0.6 mmol·L-1SA溶液,设蒸馏水处理作对照(CK),共16个处理,每个处理重复3次.而后在30℃恒温培养箱中培养.种子胚根突破种皮,长度达种子长度50%时计为发芽种子,第3天统计不同处理种子的发芽势,第7天统计不同处理种子的发芽率,相对盐害率/%=(对照发芽率-处理发芽率)/对照发芽率×100%.2周后调查棉花幼苗的苗高、单株鲜质量和干质量.
1.3 测定项目与方法
超氧化物歧化酶(SOD)活性测定用氮蓝四唑(NBT)法[19];过氧化物酶(POD)活性的测定用愈创木酚法[19];丙二醛含量的测定用硫代巴比妥酸(TBA)法[19];脯氨酸含量采用茚三酮法[19];相对电导率采用电导法[19].
1.4 数据统计分析
文中数据均由3次重复的平均值和标准误组成,采用LSD法对数据进行多重比较.
2 结果与分析
2.1 SA对NaCl胁迫下抗虫棉种子萌发和幼苗生长的影响
2.1.1 SA对NaCl胁迫下抗虫棉种子萌发的影响
由表1可以看出,随NaCl质量分数的增大,棉花种子的发芽率和发芽势呈下降趋势,表明NaCl质量分数越高,对棉子发芽势和发芽率的抑制作用越显著,相对盐害率越高.如在NaCl质量分数为90 g·kg-1时,种子的发芽率和发芽势分别是对照的51.6%和45.3%;相对盐害率为48.4%.但在同一NaCl质量分数下,用不同浓度的SA溶液处理后,棉花种子的发芽率和发芽势呈先上升后下降趋势.表明SA溶液在一定浓度范围内,对盐胁迫下抗虫棉种子发芽势和发芽率的抑制作用起缓解作用.
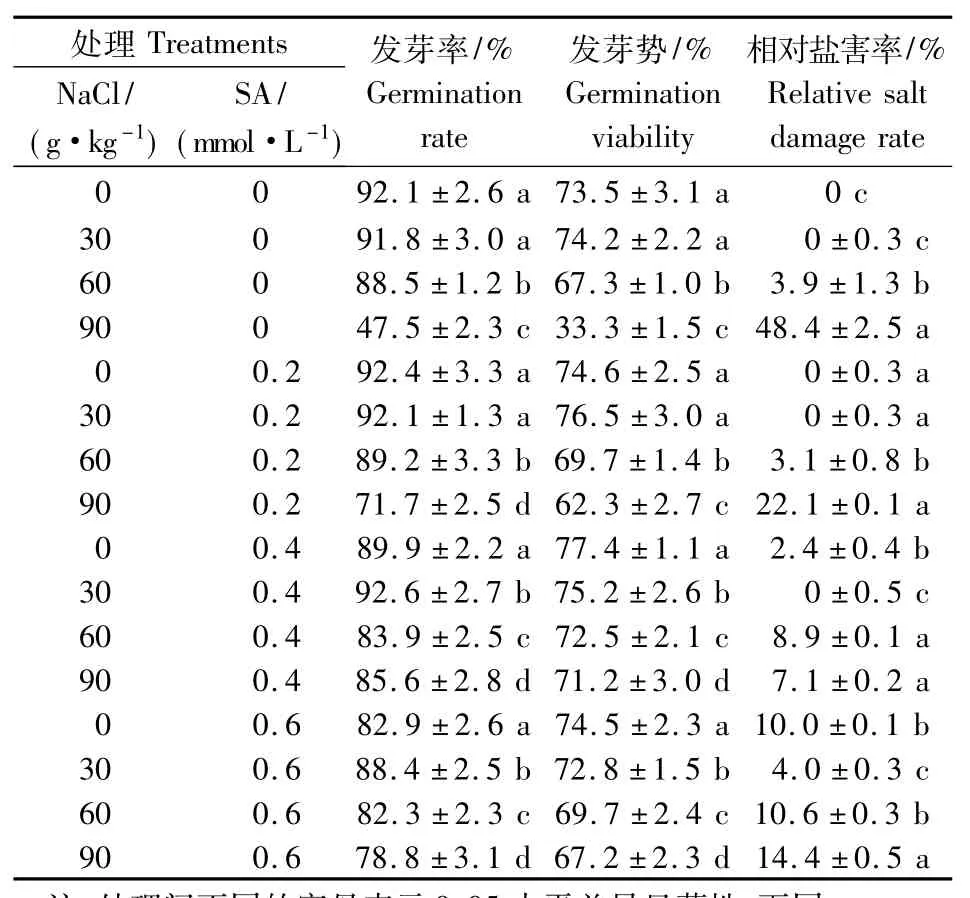
表1 SA对NaCl胁迫下抗虫棉种子萌发的影响Table 1 Effects of SA on germination of cotton seeds under different NaCl stress
2.1.2 SA对NaCl胁迫下抗虫棉幼苗生长的影响
由表2可知,受NaCl胁迫的影响,棉花幼苗生长缓慢,苗高降低.随盐分的升高,棉花干质量、鲜质量、地上部和地下部分干质量表现出相同趋势,即随盐的升高,干物质积累量减少.在NaCl质量分数较低条件下,与对照相比,地上部和地下部干质量没有显著性差异.但是,随NaCl质量分数的升高,地上部和地下部干质量显著降低.表明高盐分含量对棉花干质量的影响较大.
在同一NaCl质量分数胁迫下,不同浓度的SA对棉花干质量、鲜质量、地上部和地下部干质量有较大影响.用不同浓度的SA溶液处理后,棉花干质量、鲜质量、地上部和地下部分干质量均较同一盐量下无SA溶液处理有所增加,但总趋势随SA溶液浓度的升高,表现先升高后降低的趋势.说明SA对盐胁迫有一定的缓解作用,在一定范围内,缓解作用逐渐升高,浓度再增加时,缓解作用减弱.如在90 g·kg-1NaCl溶液胁迫下,棉花幼苗的生长受到了严重抑制,不同浓度的SA对幼苗的生长均有明显的提高.各处理相比,0.4 mmol·L-1SA 对NaCl胁迫下幼苗的恢复效果最好,如棉花苗高、鲜质量、干质量、地上部和地下部干质量分别较单独NaCl胁迫下提高 45.5%,155.3%,90.7%,114.4%和73.7%,差异均达显著水平.SA对NaCl胁迫下棉花种子萌发恢复效果的SA浓度排序是0.4 >0.6 >0.2 mmol·L-1.
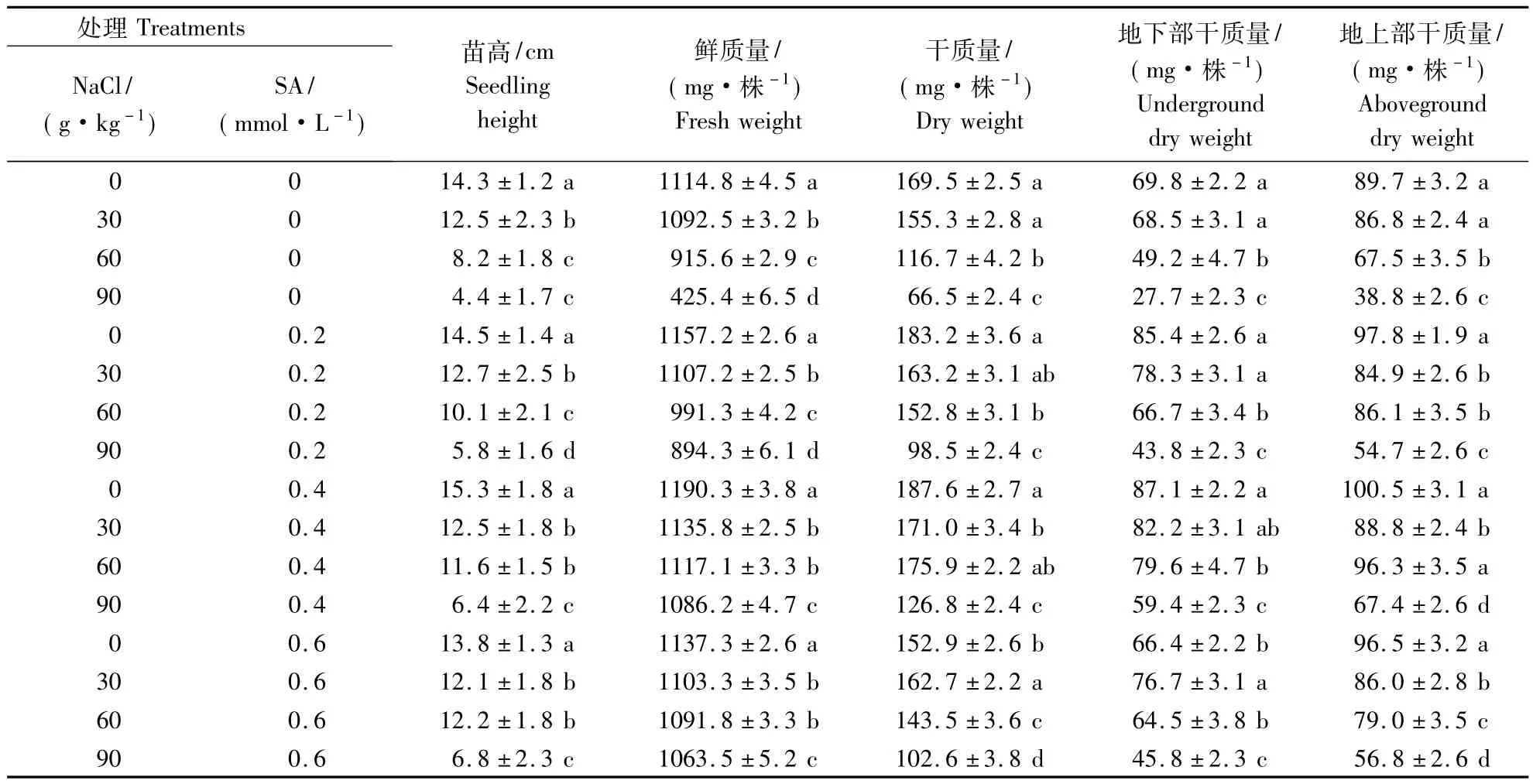
表2 SA对NaCl胁迫下抗虫棉幼苗生长的影响Table 2 Effects of SA on growth of cotton seedlings under different NaCl stress
2.2 SA对NaCl胁迫下抗虫棉幼苗生理特性的影响
2.2.1 SA对 NaCl胁迫下抗虫棉幼苗体内SOD活性的影响 由图1可知,随NaCl质量分数的升高,棉花幼苗体内SOD活性呈下降趋势.同一NaCl质量分数胁迫条件下,不同浓度SA处理对棉花幼苗体内SOD酶活性均有明显的提高作用.在低NaCl质量分数(0 g·kg-1NaCl)下,0.2 mmol·L-1SA处理对棉花幼苗体内SOD酶活性增加最为显著,但随SA浓度的升高又表现下降趋势.而在较高NaCl质量分数( >60 g·kg-1NaCl)下,高浓度SA处理对棉花幼苗体内SOD活性的提高更明显.
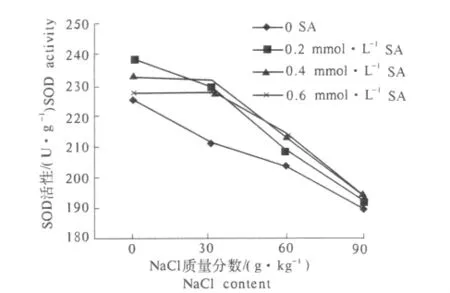
图1 SA对不同NaCl胁迫下抗虫棉幼苗SOD活性的影响Fig.1 Effects of SA on SOD activity of cotton seedlings under different NaCl stress
2.2.2 SA对NaCl胁迫下抗虫棉幼苗体内POD活性的影响 由图2可知,随NaCl质量分数的升高,棉花幼苗体内POD活性呈下降趋势,同一质量分数NaCl胁迫条件下,不同浓度SA处理对棉花幼苗体内POD酶活性均有明显的提高,增加幼苗的鲜质量和干质量,提高幼苗的耐盐性,有利于幼苗生长.

图2 SA对不同NaCl胁迫下抗虫棉幼苗POD活性的影响Fig.2 Effects of SA on POD activity of cotton seedlings under different NaCl stress
2.2.3 SA对NaCl胁迫下抗虫棉幼苗体内MDA活性的影响 丙二醛(MDA)是衡量膜脂过氧化强度的常用指标,MDA积累对膜和细胞造成一定的伤害.由图3可知,随NaCl质量分数升高,棉花幼苗体内MDA呈上升趋势,可能由于棉花种子萌发时盐分进入棉花幼苗内,细胞膜稳定性改变,幼苗为消除对盐胁迫的不适应性,产生较多的自由基导致MDA含量上升.经SA处理后,棉花幼苗的MDA含量下降.这表明SA能够在一定的程度上解除盐分对棉花细胞膜的伤害,通过降低MDA的含量来增加保护膜的稳定性,从而提高抗虫棉种子的发芽率及幼苗耐盐性.

图3 SA对不同NaCl胁迫下抗虫棉幼苗MDA活性的影响Fig.3 Effects of SA on MDA content of cotton seedlings under different NaCl stress
2.2.4 SA对NaCl胁迫下抗虫棉幼苗体内相对电导率的影响 由图4可知,随NaCl质量分数的升高,棉花幼苗体内相对电导率呈上升趋势,可能由于棉花种子萌发时盐分进入棉花植株内,增加植株细胞膜透性,细胞膜受到一定程度的伤害,导致电解质外流,引起电导率的上升.SA处理后,随着NaCl质量分数的升高,棉花幼苗的电导率呈下降趋势,在较低NaCl质量分数下,采用不同浓度SA处理,电导率下降不明显,在较高质量分数NaCl胁迫下,电导率显著下降.这表明SA能够在一定程度上解除盐分对棉花细胞膜的伤害,降低细胞膜通透性,从而提高棉花种子的发芽率及幼苗抗盐性.
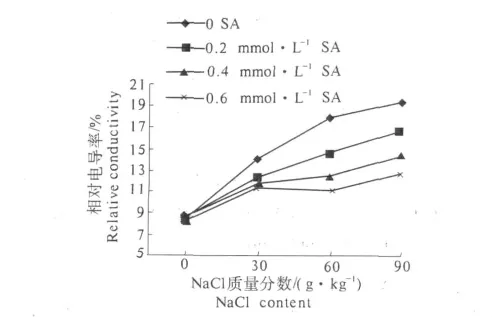
图4 SA对不同NaCl胁迫下抗虫棉幼苗相对电导率的影响Fig.4 Effects of SA on the relative conductivity of cotton seedlings under different NaCl stress
2.2.5 SA对NaCl胁迫下抗虫棉幼苗体内脯氨酸含量的影响 脯氨酸含量与植物的抗盐性密切相关,如图5所示.随着NaCl质量分数升高,棉花幼苗体内脯氨酸含量显著提高,增加外源SA对NaCl胁迫棉花幼苗体内脯氨酸含量有明显的促进作用,SA能够在一定的程度上提高脯氨酸含量缓解盐胁迫,从而提高棉花发芽率.在低盐(0 g·kg-1NaCl)和高盐质量分数(90 g·kg-1NaCl)下,不同浓度SA处理对棉花幼苗体内脯氨酸含量均表现上升趋势,在较高盐质量分数30~60 g·kg-1NaCl)下,随SA浓度升高,棉花幼苗体内脯氨酸的含量上升,在0.4 mmol·L-1SA 达到最高,然后又下降.

图5 SA对不同NaCl胁迫下抗虫棉幼苗脯氨酸含量的影响Fig.5 Effects of SA on proline content of cotton seedlings under different NaCl stress
3 结论与讨论
本研究结果表明,水杨酸对盐分胁迫条件下棉花种子萌发和幼苗生长有明显缓解作用.这一结果与尚庆茂等[12]、GUNES 等[15]、张士功等[18]在盐胁迫下利用黄瓜、玉米、小麦进行的研究结果是一致的,表明了外源SA缓解作物盐伤害作用的广泛存在.但效果最佳的作用条件有所不同,如张士功等[18]将SA溶液运用于小麦幼苗抗盐性的研究结果表明,在盐分胁迫条件下,SA质量浓度为0.1 g·L-1时对小麦幼苗高盐毒害缓解的效果最好.本研究通过棉花种子萌发试验表明,在90 g·kg-1NaCl胁迫下,以0.4 mmol·L-1SA 溶液的缓解效果最佳.分析研究结果间的差异,可能与采用的植物材料和产生盐胁迫以及SA的浓度不同等有一定的关系,具体原因还有待于进一步研究.
提高植物体内抗氧化酶类活性及增强抗氧化代谢水平是增强植物耐盐性的途径之一.SOD和POD是植物体内防护自由基对细胞膜系统伤害的重要酶类.逆境中保护酶活性增强或维持较高水平能有效地清除活性氧自由基对膜系统的伤害,使膜结构和功能相对稳定,提高植株的抗逆能力[4].本研究表明,SA处理显著提高了幼苗的SOD和POD活性,其抗盐性得到有效提高.丙二醛(MDA)是衡量细胞膜稳定性常用的指标.本研究通过棉花幼苗中丙二醛(MDA)含量的变化表明,盐胁迫后加入SA能降低MDA的含量,证明SA可以有效地抑制膜内不饱和脂肪酸过氧化作用及其产物MDA的积累,维持细胞质膜的稳定性和完整性,提高植物体对盐分胁迫的适应性.这与李焰焰等[17]在小黑麦中的发现相一致.脯氨酸在许多植物中作为主要的渗透调节物质抵抗盐胁迫如有报道认为,水稻脯氨酸的积累是盐胁迫对植物伤害的结果[18].本研究中,增加外源SA对NaCl胁迫棉花幼苗体内脯氨酸含量具有明显的促进作用,在一定的程度上缓解盐胁迫,说明外源水杨酸可调节组织内用于合成脯氨酸物质代谢,但如何调控这种代谢值得进行深入研究.
水杨酸能够诱导植物提高抗盐性作用,并且对农产品品质无不良影响,符合绿色、生态农业的发展趋势[20].因此,研究SA在棉花抗盐性方面的生理机制,可进一步利用SA缓解盐分障碍,对盐渍化土壤上棉花的栽培和育种具有重要的理论和实践意义.
[1] 陈秀兰.提高棉花抗盐性的途径[J].棉花学报,1998,10(2):64-67.
[2] 叶武威,王俊娟,樊宝相,等.盐胁迫下不同耐盐性的陆地棉品种脱落规律及机理[J].棉花学报,2007,19(2):159-160.
[3] 李伟强,杨艳敏,李存桢,等.盐胁迫对转基因抗虫棉及亲本生长发育的影响[J].中国生态农业学报,2007,15(5):108-111.
[4] 蒋玉蓉,孙玉强,童旭宏,等.种子沙引发对转基因抗虫棉耐盐性的影响[J].棉花学报,2008,19(3):212-216.
[5] 朱 伟,袁 超,马宗斌,等.水杨酸对盐胁迫下棉花种子萌发和幼苗生长的影响[J].江西农业学报,2009,21(10):17 -19.
[6] BI J L,MURPHY J B,FELTON G W.Does salicylic acid act as signal in cotton for induced resistance to Helicoverpa zea[J]?Journal of Chemical Ecology,1997,23:1805-1818.
[7] 王利军,战吉成,黄卫东.水杨酸与植物抗逆性[J].植物生理学通讯,2002,38(6):619-624
[8] 沈文飚,徐朗莱,叶茂炳.水杨酸诱导植物抗病性的新进展[J].生物化学与生物物理进展,1999,26(3):237-240.
[9] 束良佐,李 爽.水杨酸浸种对水分胁迫下玉米幼苗某些生理过程的影响[J].南京农业大学学报,2002,25(3):9-11.
[10] IDREES M,NAEEM M,AFTAB T,et a1.Salicylic acid mitigates salinity stress by improving antioxidant defence system and enhances vincristine and vinblastine alkaloids production in periwinkle[Catharanthus roseus(L.)G.Don][J].Acta Physiol Plant,2011,33:987 -999.
[11] 孙丽娜,曲 敏,任广涛,等.水杨酸对盐胁迫下黄瓜种子萌发和幼苗生长发育的影响[J].东北农业大学学报,2006 ,34(4):449-453.
[12] 尚庆茂,宋士清,张志刚,等.水杨酸增强黄瓜幼苗耐盐性的生理机制[J].中国农业科学,2007,40(1):147-152.
[13] 马敬坤,袁永泽,欧吉权,等.外源水杨酸对水稻(Oryza sativa L.)幼苗根的 NaCI胁迫缓解效应[J].武汉大学学报:理学版,2006,52(4):471-474
[14] LUTTS S,KINET J M,BOUHARMONT J.Effects of salt stress on growth,mineral nutrition and proline accumulation in relation to osmotic adjustment in rice(Oryza satival L.)cultivars differing in salinity resistance[J].Plant Growth Regul,1996,19:207 -218.
[15] GUNES A,INAL A,ALPASLAN M,et a1.Salicylic acid induced changes on some physiological parameters symptomatic for oxidative stress and mineral nutrition in maize(Zea mays L.)grown under salinity[J].Journal of Plant Physiology,2007,164:728 -736.
[16] EL-TAYEB M A.Response of barley grains to the interactive effect of salinity and salicylic acid[J].Plant Growth Regulation,2005,45:215 -224.
[17] 李焰焰,董召荣,聂传朋,等.盐胁迫下水杨酸及其衍生物对小黑麦幼苗生理特性的影响[J].生物学杂志,2005,22(3):11 -12,32.
[18] 张士功,高吉寅,宋景芝.水杨酸和阿斯匹林对盐胁迫下小麦种子萌发的作用[J].植物生理学通讯,1999,35(1):29 -32.
[19] 李合生.植物生理生化实验原理和技术[M].北京:高等教育出版社,2000.
[20] SENARATNA T,TOUCHELL D,BUNN E,et al.Acetyl salicylic acid aspirin and salicylic acid induce multiple stress tolerance in bean and tomato plants[J].Plant Growth Regulation,2000,30:157 -161.
