小檗碱衍生物HB-13对角质形成细胞分泌IFN-γ的影响
2012-07-12杨桂兰王佳媚哈小琴郭建魁
杨桂兰,李 贞,王佳媚,杨 甜,哈小琴,惠 玲,郭建魁

小檗碱是黄连的主要有效成分,具有广谱抗菌、抗炎作用,但因口服吸收有限,临床上主要用于治疗肠道细菌感染。现代医学研究表明小檗碱具有多方面的药理作用,可用于治疗心血管系统疾病、糖尿病、肿瘤、消化性溃疡及肝脏疾病[1]。目前,开发新的适应证及寻找更加有效的新型衍生物成为该药研究的热点。HB-13是从小檗碱的众多衍生物中筛选出的一个新的衍生化合物,其药效和毒理学特点都源于小檗
碱,但又有量和质的变化。本研究组前期的研究表明,HB-13较原代化合物更具备明确的抗炎、抗病毒等药理活性[2],并可诱导角质形成细胞分泌白细胞介素(IL)-10[3]。HB-13对人体和动物的多种细胞具有生理活性。本文进一步研究了HB-13对P物质诱导的人永生化角质形成细胞(HaCaT)分泌γ干扰素(IFN-γ)的影响。
1 材料与方法
1.1 材料
1.1.1 细胞及药物 HaCaT细胞株由西京医院皮肤科实验室惠赠,HB-13(纯度99.30%)及雷公藤内酯醇(T0)由中国医学科学院皮肤病研究所药物研究室提供。
1.1.2 主要试剂与仪器 HaCaT细胞培养基DMEM/F12(Gibco公司),四甲基偶氮唑蓝(MTT)及P物质(Sigma公司),IFN-γ ELISA检测试剂盒(武汉博士德公司),荧光定量PCR试剂盒(日本TaKaRa公司),全波长酶标仪(Thermo公司), PCR仪(美国ABI公司)。
1.2 实验方法
1.2.1 细胞培养 HaCaT细胞培养于含10%胎牛血清的DMEM/F12培养基中,每1~2天换液1次,待细胞生长至80%融合后传代,传代2~3次后,选择生长旺盛、形态良好的细胞进行实验。
1.2.2 药物配制 用无血清DMEM/F12培养基溶解[之前先用二甲基亚砜(DMSO)助溶]HB-13与T0并配制成所需浓度(HB-13终浓度分别为2.5、5、10、20、40、80 μg/ml,T0终浓度为20 ng/ml);P物质用无血清DMEM/F12培养基配制,终浓度为1×10-8mol/L;以上药物置-20℃保存。
1.2.3 寻找HB-13作用于HaCaT细胞的安全浓度 将生长状态良好的HaCaT细胞经胰酶消化并调整为2×104个/ml的单细胞悬液,传代至96孔细胞培养板,每孔100 μl。待细胞完全贴壁后,移去原有培养液,实验组分别加入含上述不同浓度的HB-13;对照组加入DMEM/F12培养液。每个浓度设6个复孔,数值测量及计算时取6孔的平均值。37 ℃、5%CO2培养箱孵育24 h,每孔加入5 mg/ml的MTT溶液 20 μl,继续培养4 h,吸去上清,每孔加入DMSO 200 μl,并充分振荡使甲瓒结晶完全溶解。酶标仪490 nm处测各孔A值。
1.2.4 细胞培养上清液中IFN-γ含量的检测 2×104个/ml的HaCaT细胞单细胞悬液,传代至96孔细胞培养板,每孔100 μl。待细胞完全贴壁后,移去原有培养液,向培养体系中加入P物质(1×10-8mol/L),30 min后实验组分别加入不同浓度(2.5、5、10 μg/ml)的HB-13溶液;T0组加入20 ng/ml的雷公藤内酯醇作为阳性对照;阴性对照组中加入DMEM/F12培养液;每组设6个复孔,数值测量及计算时取6孔的平均值。分别培养12、24、48 h后,收集培养上清液,-20℃保存。采用酶联免疫吸附法(ELISA)检测严格按试剂盒说明书进行,检测培养上清液中IFN-γ的表达。
1.2.5 细胞内IFN-γ mRNA的检测 ①总RNA的提取和cDNA的合成:在待测上清液中,按10 cm2(培养瓶面积)加入1ml trizol提取总RNA,严格按试剂盒说明操作。用1.2%琼脂糖凝胶电泳鉴定总RNA的完整性,紫外分光光度计检测总RNA的含量和纯度。cDNA的合成操作严格按试剂盒说明书进行。②实时定量RT-PCR检测IFN-γ mRNA:总反应体系为20 μl,包括模板cDNA 2 μl,SYBR Premix Ex Taq 10 μl,上、下游引物各(IFN-γ或β-actin)0.8 μl,ROX Reference Dye 0.4 μl,灭菌蒸馏水6 μl。扩增条件:95℃ 30 s,95℃ 5 s,60℃ 31 s,循环40次。PCR过程设无模板阴性对照,每组3个复孔。引物如下:IFN-γ扩增片段110 bp(上游为:5'- CAT CGT TTT GGG TTC TCT TG -3',下游为:5'-TTC CAT TAT CCG CTA CAT CT -3');β-actin扩增片段205 bp(上游为:5'-TGA CGT GGA CAT CCG CAA AG-3',下游为:5'-CTG GAA GGT GGA CAG CGA GG-3')。荧光定量RT-PCR的结果判断以β-actin为内参照的表达强度为基准,校正值=目的基因定量结果/内参定量结果;相对定量结果=检验样品的校正值/对照样品的校正值。
1.2.6 统计学方法
采用SPSS11.5统计软件进行处理。各组取6孔的平均值进行统计学分析。实验数据以均数±标准差(±s)表示,数据经独立样本t检验分析,P<0.05为差异有统计学意义。
2 结果
2.1 B-13的安全浓度
HB-13 的浓度为 2.5、5、10 μg/ml时,HaCaT 细胞吸光度值分别为0.982±0.041,0.980±0.043,0.979±0.042,与对照组0.982±0.037相比差异无统计学意义(P>0.05);而浓度为20、40、80 μg/ml时吸光度值分别为 0.728±0.052,0.564±0.053,0.323±0.053,明显低于对照组,差异具有统计学意义(P< 0.01)。因此当 HB-13 浓度为 2.5、5、10 μg/ml时,HaCaT细胞生长正常,确定其为安全浓度。
2.2 培养上清液中IFN-γ含量
IFN-γ含量在不同浓度 (2.5、5、10 μg/ml)HB-13培养体系和不同培养时间上清中均较阳性对照组和阴性对照组显著增高(均P<0.01),而组内含量无统计学差异(P>0.05)(表1)。
表1 HB-13对P物质刺激HaCaT细胞培养上清液IFN-γ的影响 ( ±s,pg/ml)

表1 HB-13对P物质刺激HaCaT细胞培养上清液IFN-γ的影响 ( ±s,pg/ml)
注:a:与对照组相比P<0.01;b:与 T0组相比P<0.01
组 别 12 h 24 h 48 h阴性对照组 42.358±7.143 43.641±8.426 42.102±2.526 T0组(20 ng/ml) 73.650±3.988 85.705±6.759 94.169±2.526 HB-13(2.5 μg/ml) 107.763±9.195ab 112.637±7.124ab 111.354±8.887ab HB-13(5 μg/ml) 111.611±4.065ab 110.328±5.604ab 115.971±7.096ab HB-13(10 μg/ml) 111.600±4.322ab 115.458±6.887ab 117.510±5.604ab
2.3 细胞内IFN-γ mRNA表达水平
细胞经不同浓度HB-13作用后,在不同时间段IFN-γ表达均较阴性对照组和阳性对照组明显增加(P<0.01);但不同浓度组间无药物浓度和作用时间的差异(P>0.05)(表2)。
表2 HB-13对P物质刺激HaCaT细胞内表达IFN-γ mRNA的影响 ( ±s)
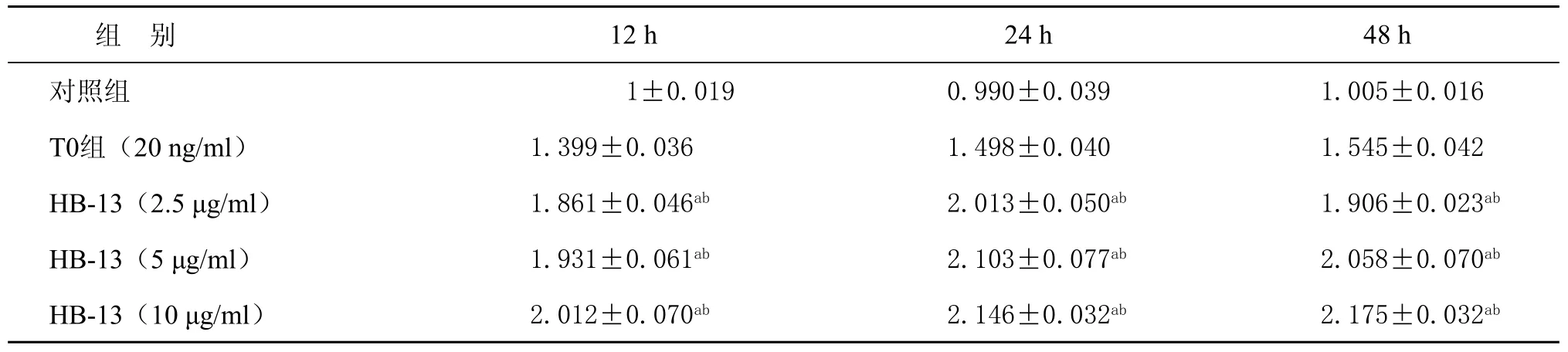
表2 HB-13对P物质刺激HaCaT细胞内表达IFN-γ mRNA的影响 ( ±s)
注:a:与对照组相比P<0.01;b:与 T0组相比P<0.01
组 别 12 h 24 h 48 h对照组 1±0.019 0.990±0.039 1.005±0.016 T0组(20 ng/ml) 1.399±0.036 1.498±0.040 1.545±0.042 HB-13(2.5 μg/ml) 1.861±0.046ab 2.013±0.050ab 1.906±0.023ab HB-13(5 μg/ml) 1.931±0.061ab 2.103±0.077ab 2.058±0.070ab HB-13(10 μg/ml) 2.012±0.070ab 2.146±0.032ab 2.175±0.032ab
3 讨论
HB-13是从小檗碱衍生物中筛选出的新化合物,具有抗炎、抗病毒和抗增生活性。然而,目前对HB-13与上述活性之间的相关性及其作用机制还不明确。IFN-γ主要由Th1细胞产生,不仅有抗病毒、抗肿瘤细胞活性,而且在免疫调节中具有重要作用,是体内重要的免疫调节因子。IFN-γ可诱导rRNA合成,促进免疫细胞表面Ⅰ类和Ⅱ类组织相容性抗原的表达,增强同种K细胞、NK细胞和巨噬细胞的活性[6]。同时,IFN-γ还可激活NK细胞,刺激先天性的细胞免疫和特异性细胞毒性T细胞免疫等,从而增强其抗病毒、抗肿瘤的功能[7,8]。P物质是由神经末梢释放的神经多肽,是过敏反应及自身免疫反应的重要递质[4],对免疫及炎症反应中炎症细胞的募集具有重要作用[5]。因此,我们选用P物质作为炎症诱导剂。T0可能诱导细胞内IFN-γ的合成,具有明确的非特异性的抗炎作用,故本研究选用其作为阳性对照组诱导剂。其促进IFN-γ分泌的具体机制尚未阐明。
我们采用MTT法检测了不同浓度HB-13对HaCaT细胞的毒性,实验证明,<10 μg/ml的HB-13对HaCaT细胞是安全浓度;同时上述浓度的HB-13对炎症递质P物质作用下的HaCaT细胞分泌IFN-γ均有促进作用。提示外用HB-13制剂可能通过促进皮肤角质形成细胞合成与分泌IFN-γ而发挥抗病毒、抗肿瘤、抗炎症等药理学作用。在本实验所选浓度及时间范围内,HB-13诱导HaCaT细胞分泌IFN-γ,无时间及剂量依赖性,提示HB-13在皮肤中发挥其药理学作用的浓度范围较广且作用时间较长。
[1]王小逸, 史亦丽, 曾衍均, 等. 小檗碱的研究进展 [J]. 中国新药杂志, 2003, 12(7):56-58.
[2]吴建兵, 李新宇, 林麟, 等. 小檗碱衍生物HB-13体外抗单纯疱疹病毒的研究 [J]. 中华皮肤科杂志, 2007, 40(11): 671-673.
[3]李贞, 杜华, 张新玲, 等. 小檗碱衍生物HB-13对角质形成细胞分泌IL-10的影响 [J]. 中国麻风皮肤病杂志, 2010,26(5):314-316.
[4]Castellani ML, Galzio RJ, Felaco P, et al. VEGF, substance P and stress, new aspects: a revisited study [J]. J Biol Regul Homeost Agents, 2010, 24(3):229-237.
[5]Rosenkranz MA. Substance P at the nexus of mind and body in chronic inflammation and affective disorders [J]. Psychol Bull,2007, 133(6):1007-1037.
[6]Agnello D, Lankford CS, Bream J, et al. Cytokines and transcription factors that regulate Thelper cell differentiation: new players and new insights [J]. J Clin Immunol, 2003, 23(3):147-161.
[7]Balato A, Unutmaz D, Gaspari AA. Natural killer T cells: an unconventional T-cell subset with diverse effector andregulatory functions [J]. J Invest Dermatol, 2009, 129(7):1628-1642.
[8]von Bubnoff D, Andrès E, Hentges F, et al. Natural killer cells in atopic and autoimmune diseases of the skin [J]. J Allergy Clin Immunol, 2010, 125(1):60-68.
