原发性系统性淀粉样变性的预后及危险因素分析
2012-07-10黄湘华史明君陈文萃王庆文曾彩虹刘志红
黄湘华 蒋 松 史明君 陈文萃 王庆文 曾彩虹 刘志红
原发性系统性(AL)淀粉样变性也称免疫球蛋白轻链相关淀粉样变性,是最常见的系统性淀粉样变性类型[1]。AL淀粉样变性的单克隆轻链来源于骨髓浆细胞或淋巴浆细胞[2],淀粉样物质可沉积于多个器官,呈进行性发展,最后死于重要器官功能衰竭,预后最差[3]。心脏受累程度仍是影响AL淀粉样变性患者预后的主要危险因素[4],心室壁增厚、舒张功能异常,收缩功能下降均提示患者预后差[5],已证实很多心脏分子标记物如肌钙蛋白I(TnI)或T(TnT)及脑钠肽(BNP)、前端脑钠肽(NT-proBNP)等均为判断淀粉样变性预后重要的预测因子[6,7]。
70%的AL淀粉样变性患者累及肾脏,以肾病范围的蛋白尿或急性肾功能损害为临床主要表现[8]。意大利的一项研究表明,AL淀粉样变性患者中位存活时间为33月[9],但我国仍缺乏相关大样本研究资料。本研究分析245例AL淀粉样变性患者的临床及随访资料,旨在阐明本组患者的临床预后特点及预后相关危险因素。
对象和方法
研究对象回顾性分析2003年3月至2011年8月期间在南京军区南京总医院全军肾脏病研究所诊断为AL淀粉样变性且资料完整的患者,均符合以下标准:(1)肾活检证实为AL淀粉样变性;或其他部位活检(皮肤脂肪、直肠黏膜等)证实为AL淀粉样变性,合并肾脏受累(尿蛋白定量>0.5 g/24h和/或肾功能不全);(2)排除糖尿病肾病;(3)随访时间≥3月或在随访3月内已达到随访终点。
观察指标
一般情况 性别、年龄、病程、临床症状、活检部位、受累器官情况、血压、随访时间、是否接受特殊治疗(化疗或干细胞移植)及人、肾存活情况。
实验室检查 确诊时血清肌酐(SCr)、尿素氮、白蛋白、碱性磷酸酶、血红蛋白(Hb)、尿蛋白、N-乙酰-β-D-氨基葡萄糖苷酶(NAG)、视黄醇结合蛋白(RBP)、免疫固定电泳、肝脏右肋下最大斜径、室间隔厚度、左室射血分数、骨髓浆细胞比例等。
肾脏病理 肾活检明确诊断的患者均进行光镜、免疫荧光、刚果红染色、刚果红高锰酸钾抵抗、电镜检查。光镜检查包括苏木素-伊红染色(HE)、过碘酸Schiff染色(PAS)、过碘酸六胺银染色(PASM-Masson)及Masson三色染色;免疫荧光检查使用冰冻切片,观察肾组织IgG、IgA、IgM、C3、C4、C1q、κ轻链、λ轻链的沉积情况。电镜下观察淀粉样纤维丝的沉积情况。
相关指标定义 肾功能不全定义为估算的肾小球滤过率(eGFR)<60 ml/(min·1.73m2);低血压定义为静息状态下未使用降压药物时收缩压<90 mmHg;体重下降定义为3月内体重减轻>10 kg;贫血定义为Hb男性<120 g/L,女性<110 g/L。随访时间范围从明确诊断到患者死亡,或至最近一次的临床随访,随访时间截点为2011-11-01。随访主要终点为患者死亡,次要终点为进入终末期肾病(ESRD)或开始透析。生存时间起点为确诊为AL淀粉样变性的时间。ESRD定义为eGFR<15 ml/(min·1.73m2)或开始肾脏替代治疗。患者肾功能下降速率定义为使用最小二乘法的计算随访eGFR变化斜率。肾存活时间起点为确诊AL淀粉样变性的日期。平均动脉压(MAP)定义为舒张压+1/3脉压差。超大量蛋白尿定义为尿蛋白定量>10 g/24h。器官受累标准采用国际统一的定义。特殊治疗定义为接受常规化疗或自体造血干细胞移植治疗。
统计学方法采用SPSS 13.0统计软件进行数据分析。计量资料以均数±标准差或中位数(四分位间距)表示,分类变量以率表示。正态分布数据,两组间比较使用t检验,率的比较采用卡方检验。利用Kaplan-Meier法计算患者的生存时间及肾脏存活时间。采用单因素COX回归模型计算各个因素的风险比值(HR),并将单因素分析有显著性差异的变量纳入多因素COX回归模型分析,以进一步明确独立的预后因素。所有检验均为双侧检验,P<0.05为差异有统计学意义。
结 果
随访情况和预后2003年3月至2011年8月共有269例患者诊断为AL淀粉样变性,其中失随访24例,本研究纳入观察245例,中位随访时间20月。245例中轻链沉积类型不明45例,合并多发性骨髓瘤(MM)15例,其余209例中λ轻链型187例(187/209,89.5%),κ轻链型22例(22/209,10.5%)。随访中111例患者死亡,其中40例死亡前已接受透析治疗;17例患者目前仍维持透析(腹膜透析3例,血液透析14例),其余患者人、肾均存活(图1)。
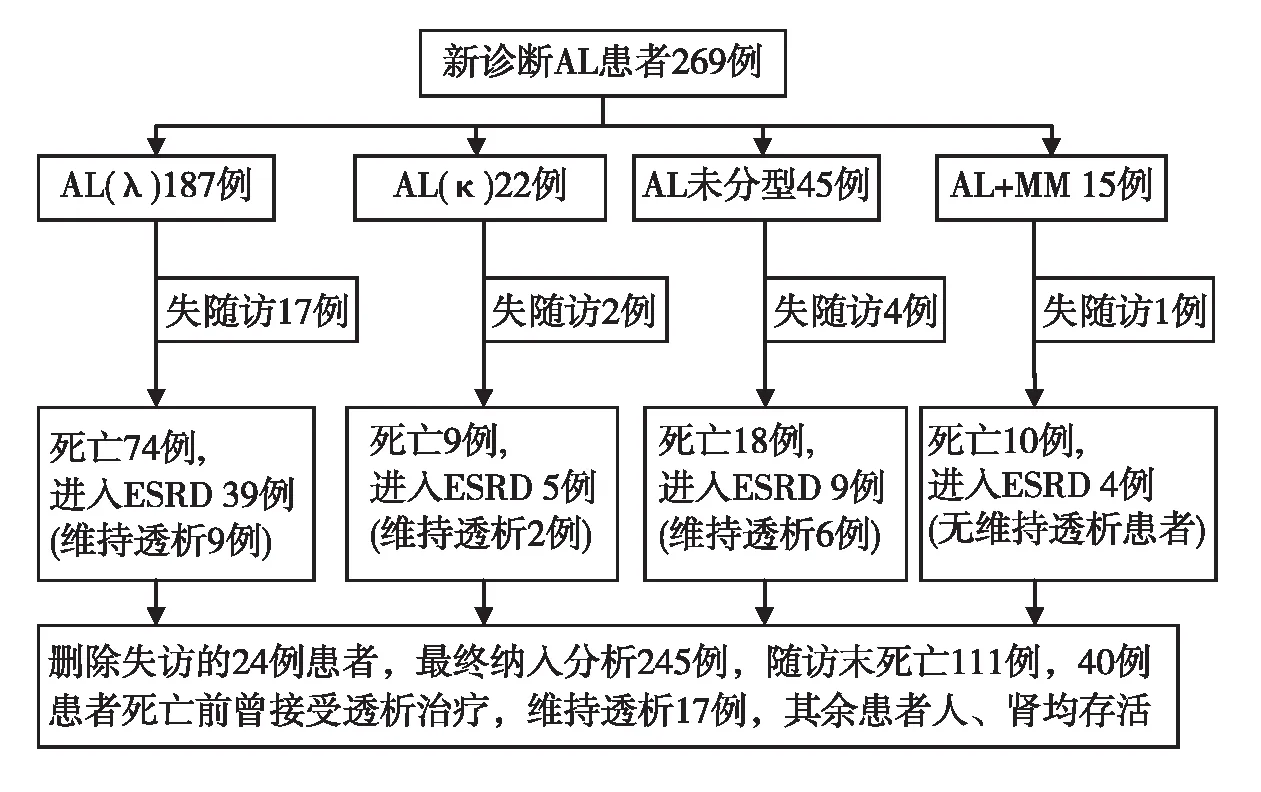
图1 总体随访情况
245例患者中男性153例,女性92例。年龄30~83岁,中位年龄56岁(表1)。202例患者行肾活检检查,均符合AL淀粉样变性的特点;40例患者行皮肤脂肪活检,阳性率92.5%;158例患者行直肠黏膜活检,阳性率86.7%。就诊时患者主要表现为水肿(90.6%)和乏力(40%),其次为低血压(30.2%)和体重下降(27.3%)(图2)。除肾脏以外,最常见的受累器官是肠道(55.9%),其次为心脏(46.9%)。大部分患者表现为多器官受累,单纯肾脏受累者仅24.9%。M蛋白以λIgG(36.1%)和λIgA(18.8%)多见(表1)。

表1 245例原发性系统性淀粉样变性患者一般情况
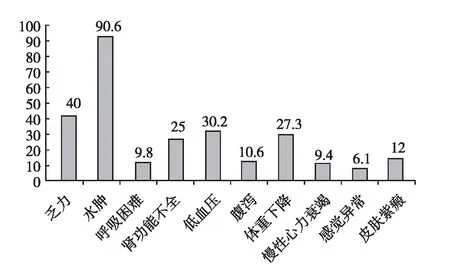
图2 原发性系统性淀粉样变性的主要临床表现及发生率
患者确诊时中位病程为7月(四分位间距3~13月),以肾病综合征为主要表现,尿蛋白定量为4.86±4.32 g/d,其中57.96%的患者尿蛋白为3.5~10 g/d,4.49%的患者尿蛋白>10 g/d。患者MAP 85.32±14.43 mmHg,4.5%的患者平均动脉压<60 mmHg。肾小管功能受损明显,NAG中位值为55.05 U/(g·Cr)[四分位间距33.52~83.47 U/(g·Cr)],RBP中位值0.61 mg/L(四分位间距0.18~3.35 mg/L)。患者SCr 114.04±103.43 μmol/L,尿素氮为11.67±5.46 mmol/L,但有25%确诊时合并肾功能不全,其中10例SCr>353.6 μmol/L。Hb 124.0±22.6 g/L,80例(32.65%)患者合并贫血。骨髓浆细胞比例中位数为2%。按轻链类型比较发现,κ型AL患者的尿蛋白更突出(6.04±4.11 g/24hvs4.69±2.66 g/24h,P<0.05)、肾功能受损更严重(SCr 128.18±83.10 μmol/Lvs96.36±61.88 μmol/L,P<0.05),其他临床特征未见统计学差异(表2)。
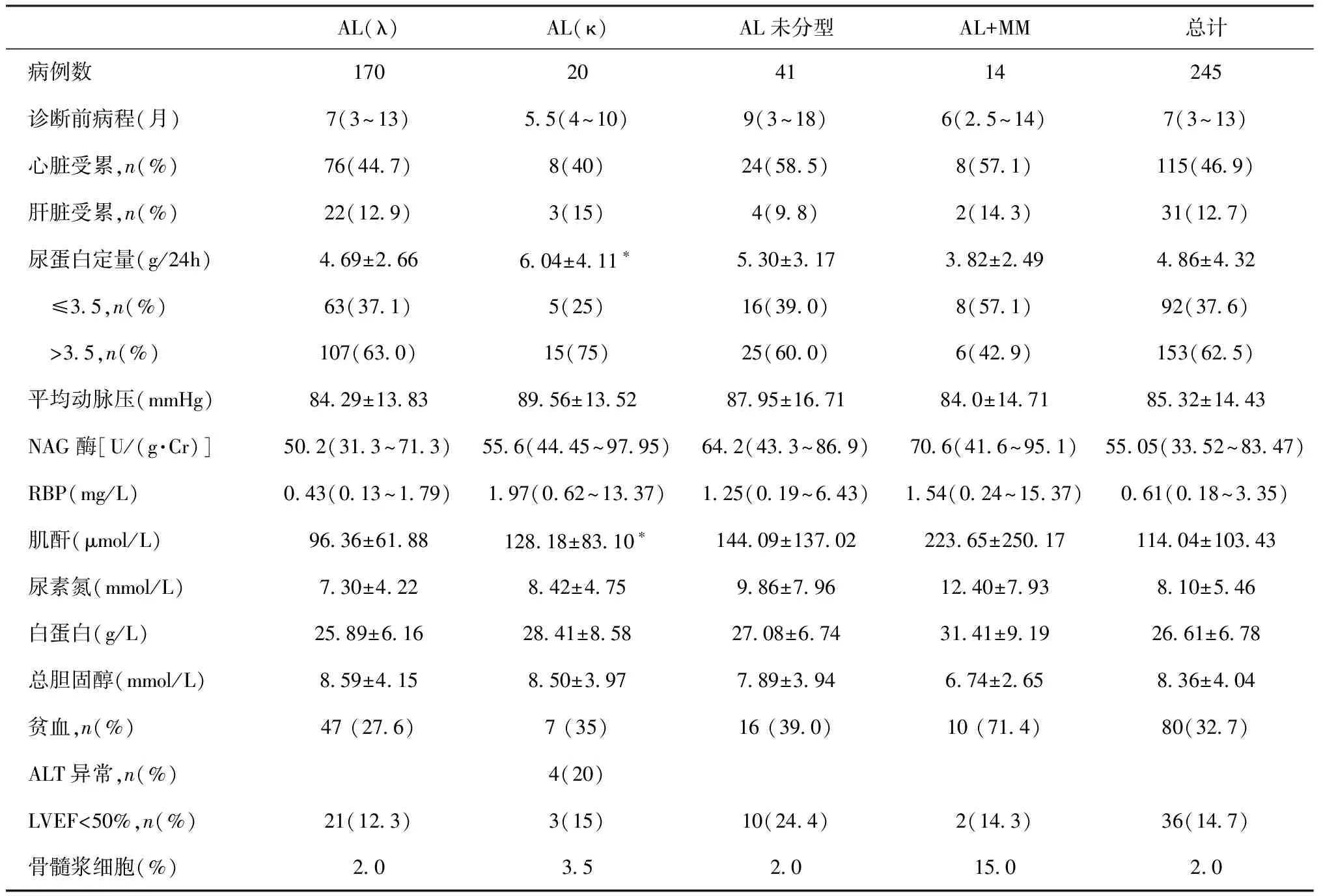
表2 原发性系统性(AL)淀粉样变性患者临床资料
生存分析本组患者总体的中位生存时间33.6月(1~98月),1年、2年、3年及5年生存率分别为68.3%、52.7%、47.8%及30.7%(图3A)。根据患者的临床特点分成不同的亚组,结果发现心脏受累、肾功能不全、特殊治疗对患者生存均有显著影响。合并心脏受累患者的中位生存时间为19.1月,而无心脏受累患者为51.8月(P=0.001)(图3B)。合并肾功能不全的患者生存时间也明显缩短,中位生存时间为11.4月,而肾功能正常患者为42.9月(P<0.001)(图3C)。特殊治疗可以改善患者预后,接受过特殊治疗的患者中位生存时间为58.6月,而未治疗患者的中位生存时间仅13.5月(P<0.001)(图3D)。其次,受累器官较多的患者生存时间也明显缩短,根据肾脏、心脏、肝脏受累的情况,按患者受累器官个数分组后,结果表明仅有肾脏受累患者的中位生存时间为58.6月,有两个器官受累是中位生存时间降至18.6月,而三个器官受累的患者仅9.2月(P<0.001)(图3E)。研究结果还表明,肝脏受累及合并低血压的患者生存期也明显缩短。
随访过程中共111例(45.3%)患者死亡,其中AL+MM组患者的死亡比例最高,为71.4%。死亡原因见表3,心脏疾病仍是AL淀粉样变性患者死亡的首要原因,占死亡人数的35.1%,其次是感染(19.8%)和疾病进展(15.3%)。透析及治疗(化疗或干细胞移植)相关并发症导致的死亡也占一定比例,透析并发症包括心跳骤停、败血症、低血压、脑出血等,治疗并发症主要有心律失常、高钾血症、败血症、血栓栓塞等。
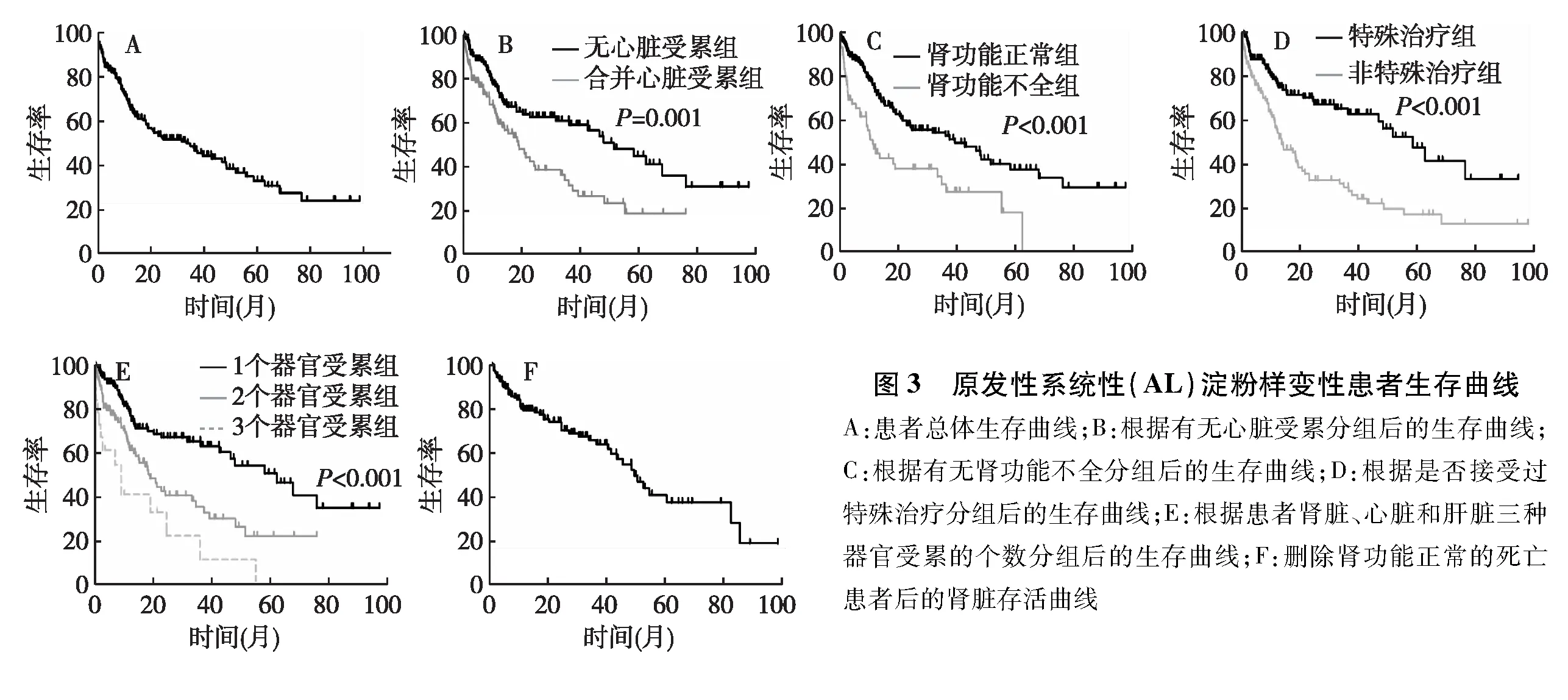
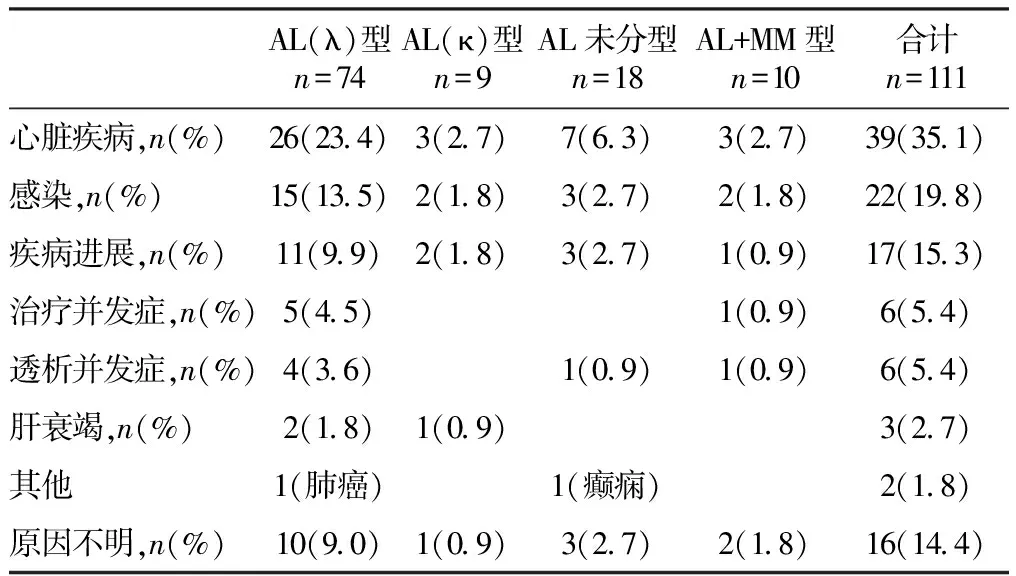
表3 111例患者死亡原因分析
单因素分析表明年龄、性别、心脏受累、肝脏受累、低血压、SCr、骨髓浆细胞比例和是否经过特殊治疗都与患者预后密切相关(表4),多因素分析表明年龄、肝脏受累、心脏受累是患者的预后危险因素,而特殊治疗是患者预后的保护因素。性别因素中男性患者的预后更差。

表4 245例患者生存预后危险因素分析
肾脏预后分析随访过程中共有57例患者接受透析治疗,其中40例患者死亡,血液透析患者49例(85.9%),8例患者接受腹膜透析治疗。在去除肾功能正常的死亡患者后,计算的肾脏中位生存时间为45月(1~98月),1年、2年、3年及5年肾存活率分别为78.6%、69.6%、63.2%和36.9%(图3F)。分析纳入诊断时eGFR<60 ml/(min·1.73m2)的患者结果显示,GFR下降速度为3.44 ml/(min·月)。透析患者的中位生存时间为18月,36.8%患者在透析后1年内死亡,死亡的主要原因是透析并发症及心源性死亡。肾脏预后单因素分析表明诊断年龄、性别、SCr、RBP、心脏受累、肝脏受累、低血压均为进展至ESRD的危险因素,多因素分析表明诊断时SCr水平和低血压是进展至ESRD的独立危险因素(表5)。

表5 245例患者肾脏预后危险因素分析
讨 论
AL淀粉样变性是临床最常见的一种系统性淀粉样变性,因淀粉样物质前体蛋白为免疫球蛋白轻链而得名。其发病机制仍不明确,目前认为主要与单克隆浆细胞功能异常有关,这些细胞过量分泌不能结合重链的游离轻链[10],游离轻链可进一步形成淀粉样纤维丝,在器官组织沉积,导致器官功能障碍及患者死亡[3]。AL型淀粉样变性为一种系统性疾病,可以累及除中枢神经系统外的任何组织器官,因受累器官的多寡和程度不等,其临床表现复杂多样。以肾脏和心脏受累最常见,其次为肝脏和外周神经[11]。患者的预后在很大程度上决定于患者累及的器官个数及严重程度,其中又以心脏受累患者预后最差,临床表现为充血性心力衰竭者中位生存期不足6月[12]。目前AL淀粉样变性的相关临床及预后研究均来自欧美国家,有关我国AL淀粉样变性患者的长期预后报道极为缺乏。本研究首次报道了中国汉族人群AL型淀粉样变性患者的临床预后特点。
活检是确诊AL淀粉样变性的必要手段,本组患者以肾活检诊断为主,除肾活检之外,皮肤和直肠黏膜活检也具有较高的阳性率,分别为92.5%和86.7%,与Kaplan等[13]报道的90%的阳性率相仿,Kyle等[11]报道在皮肤和直肠黏膜活检中的阳性率分别为80%和75%,提示在怀疑淀粉样变性且无条件行肾活检的患者中,皮肤和直肠黏膜活检都是较好的替代部位。本研究显示,肾病综合征仍是肾脏AL淀粉样变性患者的主要临床表现,患者的平均尿蛋白定量为4.86 g/24h,平均白蛋白水平仅26.6 g/L。有研究表明λ轻链型比κ轻链型尿蛋白水平更高[14],但本研究并未发现这种差别,可能与κ轻链型患者偏少有关。
AL淀粉样变性患者预后的差异较大,部分患者明确诊断后数月即死亡,而也有患者可以长期存活。AL淀粉样变性的患者多死于器官功能不全的并发症,而非潜在浆细胞疾病的进展[4]。AL淀粉样变性总体生存较差,但合并肾脏受累的AL患者似乎预后更好。Certz等[15]对145例AL淀粉样变性患者的长期随访结果显示,累及肾脏的患者的中位生存期为38月,而无肾脏受累患者的中位生存期仅为19月(P=0.05),作者认为造成这种差别的一个重要原因就是心脏受累的比例,因为无肾脏受累患者心脏受累的比例高达75%。意大利的一项多中心研究结果表明累及肾脏的AL淀粉样变性的中位生存时间为37月[9]。本研究表明患者的中位生存时间为33.6月,比其他研究更短,可能与本组患者心脏受累比例偏高有关。进一步的亚组分析发现心脏受累、肝脏受累、低血压、肾功能不全患者生存时间明显缩短,而特殊治疗(化疗或干细胞移植)可以提高患者生存时间,与既往研究相似[9]。特殊治疗即为针对轻链产生的恶性克隆细胞的化疗,是一种病因治疗,可以明显改善患者预后[8]。如自体干细胞移植,研究数据表明,自体干细胞移植的完全缓解率约40%,取得完全缓解的患者50%存活可超过10年[16]。
目前已明确的预后相关危险因素中,器官受累的严重程度是最重要的预后因素,其中以心脏受累与预后关系最为密切。AL淀粉样变性最常见的死亡原因就是心脏病变,大约65%~75%的患者死于心脏淀粉样变性相关并发症。很多心脏生物标志物也被发现与预后密切相关。Dispensieri等[7]首次报道了肌钙蛋白与AL淀粉样变性患者预后的关系。Palladini等[6]发现NT-proBNP是心脏受累及功能不全强有力的预测因子,而联合肌钙蛋白对预后判断的意义更大[17]。本研究主要针对心脏受累进行了相关分析,单因素及多因素分析均显示心脏受累是预后的危险因素,与国外研究结果类似。此外,本研究多因素分析还表明年龄和肝脏受累也是预后的独立危险因素。意大利报道的一组肾脏受累AL淀粉样变性患者的预后多因素分析表明年龄、SCr水平及心脏受累影响预后[9]。肝脏受累虽不如心脏及肾脏普遍,但对预后影响很大。一组98例肝脏受累AL淀粉样变性的临床分析表明其中位生存期仅8.5月,充血性心力衰竭、胆红素升高及血小板计数>500×109/L提示预后不良[18]。本研究也显示肝脏受累的患者中位生存期最短,临床工作中应重视肝脏受累的筛查。
肾脏是AL淀粉样变性最常见的受累器官,常引起不可逆的肾脏损害而导致ESRD。在一项研究中,累及肾脏的AL淀粉样变性患者中42%需要透析治疗,开始透析后患者1月死亡率为20%,1年死亡率45%,最常见的死亡原因仍是心脏疾病。诊断时蛋白尿及SCr是预测患者进展至ESRD的重要因素[15]。本研究中进入透析治疗的患者不足1/4,可能与随访时间较短有关,此外部分患者未进展至ESRD便已死亡,也使透析患者比例偏低。Gertz等[13]报道一组淀粉样变性患者,其中SCr<114.92 μmol/L者的中位生存期为25.6月,而SCr>114.92 μmol/L者仅14.9月(P<0.01)。另一项研究中19例透析的AL淀粉样变性患者进入透析的平均时间为25.2月,其中15例患者死亡,死亡的主要原因是感染和心源性死亡,患者的中位生存时间仅26月[19]。以上研究均表明AL淀粉样变性患者进入ESRD后,预后更差,患者的中位存活明显缩短。本研究结论与其他研究类似,同时多因素分析表明诊断时SCr和低血压是进展至ESRD的独立危险因素。
小结:肾脏是AL淀粉样变性的最常见的受累器官之一,本研究表明AL型肾脏淀粉样变性患者临床表现多样,易合并肠道、心脏等器官受累,对于年龄偏大的肾病综合征患者,应注意排除。此类患者长期预后较差,其中合并心脏受累、肝脏受累、低血压及肾功能不全者预后更差,而接受特殊治疗可明显提高患者生存率。患者肾脏预后同样不佳,肾功能恶化速度较快,进入透析患者的生存时间较短,预后分析表明诊断时SCr及低血压提示肾脏预后不良。
1 Cohen AD,Comenzo RL.Systemic light-chain amyloidosis:advances in diagnosis,prognosis,and therapy.Hematology Am Soc Hematol Educ Program,2010,2010:287-294.
2 Gertz MA,Lacy MQ,Dispenzieri A,et al.Amyloidosis.Best Pract Res Clin Haematol,2005,18(4):709-727.
3 Merlini G,Bellotti V.Molecular mechanisms of amyloidosis.N Engl J Med,2003,349(6):583-596.
4 Kastritis E,Dimopoulos MA.Prognosis and risk assessment in AL amyloidosis—state of the art.Amyloid,2011,18(Suppl 1):84-86.
5 Falk RH.Diagnosis and management of the cardiac amyloidoses.Circulation,2005,112(13):2047-2060.
6 Palladini G,Campana C,Klersy C,et al.Serum N-terminal pro-brain natriuretic peptide is a sensitive marker of myocardial dysfunction in AL amyloidosis.Circulation,2003,107(19):2440-2445.
7 Dispenzieri A,Kyle RA,Gertz MA,et al.Survival in patients with primary systemic amyloidosis and raised serum cardiac troponins.Lancet,2003,361(9371):1787-1789.
8 Merlini G,Seldin DC,Gertz MA.Amyloidosis:pathogenesis and new therapeutic options.J Clin Oncol,2011,29(14):1924-1933.
9 Bergesio F,Ciciani AM,Manganaro M,et al.Renal involvement in systemic amyloidosis:an Italian collaborative study on survival and renal outcome.Nephrol Dial Transplant,2008,23(3):941-951.
10 Katzmann JA,Abraham RS,Dispenzieri A,et al.Diagnostic performance of quantitative kappa and lambda free light chain assays in clinical practice.Clin Chem,2005,51(5):878-881.
11 Kyle RA,Gertz MA.Primary systemic amyloidosis:clinical and laboratory features in 474 cases.Semin Hematol,1995,32(1):45-59.
12 Falk RH.Cardiac amyloidosis:a treatable disease,often overlooked.Circulation,2011,124(9):1079-1085.
13 Kaplan B,Vidal R,Kumar A,et al.Immunochemical microanalysis of amyloid proteins in fine-needle aspirates of abdominal fat.Am J Clin Pathol,1999,112(3):403-407.
14 Gertz MA,Lacy MQ,Dispenzieri A.Immunoglobulin light chain amyloidosis and the kidney.Kidney Int,2002,61(1):1-9.
15 Gertz MA,Leung N,Lacy MQ,et al.Clinical outcome of immunoglobulin light chain amyloidosis affecting the kidney.Nephrol Dial Transplant,2009,24(10):3132-3137.
16 Schönland SO,Dreger P,de Witte T,et al.Current status of hematopoietic cell transplantation in the treatment of systemic amyloid light-chain amyloidosis.Bone Marrow Transplant,2012,47(7):895-905.
17 Palladini G,Barassi A,Klersy C,et al.The combination of high-sensitivity cardiac troponin T (hs-cTnT) at presentation and changes in N-terminal natriuretic peptide type B (NT-proBNP) after chemotherapy best predicts survival in AL amyloidosis.Blood,2010,116(18):3426-3430.
18 Park MA,Mueller PS,Kyle RA,et al.Primary (AL) hepatic amyloidosis:clinical features and natural history in 98 patients.Medicine (Baltimore),2003,82(5):291-298.
19 Bollée G,Guery B,Joly D,et al.Presentation and outcome of patients with systemic amyloidosis undergoing dialysis.Clin J Am Soc Nephrol,2008,3(2):375-381.
