施用钝化剂对镉污染稻田土壤微生物学特征的影响
2012-07-10黄道友朱奇宏饶中秀刘守龙
周 斌 ,黄道友 ,朱奇宏 ,饶中秀 ,刘守龙
(1.中国科学院亚热带农业生态研究所,亚热带农业生态过程重点实验室,湖南长沙410125;2.中国科学院研究生院,北京100049)
国家环保总局的调查结果显示,我国镉污染的农田面积已突破28万hm2,年产镉超标农产品达150万t[1]。土壤镉污染已成为我国的一个重要环境问题,严重威胁到了农产品的质量安全和农业区域生态系统的稳定。施用化学钝化剂被认为是修复利用镉污染土壤的一种经济有效的途径[2]。然而,钝化剂的大量施用,不仅改变了土壤的基本理化性质,也可能对土壤的微生物种群与生态环境产生影响。因此,研究土壤微生物对钝化剂储备性施用的响应,既是对其钝化修复技术效果评价的重要内容,也是对其进行生态风险评估不可或缺的内容。前人研究证实施用石灰[3-4]、钙镁磷肥[5-6]和海泡石[7]等钝化剂,可以提高土壤的pH值,从而降低土壤中镉的生物有效性[8];有机钝化剂[9]和海泡石[10]等则可通过吸附作用,从而减少土壤中的重金属有效性。本课题组通过田间小区试验研究发现,镉污染稻田通过储备性施用石灰、钙镁磷肥、海泡石和腐植酸矿粉等钝化剂,能显著降低土壤中的有效态镉含量,减少水稻对镉的吸收和积累[7]。土壤微生物和土壤酶不仅推动着土壤有机质的矿化分解与养分物质的循环与转化,而且还是表征土壤质量的重要指标,能敏感地反映土壤环境的微小变化[11]。近年来,随着分子生物学技术的迅猛发展,末端限制性酶切片段长度多态性分析(T-RFLP)技术已经成功的应用于土壤微生物群落的分析[12-14]。采用T-RFLP技术可以分析群落间差异,比较群落相对丰度和结构,识别群落中具体物种[15]。以往关于镉污染土壤施用钝化剂的研究主要是关注施用钝化剂后对土壤中镉的植物有效性以及植物对镉的吸收和累积等方面,而有关土壤微生物和酶活性对施用钝化剂的响应等方面的研究较为缺乏。本研究在课题组前期研究的基础上,重点探讨镉污染稻田储备性施用钝化剂后土壤微生物对其的响应,研究结果可为钝化改良措施的风险评估提供数据支撑,并为镉污染的钝化修复提供科学依据。
1 材料与方法
1.1 实验设计
田间试验于2007年开始在湖南省某工业城市市郊进行。试验点因土壤镉污染,部分农田弃耕,主要污染源为附近的一个小型电镀厂,该厂已于2006年4月依法关闭。试验土壤发育于第四纪红色黏土,其基本理化性质见表1。

表1 供试土壤基本理化性质
试验以当地习惯种植为对照(CK),设石灰(L,含镉0.14 mg/kg,按1.5 t/hm2一次性施入)、钙镁磷肥(P,含镉2.1 mg/kg,按22.5 t/hm2一次性施入)、海泡石(S,主成分海泡石和石英,未检出镉,按22.5 t/hm2一次性施入)、腐植酸矿粉(H,含镉0.28 mg/kg,按45 t/hm2一次性施入),共5个处理。每个处理3次重复。单个处理小区面积为20 m2,采用覆塑料薄膜(埋深20 cm)的田埂分隔,随机区组排列。种植制度为中稻,水稻品种为“金优207”。在第一季水稻移栽前7 d,所有钝化剂一次性施入,然后人工耙匀,随后不再施用,按照当地种植习惯进行田间管理。
1.2 样品采集与测试
2007年施钝化剂前用不锈钢土钻采集各小区耕层土样,自然风干后分别过1mm和0.15mm尼龙筛,测定土壤的基本理化性质。2009年10月水稻收获后用不锈钢土钻采集各小区耕层土样,一部分自然风干后分别过1mm和0.15mm尼龙筛,测定土壤pH值、土壤有效态镉和土壤酶活性;一部分自然风干至含水量约40%,保存于4℃冰箱,用于测定土壤微生物生物量碳(Cmic)和微生物生物量氮(Nmic)。同时在采样现场将部分土样立即包装放入液氮中,回实验室保存于-70℃冰箱,用于T-RFLP分析。
土壤Cmic用氯仿熏蒸、0.5 mol/L K2SO4提取,TOC-500自动分析仪测定[16];土壤Nmic用氯仿熏蒸、0.5 mol/L K2SO4提取,流动注射分析仪测定[17];土壤脲酶活性用苯酚钠比色法测定,磷酸酶活性用磷酸苯二钠比色法测定,过氧化氢酶活性用高锰酸钾滴定法测定[18-19]。采用SDS-GITC-PEG法提取土壤微生物总DNA[20]。DNA的浓度和纯度用紫外分光光度计测定(Nanodrop,PeqLab,Germany)。
细菌16SrDNA基因PCR扩增正向引物为8F(5′-AGAGTTTGATCCTGGCTCAG-3′),反向引物为 926R(5′-CCGTCAATTC(A/C)TTTGAGTTT-3′),其中正向引物 5′端用6-羧基二乙酸荧光素(FAM)标记。50 μL的PCR反应体系组成如下:10×Taq DNA聚合酶缓冲液5.0 μL,MgCl22.5 mmol/L,dNTPs(each)0.2 mmol/L,正向和反向引物各 0.4 μmol/L,模板DNA100 ng,DNA聚合酶 Taq1(TaKaRa)1 U,ddH2O补水至 50 μL。PCR反应条件如下:95℃,5 min;40个循环为:(95 ℃,30 s;56 ℃,45 s;72 ℃,1 min);72 ℃延伸10min。真菌ITS片段基因PCR扩增正向引物为ITS1F(5′-CTTGGTCATTTAGAGGAAGTAA-3′),反向引物为 ITS4(5′-TCCTCCGCTTATTGATATGC-3′),其中正向引物 5′端用6-羧基二乙酸荧光素(FAM)标记。50 μL的PCR反应体系组成如下:10×Taq DNA聚合酶缓冲液5.0 μL,MgCl22.5 mmol/L,dNTPs(each)0.2 mmol/L,正向和反向引物各0.4 μmol/L,模板 DNA100 ng,DNA 聚合酶 Taq1(TaKaRa)1U,ddH2O补水至 50 μL。PCR 反应条件如下:95℃,5 min;40个循环为:(95 ℃,30 s;52 ℃,45 s;72 ℃,1 min);72 ℃延伸10 min。
扩增的PCR产物用PCR纯化试剂盒(天根生化科技(北京)有限公司,中国)纯化,方法按说明进行。纯化后的细菌和真菌产物分别用HhaⅠ和TagⅠ消化,反应体系50 μL,限制性内切酶 20U,10×buffer 5 μL,DNA 300 ng,ddH2O 补水至50 μL。37℃下酶切反应2 h,65℃下水浴10 min终止酶切反应。酶切产物送至上海桑尼生物技术有限公司进行自动测序分析(Model373A,Applied Biosystems,Weiterstadt,Germany)。
1.3 数据分析
T-RFLP图谱中每一个限制性片段(T-RF)作为一个OTU(operational taxonomic unit),T-RF片段大小±1 bp是同一个OTU,其丰度按照Thomas的方法计算[14],即以相对峰高值 (每个T-RF的峰高除以累计峰高值)作为OTU丰度,相对误差不超过10%。T-RFLP图谱中限制性片段(T-RF)范围在35 bp~550 bp,荧光值阈值超过100RFU,在平行实验的图谱中重复再现的峰纳入统计分析,片段相对丰度超过总T-RF丰度的10%定义为该样品细菌和真菌的优势种群。
采用Shannon多样性指数(Shannon Diversity,H):H=-Σ(pi)(Inpi)和均匀度指数(Evenness index,E):E=H/Hmax(其中Hmax=lnS)进行土壤真菌和细菌种群多样性分析,其中Pi代表属于某个OUT的个体在全部个体中的比例。
采用ANOVA法(P<0.05或 P<0.01,SPSS16.0)进行差异性检验;采用Canoca for windows 4.5软件对细菌和真菌群落进行冗余分析(RDA)。
2 结果与讨论
2.1 施用钝化剂对土壤酶活性和土壤微生物生物量的影响
酶作为土壤的重要活性物质参与了土壤中的各种生化反应,其活性大小可反映土壤的综合肥力特征与土壤养分转化进程。由图1可以看出,不同钝化剂处理土壤的脲酶(图1a)和磷酸酶(图1b)的活性变化区间分别在0.09 mg/g·h~0.23 mg/g·h和 1.83 PNP mg/g·h~ 3.16 PNP mg/g·h之间,但各处理间的差异均未达到显著水平。施用海泡石显著提高了土壤过氧化氢酶的活性(与CK相比提高19.0%,P<0.05),其他处理对过氧化氢酶活性未产生显著影响(图1c)。Lee等研究施用钝化剂修复矿山污染土壤重金属时发现,施用钝化剂显著降低了土壤重金属的有效性,进而引起土壤脲酶、磷酸酶和过氧化氢酶活性等土壤微生物性状的改善[21]。前期研究结果表明施用钝化剂显著降低了土壤镉的有效性[7],但对土壤脲酶、磷酸酶和过氧化氢酶活性的影响有限,这可能是因为本研究的土壤镉污染程度相对较低,镉有效性降低对酶活性的影响有限所致。有研究指出,土壤pH值降低可能是导致过氧化氢酶活性降低的原因[22],在本研究中,海泡石处理显著提高了土壤pH值[7],可能是其过氧化氢酶活性提高的主要原因。
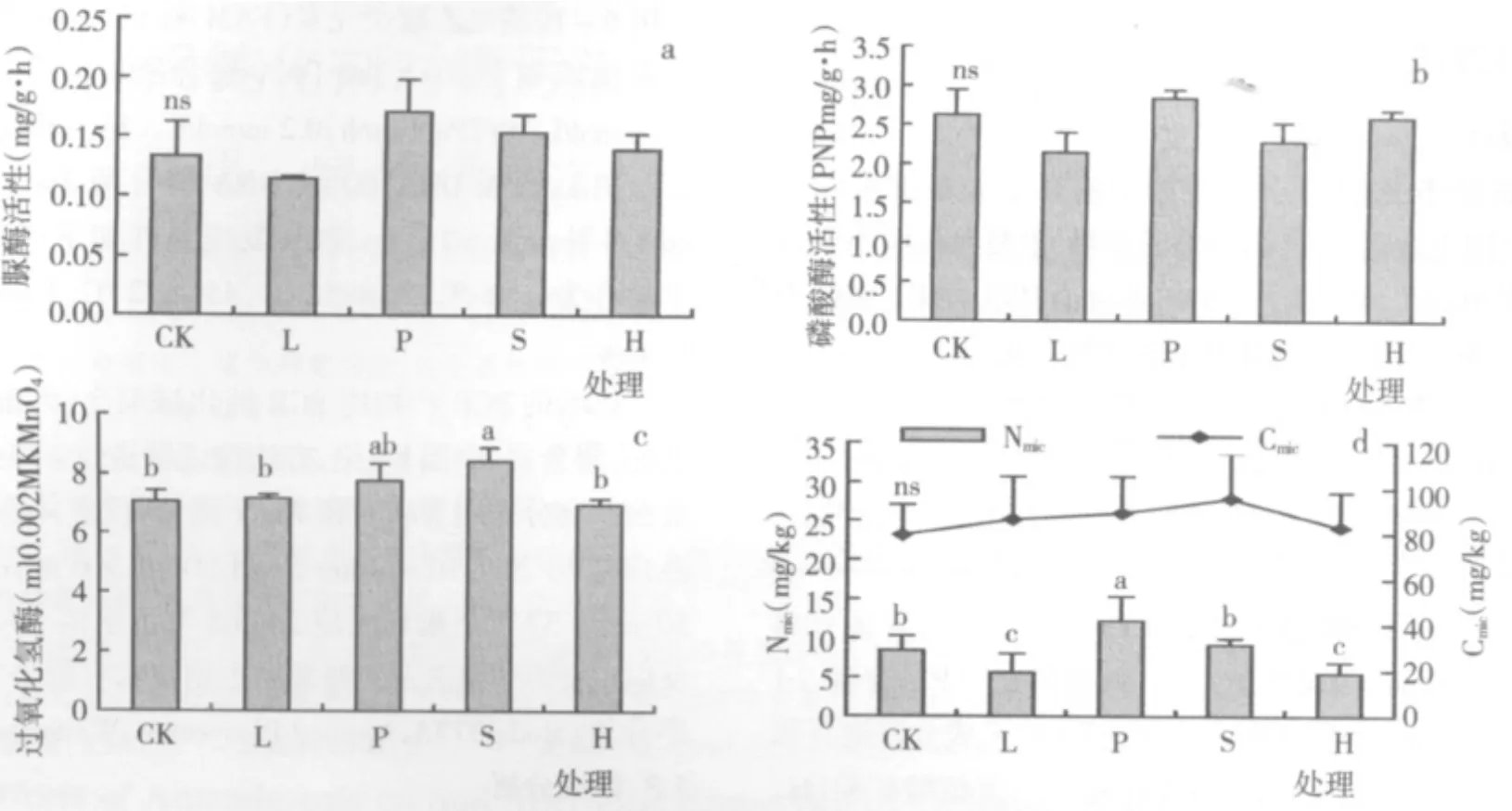
图1 施用钝化剂对土壤脲酶(a)、磷酸酶(b)、过氧化氢酶(c)、微生物生物量(d)的影响
土壤微生物生物量是反映土壤环境质量的重要微生物学参数,对人为活动、重金属污染等外界条件的变化反应比较敏感。由图1(d)可以看出,施用钝化剂后土壤Cmic呈升高趋势,但处理间差异并未达到显著水平,这与前人的研究结果是一致的[23,24]。然而,施用石灰和腐植酸矿粉后土壤Nmic显著降低,降低幅度分别为33.0%和33.8%,施用钙镁磷肥则使土壤Nmic显著提高(增幅44.9%)。进一步分析发现,施用石灰和腐植酸矿粉显著提高了Cmic/Nmic,而施用钙镁磷肥则显著降低了Cmic/Nmic。这表明供试4种钝化剂在修复镉污染稻田过程中,虽然对土壤微生物生物量影响有限,但可能改变了土壤微生物种群结构。
2.2 施用钝化剂对土壤微生物种群结构的影响
由于核苷酸序列具有多态性,所以同一个基因的DNA片段在相同的酶切后可能得到长度不同的T-RF,通过对T-RF以及由此生成的T-RFLP图谱的分析,可以揭示样品中微生物的种类和数量等信息,从而解析微生物群落的结构及其动态变化[25]。大多数情况下,可以粗略的认为每个T-RF对应着一个微生物物种。利用限制性内切酶Hha I和Taq I酶切的T-RFLP图谱,根据末端限制性片断的数目及其丰度,分别计算了不同钝化剂处理稻田土壤细菌、真菌香农指数(Shannon)和均匀度指数(Evenness)。结果表明(表 2),细菌Shannon指数介于3.83~4.23之间,Evenness指数介于0.85~0.96之间;真菌Shannon指数介于4.11~4.48之间,Evenness指数介于0.79~0.94之间。施用钝化剂后的土壤细菌和真菌Shannon指数和Evenness指数均呈降低趋势,其中海泡石和腐植酸矿粉处理的真菌Shannon指数显著低于对照,海泡石、腐植酸矿粉和钙镁磷肥处理的Evenness指数显著低于对照。可见,施用钝化剂显著降低了土壤真菌的多样性。
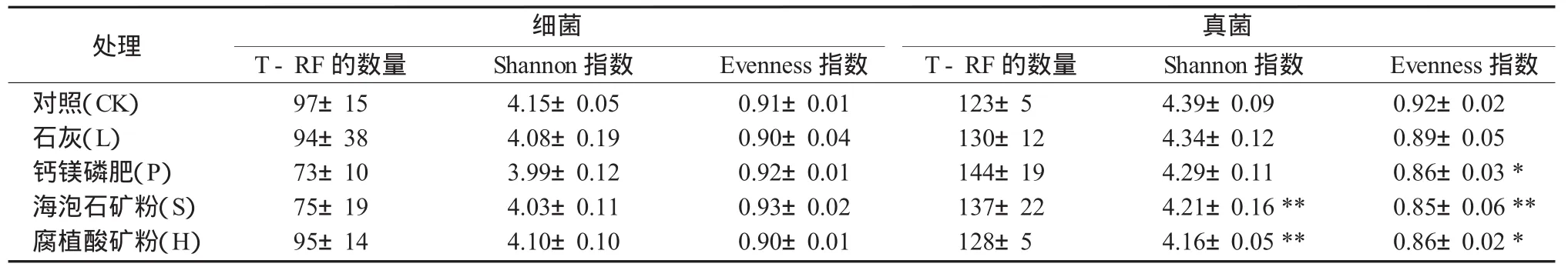
表2 钝化剂对镉污染稻田土壤细菌和真菌多样性的影响
用Hha I和Tag I酶切细菌和真菌DNA后分别检测到21和27个相对丰度大于1%的T-RF(图2)。由图2a可知,施用钝化剂后土壤细菌的T-RF均出现了新增片段,其相对丰度占总T-RF的比例在18%~30%之间,虽然未出现原有T-RF的缺失,但其相对丰度都有不同程度的降低,如36bp、92bp、59bp和106bp等。由图2b可知,施用钝化剂后真菌缺失了部分T-RF(52bp、55bp、270bp等),同时新增了部分T-RF,其相对丰度占总T-RF的比例在9%~31%之间。由此可见,钝化剂储备性施用修复镉污染稻田使土壤细菌和真菌种群结构均发生明显变化,这也验证了土壤微生物生物量变化的结果。Karaca等发现添加50 mg/kg镉培育的污染土壤(砂壤土)施用污泥和磷肥后,细菌和假单胞菌的种群丰度显著提高[26]。还有研究发现,在铅、镉和锌复合污染酸性土壤上施用红泥、石灰和沸石能够有效提高土壤微生物种群丰度(Biolog法)[27]。这与本研究的结果不同,可能因为其研究的土壤重金属污染程度极高,重金属对土壤微生物的毒害作用更强,施用钝化剂后重金属有效性显著降低,进而改善了土壤微生物性状。重金属污染程度相对较轻的土壤(如本试验)施用钝化剂后对土壤微生物性状的改善作用可能相对较弱。Mench等研究也表明镉、镍污染程度不高的土壤采用棕闪岩和铁砂作为钝化剂,对细菌丰度无显著影响[24]。
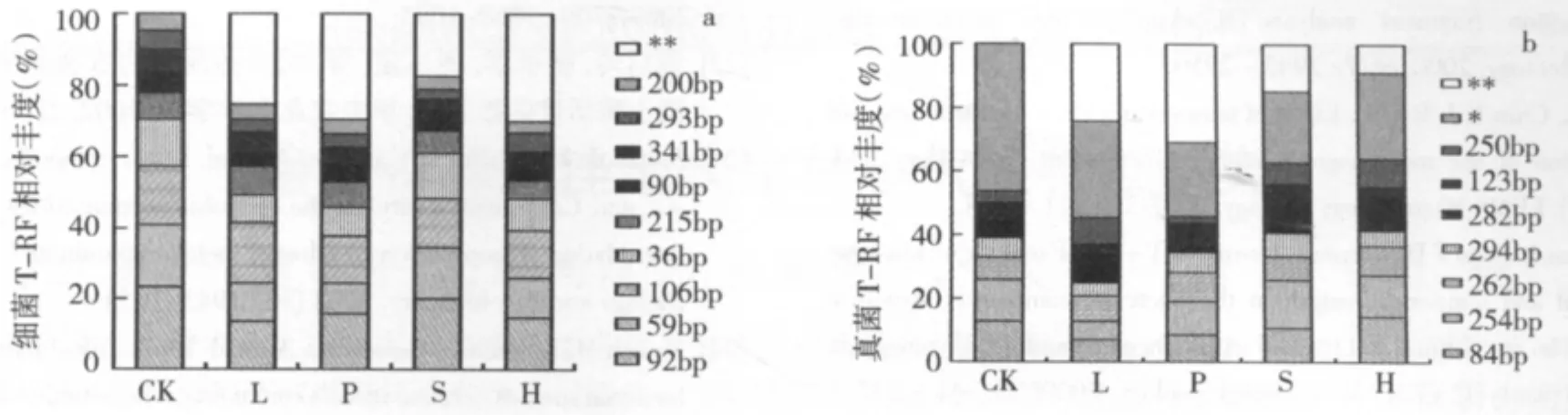
图2 钝化剂对镉污染稻田土壤细菌(a)、真菌(b)T-RF相对丰度的影响
2.3 环境因素对土壤细菌和真菌分布的影响
通过冗余分析(Canoco4.5软件)土壤细菌和真菌群落结构与土壤环境因子间的关系,探讨了施用钝化剂对土壤细菌和真菌群落结构产生影响的机理。结果表明,有效态镉和pH值显著影响土壤细菌群落(图3a,P值分别为0.002和0.032),Nmic、pH值和有效态镉显著影响土壤真菌群落(图3b,P值分别为0.002、0.002、0.008)。我们前期的研究结果表明,石灰、钙镁磷肥、海泡石和腐植酸矿粉主要通过提高土壤pH值,进而降低土壤中镉的有效性的。由此可见,土壤pH值变化可能是引起土壤细菌和真菌群落结构发生变化的原因。李江涛等[28]也发现土壤pH值变化是真菌群落的主要影响因素;袁红朝等[29]的研究结果表明,土壤pH值变化会导致土壤中对环境变化敏感的细菌种群丰度发生变化。

3 结论
通过田间小区试验研究发现,储备性施用钝化剂修复镉污染稻田,对土壤微生物生物量碳和脲酶、磷酸酶及过氧化氢酶活性的影响较小,但施用石灰和海泡石使土壤Nmic显著降低,而施用钙镁磷肥使Nmic则显著提高;T-RFLP的分析结果显示,钝化剂储备性施用使土壤T-RF的丰度发生了显著变化,出现部分T-RF的缺失和新T-RF的产生,土壤细菌和真菌的多样性指数均呈降低趋势,这表明施用钝化剂修复镉污染稻田显著改变了土壤细菌和真菌的种群结构,土壤pH值是影响细菌和真菌群落组成的主要因素。然而,施用钝化剂后缺失的T-RF和新增的T-RF对应的真菌和细菌种类尚不清楚,其功能也未知,需要进一步开展研究。
[1]张红振,骆永明,章海波,等.土壤环境质量指导值与标准研究Ⅴ.镉在土壤——作物系统中的富集规律与农产品质量安全[J].土壤学报,2010,47(4):628-638.
[2]ZhaoX,Saigusa M.Fractionation and solubility of cadmium in paddy soils amended with porous hydrated calcium silicate[J].Journal of Environmental Sciences,2007(19):343-347.
[3]Giovanni G,Paola C,Laura S,et al.Influence of red mud,zeolite and limeon heavymetal immobilization,culturable heterotrophic microbial populationsand enzymeactivitiesin acontaminated soil[J].Geoderma,2007(142):47-57.
[4]Li P,Wang X,Zhang T,et al.Effects of several amendments on rice growth and uptake of copper and cadmium from a contaminated soil[J].Journal ofEnvironmental Sciences,2008(20):449-455.
[5]曹仁林,霍文瑞,何宗兰,等.钙镁磷肥对土壤中镉形态转化与水稻吸镉的影响[J].重庆环境科学,1993,15(6):6-9.
[6]陈晓婷,王果,梁志超,等.钙镁磷肥和硅肥对Cd、Pb、Zn污染土壤上小白菜生长和元素吸收的影响[J].福建农林大学学报(自然科学版),2002,31(1):109-112.
[7]朱奇宏,黄道友,刘国胜,等.钝化剂对镉污染酸性水稻土的修复效应与机理研究[J].中国生态农业学报,2010,18(4):845-851.
[8]KirkhamMB.Cadmiuminplantsonpollutedsoils:Effectsofsoilfactors,hyperaccumulation,andamendments[J].Geoderma,2006(137):19-32.
[9]Jin H P,Dane L,Periyasamy P,et al.Role of organic amendments on enhanced bioremediation of heavy metal(loid)contaminated soils[J].Journal ofHazardous Materials,2011(185):549-574.
[10]Asc1Y,Nurba,M,SagˇAY.AcomparativestudyforthesorptionofCd(II)by K-feldspar and sepiolite as soil components,and the recovery of Cd(II)using rhamnolipid biosurfactant[J].Journal of Environmental Management,2008(88):383-392.
[11]黄昌勇.土壤学[M].北京:中国农业出版社,2000:192-214.
[12]John D,Ticknor LO,Kuske CR.Assessment ofmicrobial diversityin four southwestern United States soils by 16S rRNA gene terminalRestriction fragmentanalysis[J].Applied and Environmental Microbiology,2000,66(7):2943-2950.
[13]Wu X,Chin K J,Ralf C.Effect of temperature stress on structure and function of the methanogenic archaeal community in a rice field soil[J].FEMSMicrobiologyEcology,2002(39):211-218.
[14]ThomasL,PeterFD,WernerL.UseoftheT-RFLPtechniquetoassess spatial and temporal changes in the bacterial community structure withinanagriculturalsoilplantedwith transgenicand non-transgenic potatoplants[J].FEMSMicrobiologyEcology,2000(32):241-247.
[15]John D,Ticknor L O,Kuske C R.Phylogenetic Specificity and reproducibility and new method for analysis of terminal restriction fragment profiles of 16S rRNA genes from bacterial communities[J].Applied and Environmental Microbiology,2001,6(1):190-197.
[16]Vance E D,Brookes P C,Jenkinson D S.An extraction method for measuringsoil microbial biomass C[J].Soil Biologyand Biochemistry,1987(19):703-707.
[17]Brookes P C,Landman A,Pruden G.Chloroform fumigation and the releaseofsoilnitrogen:Arapid extraction method tomeasure microbial biomass nitrogen in soil[J].Soil Biology and Biochemistry,1985,17(6):837-842.
[18]关松荫.土壤酶及其研究方法[M].北京:中国农业出版社,1986.
[19]周礼恺.土壤酶学[M].北京:科学出版社,1987.
[20]Chen Z,LuoX,Hu R,et al.Impact of Long-termfertilization on the composition of denitrifier communities based on nitrite reductase analysesinapaddysoil[J].MicrobialEcology,2010,60(4):850-861.
[21]LeeSH,LeeJS,ChoiYJ,etal.Insitustabilizationofcadmium-,lead-,andzinc-contaminatedsoilusingvariousamendments[J].Chemosphere,2009,77(8):1069-1075.
[22]谭启玲,胡承孝,周后建,等.城市污泥中的重金属形态及其对潮土酶活性的影响[J].华中农业大学学报,2002,21(1):36-39.
[23]Suhadolc M,Schroll R,Gattinger A,et al.Effect ofmodified Pb-,Zn-,and Cd-availability on the microbial communities and on the degradation of isoproturon in a heavy metal contaminated soil[J].Soil Biologyand Biochemistry,2004(36):1943-1954.
[24]Mench M,Renella G,GelsominoA,et al.Biochemical parameters and bacterialspeciesrichnessinsoilscontaminatedbysludge-bornemetals and remediated with inorganic soil amendments[J].Environmental Pollution,2006(144):24-31.
[25]KnightBP,McGrathSP,ChaudriAM.Biomassandsubstrateutilization patterns of microbial populations from soils amended with cadmium,copper,or zinc[J].Applied and EnvironmentalMicrobiology,1997(63):39-43.
[26]KaracaA,NasebyDC,LynchJM,etal.Effectofcadmiumcontamination withsewagesludgeandphosphatefertiliseramendmentsonsoilenzyme activities,microbial structure and available cadmium[J].Biology and FertilityofSoils.2002(35):428-434.
[27]Garau G,Castaldi P,Santona L,et al.Influence ofred mud,zeolite and limeonheavymetalsimmobilizationculturableheterotrophicmicrobial population and enzyme activities in a contaminated soil[J].Geoderma,2007(142):47-57.
[28]李江涛,钟晓兰,刘勤,等.长期施用畜禽粪便对土壤生物化学质量指标的影响[J].土壤,2010,42(4):526-535.
[29]袁红朝,秦红灵,刘守龙,等.长期施肥对红壤性水稻土细菌群落结构和数量的影响[J].中国农业科学,2011,44(22):4610-4617.
