系统性红斑狼疮伴颅内环形强化病灶
2012-07-09全军肾脏病研究所学术委员会
全军肾脏病研究所学术委员会
病例摘要
病史患者女性,34岁,因“关节痛10年,发热伴血小板(PLT)减少、血清肌酐(SCr)升高1月”,于2011-01-25入院。
患者2001年出现双手关节肿痛、面部红斑、口腔溃疡和脱发,尿检阴性,血常规不详,ANA、抗dsDNA及抗Sm抗体阳性,诊断“系统性红斑狼疮(SLE)”,予甲泼尼龙(MP)静脉滴注20余日(剂量不详),后续泼尼松及甲氨蝶呤、氯喹、环磷酰胺(具体不详)治疗,1月后上述症状缓解,两年后自行停药,未复诊。2010年12月下旬劳累后出现发热,体温达39℃,伴畏寒、咳嗽,咳少许黄痰,无胸闷、咯血,逐渐出现全身水肿,腹胀、尿量减少,面部红斑、双手关节肿痛,测血压200/100 mmHg,尿蛋白3+,尿隐血3+,白蛋白 21.1 g/L,SCr 206 μmol/L,全血细胞减少[白细胞计数(WBC) 1.9×109/L,血红蛋白(Hb) 101 g/L,PLT 12×109/L],多种自身抗体(ANA、抗SSA、SSB、RNP)阳性,补体低(C3 0.36 g/L,C4 0.03 g/L),血培养示产气肠杆菌,痰培养示大肠埃希菌,肺部CT示两肺斑片影,胸腔积液,心脏超声示心包积液,予拜复乐、罗氏芬、舒普深抗感染(具体不详),MP 80 mg/d×7d,静脉用人免疫球蛋白(IVIg)20 g/d×7d治疗,及降压、利尿对症处理。治疗10d后体温恢复正常,咳嗽咳痰好转,复查血培养阴性,血压仍波动于160~180/90~100 mmHg,水肿加重,尿量仅600 ml/24h,SCr逐渐升至404 μmol/L,Hb 69 g/L,PLT 46×109/L,关节肿痛缓解,面部红斑减轻。病程中无肉眼血尿,无神志异常,无头痛头昏,无视物模糊,食欲较差,有恶心,无呕吐,无腹痛,精神睡眠欠佳,体重增加15 kg。
既往史:20余岁时曾患急性黄疸性肝炎,已治愈。个人史、婚育史无特殊。
家族史:母亲患“类风湿关节炎”,现双手关节畸形,尿检、肾功能不详。
体格检查体温36.7℃,脉搏88次/min,呼吸14次/min,血压178/100 mmHg,脉氧100%,神清,精神欠佳,皮肤针刺部位片状淤斑,双侧面颊部可见片状陈旧性红斑,咽不红,扁桃体不肿大,双肺呼吸音粗,未闻及干湿性啰音,心律齐,未闻及杂音,腹膨隆,无压痛及反跳痛,移动性浊音阳性,双下肢对称性中度水肿。四肢无活动障碍,无关节肿痛。生理反射存在,病理反射未引出。
实验室检查
尿液 蛋白定量3.42 g/24h,红细胞计数1 100 万/ml,多形型,白细胞 2~4/HP,C3 3.11 mg/L,α2巨球蛋白(α2-MG) 2.78 mg/L,N-乙酰-β-D-氨基葡萄糖苷酶(NAG) 94.7U/(g·Cr),视黄醇结合蛋白(RBP)12.21 mg/L;尿淀粉酶287 μ/L,尿胰蛋白酶原2阳性;
血常规 Hb 73 g/L(正细胞正色素),WBC 4.6×109/L,PLT 22×109/L,网织红细胞(Ret) 5.5%,C反应蛋白(CRP) 0.1 mg/L;
凝血功能 活化部分凝血活酶时间27.1s,凝血酶原时间16.1s,凝血酶时间19.9s,国际标准化比值(INR)1.41,纤维蛋白原237 mg/dl,D二聚体 0.92 mg/L;
血生化 白蛋白30.7 g/L,球蛋白28.7 g/L,谷丙转氨酶9 U/L,谷草转氨酶28 U/L,胆红素正常,乳酸脱氢酶(LDH) 389 U/L;尿素氮74.11 mmol/L,SCr 403.99 μmol/L,尿酸865 μmol/L,钾4.52 mmol/L,钠138.1 mmol/L,氯106.7 mmol/L,二氧化碳结合力13.9 mmol/L,淀粉酶高174 U/L,脂肪酶1 092 U/L;
免疫学 ANA 1:256,ds-DNA 1:10,抗Sm抗体++,抗SS-A 抗体++,抗C1q抗体 160.86 U/ml,MPO-ANCA阴性,PR3-ANCA 88.71 RU/ml,抗磷脂抗体(ACL)、狼疮抗凝因子(LA)、类风湿因子、Coomb’s试验阴性,补体C3 0.271 g/L,C4 0.046 2 g/L;免疫球蛋白IgG 17.5 g/L,IgA 1.78 g/L,IgM 0.833 g/L;淋巴细胞CD3 156个/μl,CD4+59个/μl,CD8+84个/μl,CD20+14个/μl,Treg 1个/μl;HLA-DR 23.2%。乙肝HBc、HBe、HBsAb阳性,HBV-DNA阴性;丙肝IgG阴性。
内皮细胞损伤标记物 循环内皮细胞41个/ml,血管细胞黏附分子(VCAM) 1 656.60 ng/ml,血管性假血友病因子(vWF) 196.6%,血栓调节蛋白 25.88 ng/ml,E选择素36.42 ng/ml,AECA 阴性。
其他 红细胞碎片>10枚/片;血管性血友病因子裂解酶(ADAMTS13)活性20.17%(正常为 100%,苏州血液病研究所);骨髓细胞及组织活检:骨髓轻度增生低下。
辅助检查肾脏B超:左119 mm×53 mm×59 mm,右115 mm×43 mm×57 mm,皮质回声稍增强,皮髓界限清楚,集合系统正常。胸部平片及CT未见异常。心电图:窦性心律,低电压趋势。腹部B超:胆内强回声光团,泥沙样结石,腹水。腹部CT:胰周脂肪间隙模糊伴双肾筋膜增厚。
诊疗经过
第一阶段 患者SLE诊断明确,入院时狼疮高度活动,存在以下问题:(1)血栓性微血管病(TMA),溶血性贫血(Ret、LDH高,红细胞碎片阳性,Coomb’s试验阴性)伴PLT少,急性肾功能不全、恶性高血压,ADAMTS13酶活性下降;(2)高度水肿,有效容量不足,院外激素治疗后高分解代谢、氮质血症;(3)支气管出血:凝血时间延长,出现咯血,监测Hb无明显下降,胸部CT无异常;(4)急性胰腺炎:血、尿淀粉酶高,尿胰蛋白酶原2(+),CT示胰腺均匀弥漫水肿渗出,符合急性胰腺炎。患者无消化道症状及腹部体征,无黄疸、无胆管梗阻,查消化道钡餐亦无异常,排除胆源性或十二指肠息肉梗阻性胰腺炎,结合全身狼疮活动明显,考虑急性胰腺炎为狼疮活动所致。立即行床边无肝素连续性血液净化(CRRT)治疗,MP 500 mg/d静脉滴注,输注洗涤红细胞、血浆,予维生素K1、血小板生长因子,禁食、胃肠减压、抑酸、生长抑素、肠外营养降压及吸氧等支持治疗。1d后咯血停止,凝血功能恢复正常。后续MP冲击,血浆置换(PE)及持续MP 40~80 mg/d治疗,PLT逐渐恢复正常,复查ADAMTS13酶活性升至47.72%(图1),1周后过度至鼻肠管肠内营养。

图1 血小板(PLT)变化
第二阶段 入院后第4天,出现阵发性视物倒置,约持续2 min症状自行缓解,共发作三次,无其他伴随症状及神经系统定位体征。
实验室检查:血培养、血厌氧菌培养阴性;降钙素正常,内毒素 10.35 pg/ml(参考值<10 pg/ml);(1-3)-β-D-葡聚糖(G)试验 4.9 pg/ml(参考值<10 pg/ml),半乳甘露聚糖(GM)试验0.28 pg/ml(参考值<0.5 pg/ml),血清隐球菌抗原阴性;大便常规:真菌阳性。
影像学检查(2011-01-28):头颅CT示右侧额叶低密度影。头颅MRI平扫示右侧额叶异常信号(点片状长T1长T2信号,边缘模糊,于T2-FLAIR像显示更清晰,边缘模糊,DWI呈稍高信号,ADC部分呈低信号),考虑炎性肉芽肿性病变,脑脓肿。MRI增强示右侧额叶病灶呈环状强化,大小约6.5 mm×9 mm,脑膜可见明显强化,考虑脑脓肿(图2A)。
脑脊液(CSF)检查:压力150 mmH2O,无色、清亮,白细胞2个/ul,红细胞0,革兰染色及抗酸染色阴性,新生隐球菌阴性,潘氏实验阴性。生化:氯 120 mmol/L,糖 4.3 mmol/l,蛋白0.22 g/L。免疫学:ANA阴性,IgA<0.011 g/L,IgE<20 IU/ml,IgM<0.007 g/L。
脑电图:以8~9 Hz α波为基本节律,25~50 uV左右对称,调幅节律性见好,各区散在多量5~6 Hz θ波,60W及额区较多量13~14 Hz β波;HV:同上改变;OC:α抑制完全。结论:异常脑电图。
用美罗培南(1.0g,1/12h)加强抗感染,大扶康静脉滴注预防真菌感染。6周后患者狼疮活动性病变改善:(1)PLT正常(图1);(2)复查CT胰腺无明显水肿渗出,监测血淀粉酶稳定,但仍未下降至正常,继续鼻肠管肠内营养;(3)尿量逐渐增加,SCr逐渐下降(图3),摆脱肾脏替代治疗,肾活检示狼疮性肾炎(LN)IV型伴TMA(图4);(4)免疫学指标好转(自身抗体滴度下降,补体上升)(表1)。但复查头颅病灶无改善(图2)。
患者一直无发热,无神经系统症状体征,停抗感染药物,鉴于不能排除颅内感染性病变,全身狼疮活动未完全控制,肾活检提示仍存在活动性病变,予IVIg 20g×5d治疗,并续激素联合吗替麦考酚酯(MMF)治疗1.5月,再加用他克莫司(FK506)治疗1.5月。
上述治疗后患者病情变化如下:(1)SCr下降稳定至159.12 μmol/L,尿检明显改善,免疫学指标自身抗体转阴性,补体正常(表1);(2)监测淀粉酶正常,拔鼻肠管,恢复正常进食;(3)随访中一直无明显神经系统症状体征,但多次复查颅内病灶较前增大,性质不明(图2)。

图2 A~E:右侧额叶病灶逐渐增大(头颅MRI,A:2011-01-28,B:2011-03-02,C:2011-03-31,D:2011-05-17,E:2011-06-17);F:颅内病灶切除术后(头颅CT,2011-06-18)

表1 治疗期间病情变化
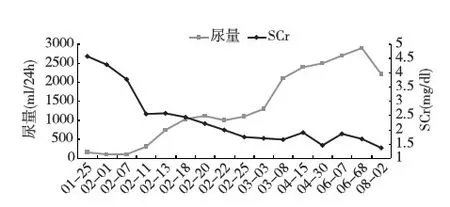
图3 尿量和血清肌酐(SCr)的变化

图4 肾组织病理:狼疮性肾炎Ⅳ型伴血栓性微血管病(TMA),血管TMA病变(↑)(A: PAS,×200;B: PASM-Masson,×400)
诊断分析中年女性,病程10余年。以皮肤、关节损害起病,多种自身抗体阳性,补体低,SLE诊断明确。曾予激素联合免疫抑制剂治疗2年,病情稳定。停药8年,入院前1月SLE复发合并肺部感染、脓毒血症,院外经多种药物抗感染治疗,感染控制,虽经MP及IVIg治疗,SLE仍高度活动。
入院时患者病情危重,临床经过复杂,存在多系统损害。(1)肾脏:少尿型急性肾功能不全伴大量血尿、大量蛋白尿,高血压,肾活检示LN-Ⅳ型伴TMA;(2)血液系统:溶血性贫血伴PLT减少;(3)支气管出血;(4)急性胰腺炎;(5)颅内环形强化灶,性质不明;(6)免疫学指标:多种自身抗体阳性,补体低。
针对上述病情予以下治疗:(1)CRRT:减轻容量负荷、改善氮质血症,保证后续治疗进行;(2)补充凝血因子及MP冲击,改善凝血功能,PLT升高,短期内控制了危及生命的支气管出血;(3)美罗培南及大扶康抗感染治疗,颅内病灶尚稳定的情况下,同时MP冲击联合PE、IVIg治疗控制SLE的多器官损害;(4)对症、鼻肠管肠内营养,全身支持治疗。经上述治疗后患者PLT恢复正常,贫血改善;胰腺炎治愈,恢复正常进食;尿量增加,SCr下降,逐渐摆脱透析,尿检改善;自身抗体转阴,补体正常。但多次复查颅内病灶较前增大,病灶性质不明,需要就以下疾病进行鉴别诊断。
神经精神狼疮(NPSLE) 在全身狼疮高度活动的情况下发现颅内病灶,首先需鉴别NPSLE。SLE累及中枢神经系统(CNS)常伴头痛、认知障碍、癫痫、脑血管病等,伴抗磷脂抗体综合征者发生NPSLE的风险高,MRI影像学改变多为位于皮质下和白质室周的T2相高密度小病灶,常见轻度脑脊液淋巴细胞增多、蛋白水平升高和葡萄糖水平下降[1]。本例患者病程中仅出现一过性视物倒置,无其他神经系统的症状体征,ACL及LA阴性,脑脊液检查正常,影像学改变仅为单发的颅内环形强化病灶,与典型的NPSLE不符。经积极治疗,患者无全身狼疮活动,各器官损害改善,但颅内病灶却较前增大,不符合NPSLE的转归。
脑肿瘤 患者虽存在颅内占位性病变,但无发热,在3月内增大5倍,不能排除颅内原发或转移瘤。
颅内感染 本例患者头颅MRI表现为特征性的环形强化灶,其病原体可能:(1)细菌性脑脓肿:患者入院前1月并发肺部感染、脓毒症,病原菌可经血源性途径进入颅内形成脑脓肿。考虑药物通过血脑屏障的能力,予美罗培南抗感染,及大扶康预防真菌。但患者一直无发热,病原学检查也无阳性发现,脑脊液检查也无颅内感染的征象,可能与病灶包裹局限有关。抗感染治疗6周,复查MRI病灶无改善,不符合大多细菌性脑脓肿,但不能排除为美罗培南不敏感的细菌。(2)真菌脑脓肿:患者抗菌治疗无效,免疫功能低下,CD4+淋巴细胞仅59个/ul,无明显感染中毒症状,需考虑真菌感染。颅内真菌感染最常见于念珠菌和新生隐球菌,但大扶康治疗6周无效,需高度考虑大扶康不能涵盖的曲霉菌感染。单纯颅内曲霉菌感染的少见,大部分同时存在其他脏器如肺部的曲霉菌感染或来源于鼻窦,影像学检查为颅内多发病灶[2]。本例患者无颅外器官曲霉菌感染,多次影像学检查无鼻窦炎,颅内单个病灶,多次查GM试验阴性,无曲霉菌感染的线索。但少数曲霉菌感染也可表现为单纯颅内的单发病灶[3]。(3)颅内结核球:患者无其他部位的结核病灶,无慢性消瘦、发热等全身消耗症状,头颅影像检查未见钙化灶,但也有单纯局限于颅内的结核球,临床不能排除;(4)脑囊虫:链状带绦虫的幼虫寄生于脑部,多同时寄生于皮下及肌肉等多个组织,临床表现复杂多样,如癫痫、头痛、脑膜炎等,也可一直无明显临床症状,影像学检查也常见多发病灶。本例患者脑外其他部位未发现囊肿感染,多次粪常规检查未发现寄生虫,影像学检查仅单个病灶,但仍不能完全排除。
第三阶段治疗鉴于患者无临床症状,停抗菌药继续观察。在全身狼疮活动性病变控制及多个器官功能改善后,多次复查头颅病灶增大,于6月18日开颅脑活检。术中见质硬边界清楚,直径约3 cm大小的病灶,抽出灰白色浓稠液体,术中快速冰冻切片病理示“霉菌性肉芽肿”,予病灶全切术;切除标本病理示“曲霉病”(图5);培养示“烟曲霉菌”。

图5 颅内病灶:脑组织内多灶性坏死及肉芽肿形成,坏死灶内见霉菌呈灶性分布,可见孢子及菌丝,有隔,分枝较多见(HE,×200)
最后诊断(1)SLE(累及肾脏、血液系统、胰腺、关节及皮肤),LN-IV型伴TMA;(2)颅内烟曲霉菌感染。
随访患者经激素联合MMF及FK506治疗3月后,病情稳定,无狼疮活动,SCr下降,仅少量血尿,蛋白尿,免疫学指标自身抗体阴性,补体正常,但仍需长期激素及免疫抑制剂维持治疗,颅内病灶为感染性质,虽经手术切除,但仍需警惕感染再发。故调整免疫抑制剂为小剂量的激素联合雷公藤多苷片(TW)治疗,并建议伏立康唑口服继续药物抗曲霉菌治疗。1月后随访,SCr继续下降,尿检稳定(表1);复查头颅MRI未见颅内病灶复发;复查真菌G试验和GM试验均正常,复查胸部CT正常,无颅外真菌感染的征象。
讨 论
颅内曲霉菌感染的诊断本例SLE患者,病情危重,临床经过复杂,尤其是颅内病灶的诊断困难。虽病程中仅出现一过性的视物倒置,无其他神经系统伴随症状及体征,血清及脑脊液检查均无明显异常,头颅MRI示右侧额叶环形强化灶,予美罗培南及大扶康治疗无效,颅内病灶增大,最终经脑活检病理及组织培养才得以确诊颅内病灶烟曲霉菌感染,手术切除病灶后病情缓解。
颅内曲霉菌感染占CNS感染的5%[4],以烟曲霉菌最常见。免疫缺陷患者单发或多发的脓肿具有明显的血管侵袭性,伴或不伴血栓,是颅内曲霉菌感染的特点[2]。颅内曲霉菌感染大部分源于肺、肝、脾等脏器曲霉菌感染的血行播散,或鼻窦、中耳、眶部感染的直接侵犯,亦有1/4单纯为颅内感染[3],其临床表现多样,缺乏特异性。单纯脑实质内曲霉菌感染者常无明显全身反应,以头痛为首发症状;若无病变体积大、颅内占位效应重,头痛可自发缓解;若局部形成脑膜炎,则出现具定位意义的头痛。本例患者无颅外曲霉菌感染,术前病灶已增大,出现中线移位,但无临床症状,诊断难度增加。
早期颅内曲霉菌感染,CT或MRI难以发现病灶。MRI影像改变多样[5],表现为与曲霉菌侵入血管分布一致的不规则梗死病灶,可发生于颅内任何部位的多灶性、多形态性损害;有的为梗死后脓肿形成环形强化病灶,曲霉菌脓肿在T1WI相为低信号,T2WI相为高信号,烟曲霉菌脓肿环形强化壁常较厚;有的来源于鼻窦或眼眶的伴硬脑膜或血管浸润;还有颅内(中轴内或外)占位性病变。本例患者颅内为单发病灶,而非典型的颅内曲霉菌感染的MRI表现,但颅内病灶在T1WI上为低信号,T2WI上为高信号伴有明显的环形强化壁还是与颅内曲霉菌感染的MRI表现一致。
颅内曲霉菌感染CSF分析无特异性,可有细胞计数增多,蛋白高,葡萄糖低。CSF培养常阴性,CSF中常只有少量的真菌,需要大量(至少5 ml)的CSF反复培养才可能有阳性结果。检测CSF曲霉菌DNA可能有助提高颅内曲霉菌感染的诊断[6]。GM试验对免疫缺陷患者的侵袭性曲霉菌感染准确度中等[7]。本例患者CSF无异常发现,GM试验正常,实验室检查对诊断帮助不大。
颅内曲霉菌感染确诊需要组织病理学证据和(或)组织培养阳性。任何影像检查提示颅内占位病变伴或不伴临床症状和体征的免疫缺陷患者均应警惕颅内曲霉菌感染。本例患者在临床、血清及脑脊液检查无特异性,颅内病灶性质难以明确,最后经颅内病灶活检才得以明确诊断。有作者总结了常规临床、影像学及实验室检查不能确诊的16例CNS感染病例进行了脑活检,均于术中冰冻病理切片快速明确了诊断,及时确定治疗方案[8],提示对临床、影像和实验室检查等常规方法无法确诊病例,建议及早采取脑组织活检,以免延误诊治。
SLE合并颅内曲霉菌感染本文报道1例重症SLE合并颅内曲霉菌感染病例。SLE合并颅内曲霉菌感染为少见病例,多为个案报道。Chen等[9]回顾分析15例SLE并发侵袭性真菌感染的患者,其中颅内真菌感染10例,主要为新生隐球菌,仅1例为曲霉菌。上海瑞金医院报告10年间有38例SLE并发CNS感染,其中曲霉菌感染1例,起病隐匿,临床无特异表现,分析发现SLE伴CNS感染的较无CNS感染的血清白蛋白水平更低,平均激素的用量更大[10]。Naidech[11]报道了一例非粒细胞减少的SLE患者接受激素治疗时出现发热、头痛和癫痫,CT显示颅内环形强化病灶,经脑活检诊断为曲霉菌感染,但经积极治疗,患者仍未能存活,尸检时发现还同时存在曲霉菌心内膜炎。Nenoff等[12]报道1例SLE接受大剂量激素及抗生素治疗并发包括CNS受累的急性致死性播散性曲霉菌感染。
SLE患者长期接受激素和免疫抑制剂治疗抑制了机体的炎症反应[13],造成吞噬细胞功能减弱,抗体生成减少,机体免疫力下降,LN伴低蛋白血症及伴感染者广谱抗生素的使用和有创性操作均使SLE易患真菌感染。本例患者全身疾病高度活动,免疫功能低下伴低蛋白血症,院外予激素及多种抗生素治疗,为真菌感染的易感者。SLE并发颅内曲霉菌感染,其感染的症状、体征常与原发病的表现相互掺杂,复杂多样,激素的应用可能掩盖了感染的临床表现,增加了诊断及治疗的难度,临床医师需警惕SLE患者并发少见的颅内曲霉菌感染。
颅内曲霉菌感染治疗颅内曲霉菌感染病情凶险,预后差,死亡率达95%以上,治疗相当困难。由于成功救治的病例数少,尚无标准的治疗方案。推荐尽可能予根治性手术切除或部分切除,术后不能手术者予强有力的抗曲霉菌药物治疗[14]。药物治疗首选伏立康唑,其通过血脑屏障的能力强,有研究证实对颅内曲霉菌感染的治疗效果好、安全性高,一项研究显示120例颅内曲霉菌感染,伏立康唑治疗56例(47.7%)有效[15],亦可选用两性霉素B脂质体、两性霉素B脂质复合体、卡泊芬净和伊曲康唑等抗真菌药物。
SLE合并颅内曲霉菌感染的治疗需权衡利弊,及时调整糖皮质激素和免疫抑制剂治疗方案,适当加强支持疗法(如IVIg等)。在抗曲霉菌药物选择方面也要注意SLE常合并肝肾等器官的损害。鉴于本例患者一直无感染及神经系统症状,开始颅内病灶病情较稳定,而原发病SLE病情危重,在治疗初期给予大剂量MP冲击、PE、IVIg及加强支持治疗控制原发疾病,不仅挽救患者的生命,使各器官功能恢复,也为后续治疗创造条件。原发疾病SLE控制稳定后,在随访过程中复查颅内病灶增大,及时颅内病灶活检,明确诊断为曲霉菌感染,同时成功的采用根治性手术完整切除了病灶,术后恢复良好,后续伏立康唑口服抗曲霉菌治疗。此时患者SLE已无活动,并存在颅内曲霉菌感染,调整为小剂量的激素联合TW治疗。本文患者颅内曲霉菌感染进展相对缓慢,预后良好,与颅内病灶局限包裹及治疗适当及时有关。对SLE合并感染的患者,治疗时要充分全面评估病情,权衡利弊,慎重选择治疗方案。
经验与教训本例重症SLE合并颅内曲霉菌感染病例治疗获得成功,总结如下:(1)SLE患者免疫功能低下,需长期激素及免疫抑制剂治疗,治疗过程需预防感染,警惕少见性感染;(2)颅内曲霉菌感染的临床、影像及实验室检查均无特异性,同时原发病SLE病情复杂,增加了诊断及治疗的难度;(3)在常规临床、影像和实验室检查仍无法诊断,若病情许可,建议及早颅内病灶活检,可快速准确的诊断;(4)SLE合并感染者,治疗时要权衡利弊,慎重选择免疫抑制剂方案。
(陈樱花 李世军 整理)
1 Bertsias GK,Boumpas DT.Pathogenesis,diagnosis and management of neuropsychiatric SLE manifestations.Nat Rev Rheumatol,2010,6(6):358-367.
2 Shamim MS,Enam SA,Ali R,et al.Craniocerebral aspergillosis: a review of advances in diagnosis and management.J Pak Med Assoc,2010,60(7):573-579.
3 Mylonakis E,Paliou M,Sax PE,et al.Central nervous system aspergillosis in patients with human immunodeficiency virus infection.Report of 6 cases and review.Medicine(Baltimore),2000,79(4):269-280.
4 Siddiqui AA,Shah AA,Bashir SH.Craniocerebral aspergillosis of sinonasal origin in immunocompetent patients:clinical spectrum and outcome in 25 cases.Neurosurgery,2004,55(3):602-611.
5 Tempkin AD,Sobonya RE,Seeger JF,et al.Cerebral aspergillosis: radiologic and pathologic findings.Radiographics,2006,26(4):1239-1242.
6 Hummel M,Spiess B,Kentouche K,et al.Detection of Aspergillus DNA in cerebrospinal fluid from patients with cerebral aspergillosis by a nested PCR assay.J Clin Microbiol,2006,44(11):3989-3993.
7 Pfeiffer CD,Fine JP,Safdar N.Diagnosis of invasive aspergillosis using a galactomannan assay: a meta-analysis.Clin Infect Dis,2006,42(10):1417-1427.
8 Jansen M,Corcoran D,Bermingham N,et al.The role of biopsy in the diagnosis of infections of the central nervous system.Ir Med J,2010,103(1):6-8.
9 Chen HS,Tsai WP,Leu HS,et al.Invasive fungal infection in systemic lupus erythematosus:an analysis of 15 cases and literature review.Rheumatology(Oxford),2007,46(3):539-544.
10 Yang CD,Wang XD,Ye S,et al.Clinical features,prognostic and risk factors of central nervous system infections in patients with systemic lupus erythematosus.Clin Rheumatol,2007,26(6):895-901.
11 Naidech A.A young woman with ring-enhancing lesions.J La State Med Soc,2003,155(3):158-161.
12 Nenoff P,Horn LC,Mierzwa M,et al.Peracute disseminated fatal Aspergillus fumigatus sepsis as a complication of corticoid-treated systemic lupus erythematosus.Mycoses,1995,38(11-12):467-471.
13 Kim HJ,Park YJ,Kim WU,et al.Invasive fungal infections in patients with systemic lupus erythematosus: experience from affiliated hospitals of Catholic University of Korea.Lupus,2009,18(7):661-666.
14 Alrajhi AA,Enani M,Mahasin Z,et al.Chronic invasive aspergillosis of the paranasal sinuses in immunocompetent hosts from Saudi Arabia.Am J Trop Med Hyg,2001,65(1):83-86.
15 Schwartz S,Reisman A,Troke RF.The efficacy of voriconazole in the treatment of 192 fungal central nervous system infections:a retrospective analysis.Infection,2011,39(3):201-210.
