双重血浆置换治疗抗中性粒细胞胞质抗体相关血管炎严重肾损害的临床疗效
2012-07-09陈樱花龚德华刘正钊章海涛刘志红胡伟新
陈樱花 龚德华 刘正钊 章海涛 刘志红 胡伟新
抗中性粒细胞胞质抗体(ANCA)相关血管炎(ANCA associated vasculitis,AAV)是由ANCA介导纤维素性小血管壁炎症和坏死并导致多个器官组织损伤的系统性疾病。ANCA水平升高与AAV的活动、复发密切相关,清除循环中ANCA以控制血管炎活动已成为临床治疗AAV的手段之一。既往我们采用葡萄球菌蛋白A免疫吸附(immunoadsorption,IA)清除ANCA及控制血管炎病变取得了良好疗效[1],但目前受到免疫吸附柱来源的限制,临床无法常规开展。双重血浆置换(double filtration plasmapheresis,DFPP)是一种在血浆置换(plasma exchange,PE)基础上改进的选择性血浆分离方法,采用血浆分离器(一级滤器)分离血浆后,再采用血浆成分分离器(二级滤器)滤过,分子量较小的血浆成分(主要为白蛋白及小分子蛋白)可被再次滤出返回患者体内,从而相对选择性的清除血浆中分子量较大的致病物质(如致病性抗体、免疫复合物、冷球蛋白等)。我们的初步研究已显示DFPP能有效降低血清IgG型ANCA[2],有零星个案报道DFPP清除ANCA可改善AAV病情[3,4],但因病例数量少,其疗效难以评价。本文观察了免疫抑制剂联合DFPP对12例AAV的疗效,观察其清除血清ANCA的作用和对肾功能的影响。
对象和方法
病例选择AAV符合Chapel Hill的诊断标准[5],血清ANCA阳性,且均有肾脏受累或伴肺出血。肾活检组织病理示寡免疫复合物节段坏死性新月体肾炎,可伴或不伴其他脏器(如肺、副鼻窦、皮肤和关节等)损害;排除继发性血管炎,如过敏性紫癜、药物过敏、狼疮性血管炎和感染等。符合以下条件的AAV患者采用DFPP治疗:(1)肾功能进行性下降,SCr≥265.2 μmol/L,伴持续大量血尿,肾脏无缩小;肾外伴或不伴肺出血;(2)血清ANCA高滴度阳性;(3)肾活检病理示寡免疫复合物新月体肾炎或伴袢坏死、间质血管炎。但除外活动性感染、免疫缺陷、合并乙型或丙型病毒肝炎、伴严重心脑血管疾病的患者。
肾组织病理检查所有患者均行肾活检,肾组织进行常规光镜、免疫荧光和电镜检查。光镜检查肾组织经石蜡包埋,切片厚度1.5 μm,常规行HE、PAS、PASM、Masson三色染色。免疫荧光采用冰冻切片,观察肾组织IgG、IgA、IgM、C3、C1q的沉积强度及部位。参照文献[6],病理类型分为新月体型(细胞性新月体≥50%)、混合型(细胞性新月体<50%,<50%肾小球硬化)、局灶型(≥50%肾小球正常)和硬化型(≥50%肾小球硬化)。肾小管间质病变按累及范围分为:+(<25%),++(25%~50%),+++(>50%)。
治疗方案
DFPP方法[2]均采用右侧颈内静脉留置双腔导管作血管通路。DFPP采用血液净化装置IQ21(Asahi Kasei Kuraray Medical CO,Ltd,日本),血浆分离器EC50W作一级滤器,血浆成分分离器EC20W作二级滤器。枸橼酸联合低分子肝素抗凝,使活化凝血时间延长1倍以上。体外循环下全血以120~150 ml/min的速度流经一级滤器,滤出的血浆以30~40 ml/min的速度进入二级滤器再次滤过,滤出血浆回输体内,被截留的血浆成分滞留在二级滤器中不断再循环,再循环流量60 ml/min。当二级滤器前压力逐步升高,超过150~160 mmHg时,停止分离血浆,用生理盐水800 ml冲二级滤器,使二级滤器中滞留血浆成分进一步滤过,并丢弃二级滤器中仍残留的血浆成分。每次处理血浆量为2倍血浆容量,每次补充白蛋白30~40g,隔日治疗1次,至少进行3次。
免疫抑制剂 DFPP治疗同时均给予甲泼尼松(MP)静脉治疗(0.5 g/d,3~6d),后口服泼尼松[起始剂量为0.6 mg/(kg·d)],4周后逐渐减量至10 mg/d维持。DFPP治疗结束后给予吗替麦考酚酯(MMF)1 g/d或间断环磷酰胺(CTX)静脉冲击(NIH方案)诱导治疗。
临床及实验室指标 观察DFPP治疗前后血清ANCA水平和肾功能变化。采用伯明翰血管炎活动性评分(BVAS)评估AAV活动性;肾损害指标包括尿沉渣红细胞计数、尿蛋白定量、血清肌酐(SCr)、血清白蛋白,均参照既往报道的方法[7]。采用间接免疫荧光检测pANCA、cANCA,ELISA法检测抗髓过氧化酶抗体(MPO-ANCA)、抗蛋白酶3抗体(PR3-ANCA))和免疫球蛋白,参照既往报道的方法,测定DFPP治疗前的基础值及每次DFPP治疗后次日的值[2]。循环内皮细胞(CECs)数量采用免疫磁珠分离方法检测[8],血浆血管性假血友病因子(vWF)、血管细胞黏附分子(VCAM-1)和E选择素(E-selectin)水平采用ELISA法检测,均参照我科既往报道的方法[9]。
统计学方法采用SPSS 16.0软件进行统计分析,所有计量资料,以均数±标准差表示,均数之间比较应用t检验。P<0.05为差异有统计学意义。
结 果
一般情况2010年12月~2011年12月间南京军区南京总医院全军肾脏病研究所住院的12例AAV采用DFPP治疗的患者,其中男性7例,女性5例,发生肾脏损害的平均年龄60.9±9.8岁(43~72岁),肾活检时血管炎肾脏损害平均病程为12.0±37.8月,平均BVAS 14.7±3.2分,其中10例p/MPO-ANCA阳性,2例c/PR3-ANCA阳性,ANCA水平221.3~341.4 RU/ml (平均 274.9±33.9 RU/ml)(表1)。肾脏损害均表现为急进性肾炎综合征(RPGN),均需要肾脏替代治疗,平均SCr水平(549.9±197.1)μmol/L,平均尿蛋白(2.8±2.3)g/24h,尿沉渣红细胞计数(1 355±1 123)万/ml,其中肉眼血尿4例。肾活检病理均表现为寡免疫复合物节段坏死性新月体肾炎,细胞性新月体比例(37.4土27.3)%,球性硬化比例(31.6土28.4)%。病理分型新月体型5例,混合型和硬化型各3例,局灶型1例。肾外损害包括鼻窦炎(6例),肺出血(4例),间质性肺炎(1例),关节炎(3例)和听力丧失(1例)。
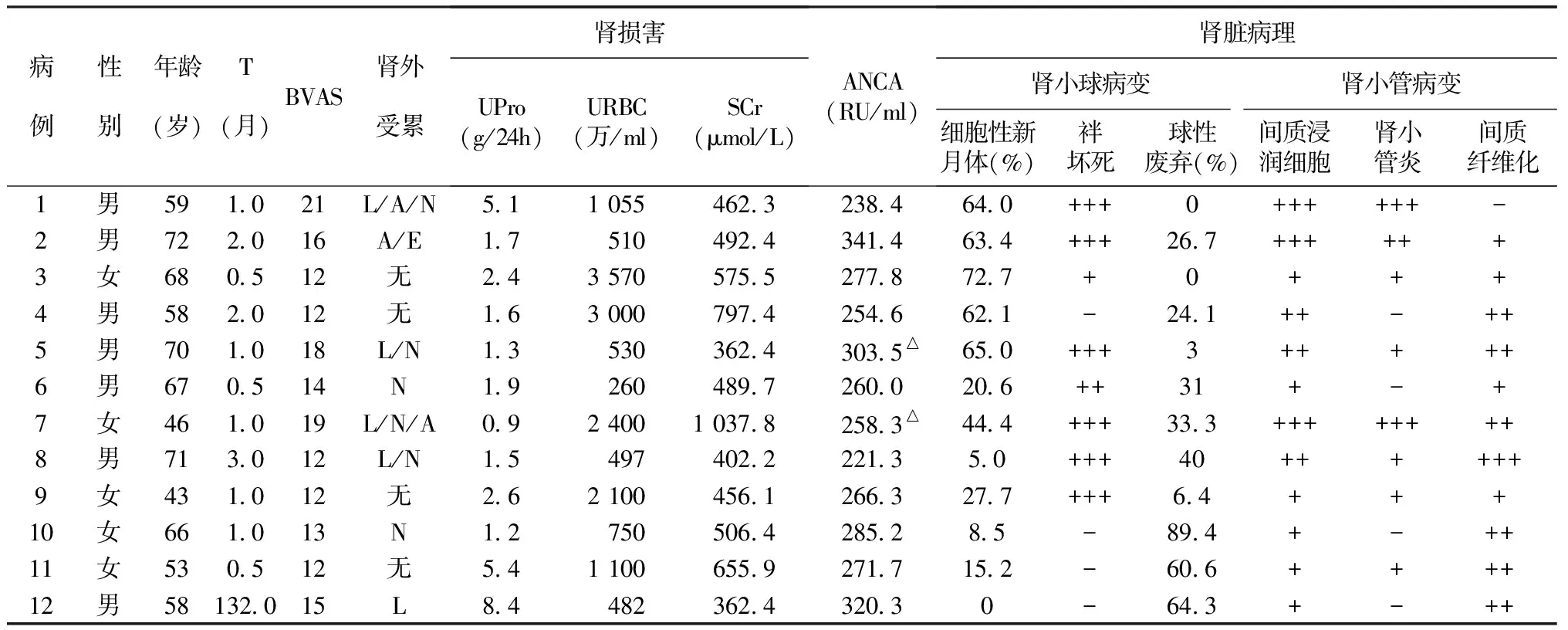
表1 临床及病理特征
临床疗效 DFPP治疗3~5次(平均3.5次)。DFPP治疗前后血清ANCA水平变化和对肾功能的影响见表2。4例伴肺出血的患者,1例症状轻,经激素治疗后即缓解;另3例经DFPP治疗后均缓解。
ANCA水平 DFPP治疗结束时ANCA水平显著下降[(274.9土33.9)RU/mlvs(111.8±55.1)RU/ml,P<0.01],平均下降(60.0±18.1)%。其中 8例DFPP治疗3次,ANCA平均下降(57.1±19.1)%,DFPP治疗4次和5次的患者各2例,ANCA分别下降(78.8±13.1)%和(52.8±5.14)%(图1)。随访1~15月,4例ANCA转阴,6例ANCA水平稳定,2例升高。
肾功能 DFPP治疗结束后,10例(83.3%)摆脱透析,病理类型分别为新月体型4例,混合型3例,硬化型2例和局灶型1例。1例新月体型仅随访1月尚未摆脱透析。1例硬化型肾功能无改善,转为维持性肾脏替代治疗。
1例维持性肾脏替代治疗的患者给予小剂量激素,余2例激素联合MMF,9例为激素联合间断静脉CTX冲击治疗。摆脱透析的10例患者平均随访6.2土4.8月(1~15月),1例(局灶型)肾功能恢复正常,8例(新月体型和混合型各3例,硬化型2例)Scr稳定,1例(新月体型)1月后,MPO-ANCA水平伴SCr再次升高行肾脏替代治疗。病例1、9、10随访9~15月,尿检均明显改善(表2)。
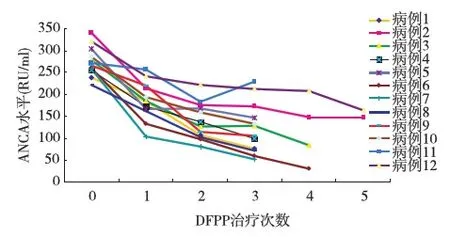
图1 DEPP治疗后ANCA的变化
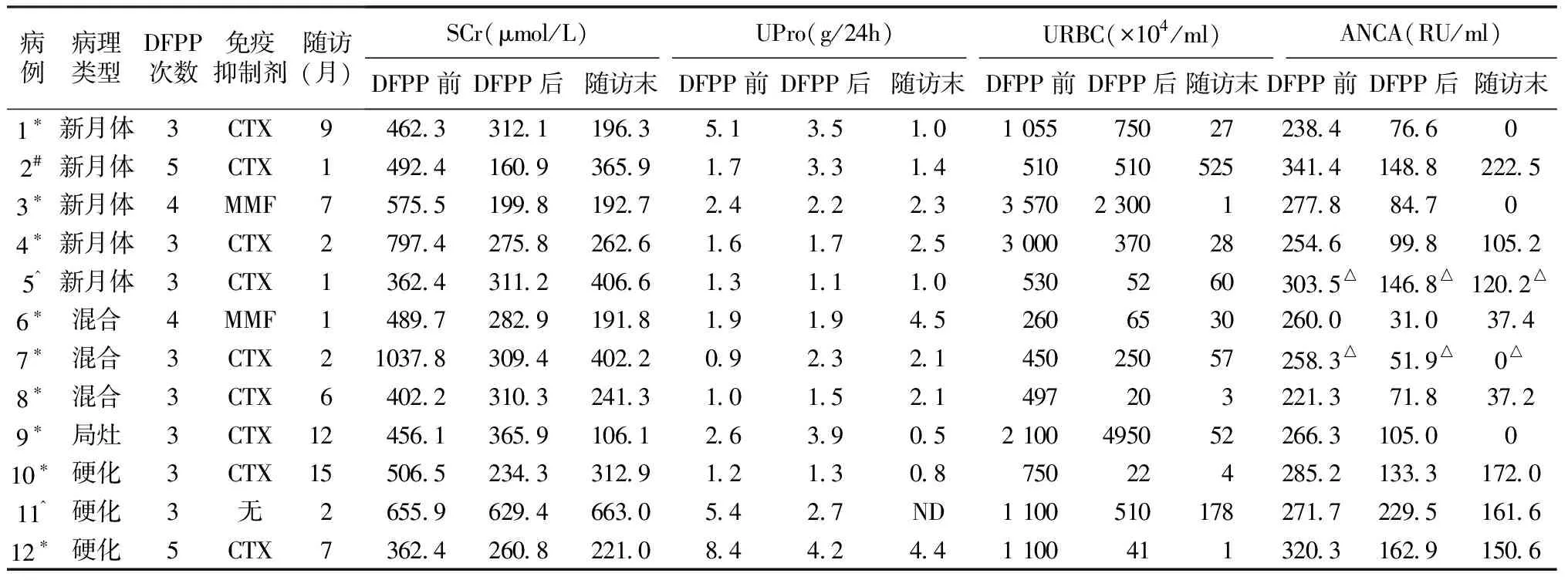
表2 DFPP治疗前后临床疗效比较
T淋巴细胞亚群 DFPP治疗结束时CD4+淋巴细胞[(380.5±256.6)个/ulvs(279.2±241.9)个/ul,P>0.05]和CD8+淋巴细胞[(225.2±163.5)个/ulvs(295.1±315.7)个/ul,P>0.05]均无明显变化。
血管内皮损伤标记物 观察了9例DFPP治疗前后循环内皮损伤标记物水平的变化发现,DFPP治疗后CECs数量[(33土21)个/mlvs(28±13)个/ml,P>0.05]、VCAM-1[(1 395.8土559.4)ng/mlvs(1 197.5±341.9) ng/ml,P>0.05]、vWF[(198.2±59.2)%vs(194.2±8.9)%,P>0.05]和E-selectin[(80.9±36.5)ng/mlvs(52.8±15.1)ng/ml,P>0.05]均下降。
不良反应DFPP治疗过程中无过敏、感染、出血、血栓等不良反应。随访期间,病例12间断CTX冲击治疗3月时发生肺部感染,经抗感染治愈。
讨 论
DFPP治疗AAV的临床疗效AAV患者的肾功能不全发生率高,本文12例患者均存在肾功能不全,并需肾脏替代治疗。AAV中的微型多血管炎预后较差,3年肾存活率仅58.5 %[10]。AAV治疗初期的肾功能状态对预后有显著影响[11]。现有治疗AAV的免疫抑制剂方案,包括MP静脉冲击、联合CTX或MMF,临床缓解率可达80%~94%[12,13],在一定程度上改善了患者预后。但在严重肾功能损害者疗效差,治疗初期需透析患者肾存活率仍很低,治疗1年后摆脱透析者仅50%[11]。因此,还需新的治疗手段改善AAV患者的预后。
ANCA是致病性抗体,具有直接损伤肾和肺毛细血管的作用,应用PE[14]和IA[1]等体外循环方法可快速清除体内ANCA,从而控制AAV活动,促进肾功能恢复。PE是采用一级血浆分离器,从全血中分离血浆并弃除,再补充等量正常新鲜血浆或白蛋白置换液,以清除血液中的致病因子。PE治疗AAV的疗效已经得到了临床研究的证实。Jayne等[14]的多中心前瞻性临床对照研究观察了137例SCr>500 μmol/l的AAV患者分别采用大剂量MP静脉冲击治疗或MP联合PE的疗效发现,3月内摆脱透析的比例PE组显著高于MP冲击治疗组(69%vs49%,P=0.023),随访12月时PE组进展至终末期肾病的风险下降24%。因此,对有严重肾功能不全的AAV推荐免疫抑制药物联合PE(KDIGO指南)。但是PE清除ANCA为非选择性,在分离出的血浆中还丢失了大量人体必需物质,如白蛋白、凝血因子,因此,每次PE需要补充大量的人体血浆或白蛋白等血制品。而输注血制品存在病毒(肝炎病毒、HIV等)感染的风险。另一种清除血ANCA的方法是IA[1]。IA通过免疫吸附柱(如葡萄球菌A蛋白吸附柱),选择性吸附血液中的IgG型自身抗体抗体,具有选择性强、保留有用血浆成分,避免疾病传播特点,但因免疫吸附柱来源困难,限制了临床应用。
DFPP是在PE的基础上,再引入第2个孔径较小的滤器,分子量较大的物质(免疫球蛋白、自身抗体、免疫复合物等)被截留,分子量较小的血浆成分(主要为白蛋白及小分子蛋白)被二级滤器滤出后回输体内。DFPP能相对高选择性地清除血浆中分子质量较大的致病物质,减少了白蛋白和其他血浆成分的丢失,能减少血浆/白蛋白补充量。我们的初步研究显示,采用EC50W/EC20W滤器组合方式对IgG型MPO-ANCA的清除具有较高的选择性,能有效降低血清ANCA水平,避免其他大分子物质的丢失[2]。
已有个案报道发现AAV经DFPP治疗后ANCA水平下降或转阴,SCr下降[3,4]。有研究发现存活的12例AAV患者接受DFPP治疗的比例为42%,死亡的7例中接受DFPP治疗的仅14%,提示DFPP治疗能改善AAV的预后[15]。本研究观察发现DFPP治疗能使ANCA水平显著下降60%,80%以上的患者暂时摆脱肾脏替代治疗。此研究表明DFPP能快速有效降低血清ANCA水平,从而控制AAV活动性,改善肾功能。本文DFPP治疗后ANCA水平较低的4例在随访中ANCA均转阴,而病理类型为新月体型的2例,分别经DFPP治疗5次和3次,ANCA仍高滴度阳性,1例摆脱透析仅1月再次行肾脏替代治疗,另1例随访1月尚未摆脱透析。关于DFPP治疗的次数及剂量,ANCA下降的目标值与AAV预后的关系,目前国内外研究尚未明确,还需进一步的研究。另外,本研究中伴肺出血的患者,经DFPP治疗后肺出血均缓解,表明DFPP能控制活动性肺出血[16],提高患者的存活率。但由于本研究为非对照研究,DFPP对AAV的治疗效果,尤其对改善远期肾功能和减少血管炎复发的疗效还需进行对照研究和长期随访。
DFPP改善肾功能和缓解肺出血的疗效不仅与其有效清除ANCA相关,还可能与其改善血管内皮功能有关[17]。本文检测了DFPP治疗前后循环内皮损伤标记物的变化,发现DFPP治疗后CECs数量、VCAM-1、vWF和E-selectin水平均下降,表明内皮损伤改善。但DFPP的治疗机制还需进一步研究。
DFPP治疗期间未发生严重不良反应,仅1例在随访期间发生肺部感染,较PE和IA治疗后报道的感染发生率低[1,14],表明DFPP安全性较好。
DFPP对不同病理类型的治疗效果研究显示肾组织病理改变可以预测AAV肾脏预后,正常肾小球的比例越高,提示近期和远期预后良好,硬化肾小球的比例越高,预后越差,细胞性新月体与肾功能的恢复相关,纤维性新月体提示远期肾预后差[18,19]。本研究4例(4/5)新月体型、3例混合型和1例局灶型经DFPP治疗后均摆脱肾脏替代治疗。但硬化型3例中也有2例经DFPP治疗后摆脱了透析,表明不能仅根据肾小球硬化的比例来决定是否应该积极治疗,还要根据临床综合判断肾脏病变的活动性和可逆程度,以免错失治疗时机。作者认为AAV导致严重肾功能不全时,只要肾脏未萎缩,且伴有大量血尿,血清ANCA滴度较高,肾活检病理上仍可见细胞或细胞纤维性新月体、袢坏死等活动性病变时,均应考虑联合DFPP,积极改善肾功能。
小结:DFPP治疗能有效清除AAV患者血清ANCA,改善肾功能,但其疗效还需大样本临床对照研究的证实。
1 梅洁卉,胡伟新,季大玺,等.免疫吸附治疗ANCA相关血管炎的初步观察.肾脏病与透析肾移植杂志,2007,16(4):316-321.
2 龚德华,季大玺,朱冬冬,等.选择性血浆分离器行双重血浆置换对抗中性粒细胞胞质抗体清除的研究.肾脏病与透析肾移植杂志,2011,20(3):212-217.
3 Ito C,Ando Y,Akimoto T,et al.Comparison of plasma exchange(PEX) vs.double filtration plasmapheresis (DFPP) with or without steroid administration in a case of MPO-ANCA-positive immune complex type crescentic glomerulonephritis.Nippon Jinzo Gakkai Shi,2000,42(5):374-380.
4 Takeshita Y,Takagi N,Yamada A,et al.Diabetes mellitus associated with rapidly progressive glomerulonephritis with perinuclear antineutrophil cytoplasm antibodies.Intern Med,2000,39(2):154-156.
5 Jennette JC,Falk RJ,Andrassy K,et al.Nomenclature of systemic vasculitides:the proposal of an International Consensus Conference.Arthritis Rheum,1994,37(2):187-192.
6 Berden AE,Ferrario F,Hagen EC,et al.Histopathologic classification of ANCA-associated glomerulonephritis.J Am Soc Nephrol,2010,21(10):1628-1636.
7 胡伟新,陈惠萍,唐 政,等.霉酚酸酯与间断环磷酰胺冲击疗法治疗IV型狼疮性肾炎的疗效比较.肾脏病与透析肾移植杂志,2000,9(1):3-8.
8 Woywodt A,Streiber F,de Groot K,et al.Circulating endothelial cells as markers for ANCA-associated small-vessel vasculitis.Lancet,2003,361(9353):206-210.
9 张庆燕,曾彩虹,陈朝红,等.局灶节段性肾小球硬化患者内皮细胞功能异常及临床意义.肾脏病与透析肾移植杂志,2010,19(4):309-316.
10 胡伟新,刘春蓓,唐 政,等.微型多血管炎肾损害的预后.肾脏病与透析肾移植杂志,2004,13(5):419-430.
11 胡伟新,刘春蓓,谢红浪,等.霉酚酸酯与环磷酰胺治疗ANCA相关血管炎的临床对照研究.肾脏病与透析肾移植杂志,2005,14 (6):501 - 507.
12 Jayne D,Rasmussen N,Andrassy K,et al.A randomized trial of maintenance therapy for vasculitis associated with antineutrophil cytoplasmic autoantibodies.N Engl J Med,2003,349(1):36-44.
13 Booth AD,Almond MK,Burns A,et al.Outcome of ANCA-associated renal vasculitis:a 5-year retrospective study.Am J Kidney Dis,2003,41(4):776-784.
14 Jayne DR,Gaskin G,Rasmussen N,et al.Randomized trial of plasma exchange or high-dosage methylprednisolone as adjunctive therapy for severe renal vasculitis.J Am Soc Nephrol,2007,18(7):2180-2188.
15 Yoshida A,Takeda A,Fukuda M,et al.Therapeutic effect and clinical findings in patients with MPO-ANCA associated vasculitis syndrome.Ryumachi,2000,40(1):1-8.
16 Iwatani H,Uzu T,Kakihara M,et al.A case of Wegener’s granulomatosis with pulmonary bleeding successfully treated with double filtration plasmapheresis(DFPP).Clin Exp Nephrol,2004,8(4):369-374.
17 Yokoyama H,Wada T,Zhang W,et al.Advances in apheresis therapy for glomerular diseases.Clin Exp Nephrol,2007,11(12):122-127.
18 de Lind van Wijngaarden RA,Hauer HA,Wolterbeek R,et al.Clinical and histologic determinants of renal outcome in ANCA-associated vasculitis:A prospective analysis of 100 patients with severe renal involvement.J Am Soc Nephrol,2006,17(8):2264-2274.
19 Hauer HA,Bajema IM,van Houwelingen HC,et al.Determinants of outcome in ANCA-associated glomerulonephritis:A prospective clinico-histopathological analysis of 96 patients.Kidney Int,2002,62(5):1732-1742.
