响应面法优化海藻酸钙包囊的制备条件
2012-07-06李秀凉田丽爽张玉娟窦海艳
李秀凉,田丽爽,张玉娟,窦海艳
(1.黑龙江大学 生命科学学院,哈尔滨 150080;2.微生物黑龙江省高校重点实验室,哈尔滨 150080;3.农业微生物技术教育部工程研究中心,哈尔滨 150080;4.哈尔滨学院 理学院,哈尔滨 150086)
0 引 言
固定化细胞的方法很多,其中以包埋法最为常见[1-2]。包埋法中海藻酸钙包埋应用最为广泛[3],最初,研究较多的海藻酸钙/壳聚糖固芯微胶囊,但由于固芯结构的空间位阻使细胞生长受到一定影响,而液芯海藻酸钙包囊固定化方法是将细胞包裹在一层半透膜包围的液态环境中,使其不仅具有海藻酸钙凝胶固定化方法的众多优点,而且此包囊具有更好的传质性能;营养物质和代谢产物的进出更容易;固定化空间更大,细胞在液芯的环境中生长较均匀,空间位阻较小,能够高浓度生长[4-7],有利于固定化发酵周期长的菌株。
本文通过壳聚糖覆膜改进液芯海藻酸钙包囊的制备,即选择了海藻酸钠-羧甲基纤维素钠/氯化钙-壳聚糖复合载体,通过响应面法优化该液芯包囊的制备条件,以期获得机械压力较高的液芯包囊,延长其使用寿命。利用扫描电镜观察液芯包囊的微观结构,为细胞液芯包囊固定提供参考。
1 材料与方法
1.1 材料及仪器
海藻酸钠和羧甲基纤维素钠为食品级;壳聚糖、氯化钙等均为分析纯。
90-1恒温磁力搅拌器(上海精科有限公司);AB104-N电子分析天平(梅特勒-托利多仪器上海有限公司);DK-S26型电热恒温水浴锅(上海精宏实验设备有限公司);HNY-1102C摇床(天津市欧诺仪器仪表有限公司);TA-XT质构分析仪。
1.2 实验方法
1.2.1 海藻酸钙液芯包囊的制备方法
将羧甲基纤维素钠(CMC)溶液与CaCI2溶液以4∶1的比例混匀,滴入海藻酸钠(SA)溶液中进行凝胶反应,过滤出液芯包囊,洗涤,转移到2%CaCI2溶液中进行硬化处理,过滤洗涤包囊,转移到壳聚糖溶液中进行包覆,过滤洗涤后于生理盐水中4℃下保存待用。
1.2.2 液芯包囊机械压力的测定
采用质构分析仪测量包囊的机械压力,以包囊正面所能承受的最大压力来表征包囊的机械压力。同一批包囊随机取20个,用破裂压力的平均值作为其机械压力[5]。
1.2.3 液芯包囊微结构的测定
采用电镜扫描仪观察包囊膜的微结构。首先用液氮将包囊冷冻5min,然后将其破碎;放入pH=6.8的戊二醛中固定并置于4℃冰箱中;再用磷酸缓冲溶液冲洗;选用乙醇逐级脱水;100%的乙醇∶叔丁醇=1∶1(v/v),纯叔丁醇各一次进行置换;将样品放入-20℃冷冻30min,再进行干燥;将样品用导电胶带粘贴在样品台上;用离子溅射镀膜仪在样品表面镀金;将处理好的样品放入样品盒中待检。
1.3 实验设计
1.3.1 Plackett-Burman实验设计
在单因素实验的基础上,采用N=8的Plackett-Burman实验设计[8],对CaCl2浓度/(%,W/V)、CMC浓度/(%,W/V)、SA浓度/(%,W/V)、凝胶反应时间/min、CaCl2中硬化时间/min、壳聚糖的浓度/(%,W/V)6个影响因素进行考察,确定影响包囊机械压力的显著因子。对制备包囊的每个影响因素分别取高低两个水平,以机械压力作为响应值Y。
1.3.2 最陡爬坡实验
根据Plackett-Burman实验筛选出的包囊机械压力的主要因素,按文献 [9]做最陡爬坡实验。
1.3.3 响应面分析设计
3.根据企业自身情况进行税务筹划,从而减轻企业资金成本。在企业进行采购时,应保持与供应商协商与交流,以利益最大化为原则,平衡商品单价与税额。采购前应认真挑选供应商,并取得合法、合规的增值税专用发票,确保开票单位与收款单位的统一,从规避违法、违规等涉税行为,避免法律风险。
在Plackett-Burman实验和最陡爬坡实验的基础上进行响应面优化。采用Box-Behnken实验设计来确定试验点[10],通过SAS分析软件对实验数据进行分析,获得二次响应面回归模型,确定影响包囊制备显著因素的最佳值。确定模型可行性后,得出制备包囊最佳条件时的机械压力,并进行模型验证实验。
2 结果与分析
2.1 Plackett-Burman实验确定显著影响因子
在单因素实验的基础上,采用Plackett-Burman实验设计对影响包囊机械压力的6个主要因素进行考察,实验设计及结果见表1,表2。
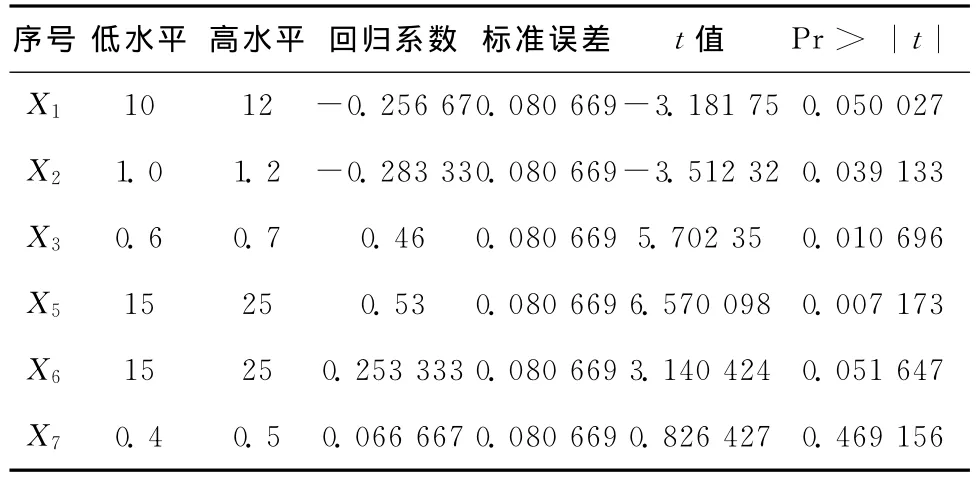
表2 Plackett-Burman实验因素及分析结果Table2 Factors levels and analysis of the result for Plackett-Burman design
由表2的分析结果可知,凝胶反应时间(X5)、SA浓度(X3)和CMC浓度(X2)为显著影响因素,且在95%置信区间其可信度分别为99.2%、98.9%和96.1%。
由Plackett-Burman实验结果分析所得的一次回归方程为:
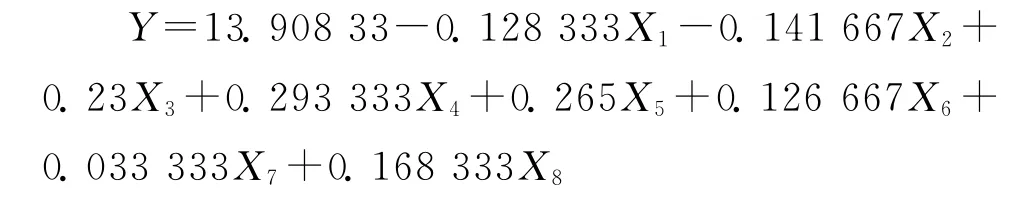
2.2 最陡爬坡实验
由Plackett-Burman实验结果可知,以海藻酸钙包囊的机械压力为测定指标,凝胶反应时间、SA浓度有显著正效应,CMC浓度有显著负效应,其它因子均无显著影响。最陡爬坡实验设计及结果见表3。
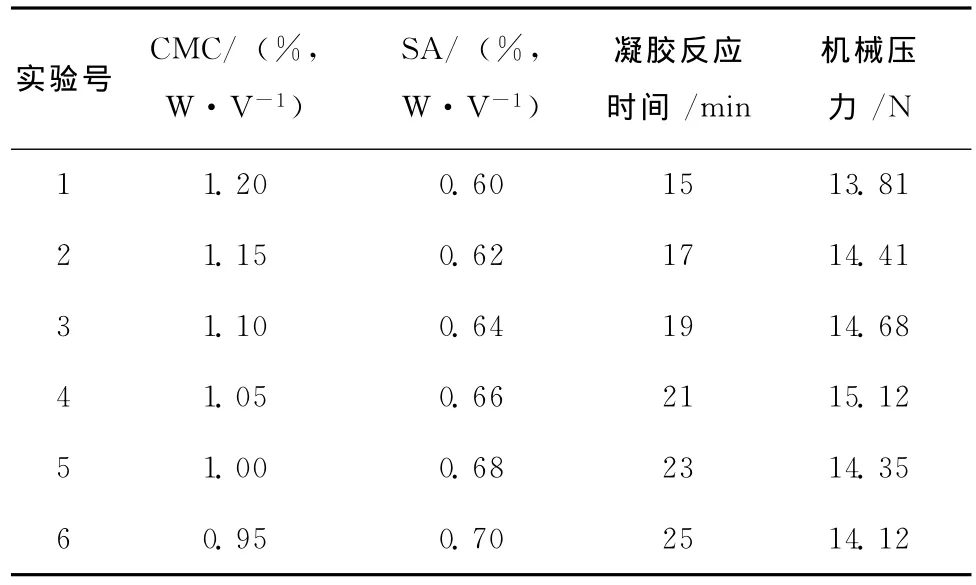
表3 最陡爬坡实验设计及实验结果Table3 Design and results of steepest ascent experiment
由表3实验结果分析可知,随着CMC浓度降低、SA浓度增加和凝胶反应时间延长,机械压力的变化趋势是先上升后降,最大机械压力出现在第3组和第5组之间,所以选取第4组的条件为实验中心点,进行响应面分析。
2.3 响应面分析设计
应用Box-Behnken的中心组合设计原理,在最陡爬坡实验基础上,设计三因素三水平实验(表4),并利用SAS分析软件对实验数据进行统计分析,结果见表5。

表4 Box-Behnken实验的因素与水平Table4 Box-Behnken test factors and level
通过SAS的RSREG(响应面回归)过程进行数据分析,建立二次响应面回归模型,获得拟合二次多项式回归方程:

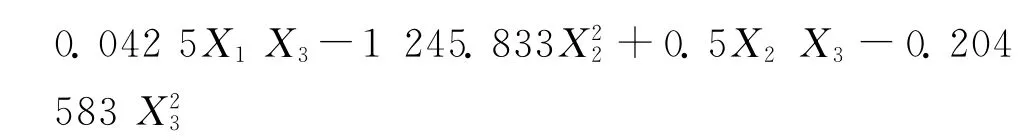
其中的X1、X2、X3分别代表海藻酸钙包囊的CMC浓度、SA浓度和凝胶反应时间。
对拟合二次多项式回归方程的系数和概率进行方差分析,结果见表6。

表5 响应面分析方案及实验结果Table5 Program and test results of RSA
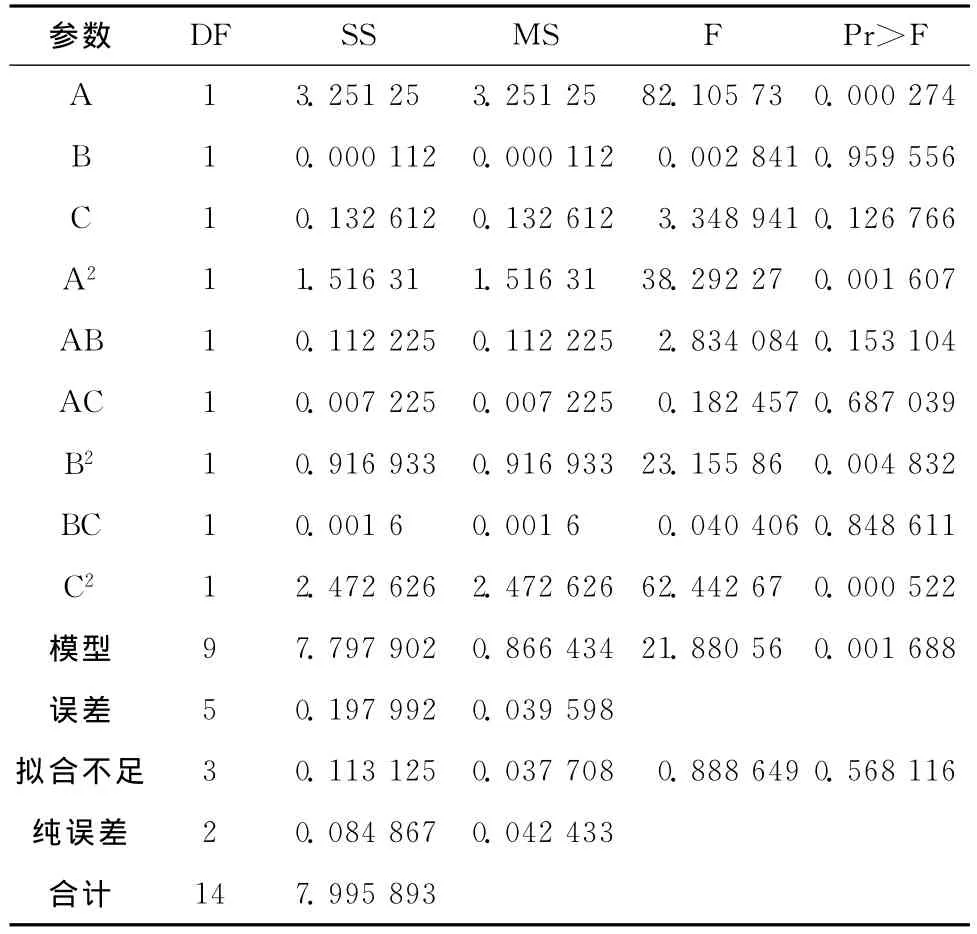
表6 回归方程中回归系数的估计Table6 Estimated value of coefficient in the regression equation
由表6分析可知,模型的回归P=0.001688,说明该模型的概率在a=0.01的水平上差异显著;拟合不足P值=0.568116>0.05,说明该模型失拟不显著,所以该模型可以用于海藻酸钙包囊制备的最佳条件的理论预测。模型的复数关系数R2=0.9752,说明模型的拟合度很好;其校正决定系数R2(adj)=0.9307,表明有约为0.07的机械压力变异不能由该模型进行解释。
由表6分析还可知,CMC浓度及二次项对机械压力的影响比较显著,而SA浓度和凝胶反应时间对机械压力的影响不显著,交叉项不显著。
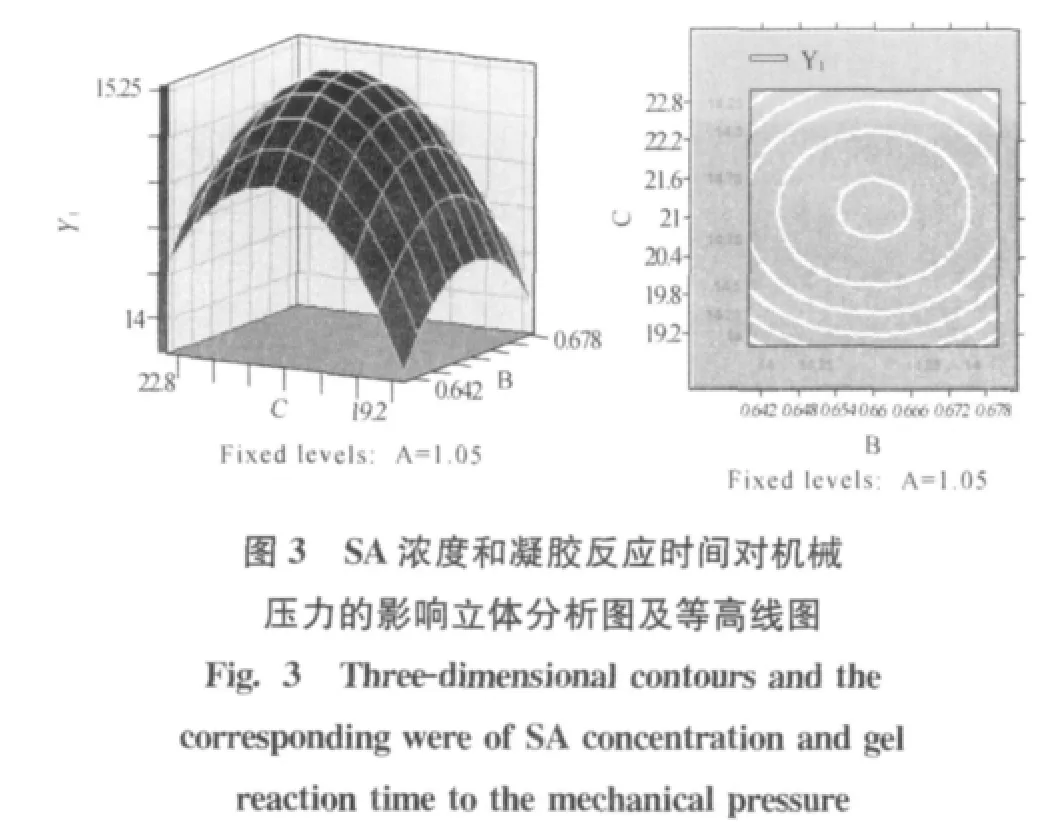
求解回归方程,得到CMC浓度、SA浓度和凝胶反应时间的最大预测值分别为1.08%、0.66%、21.19min(图1~图3)。此时机械压力的最大预测值为15.46N。
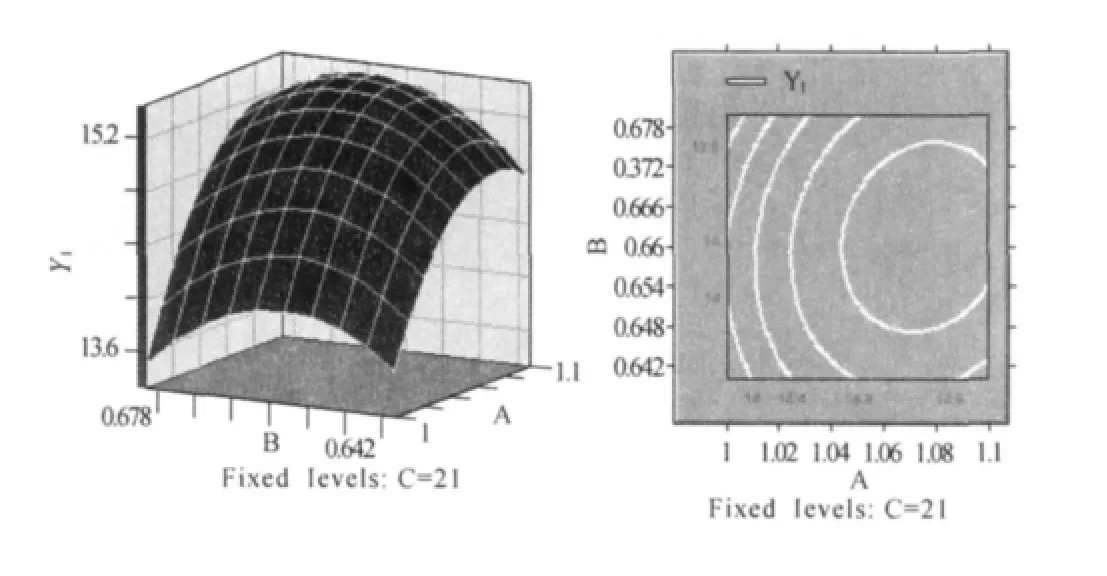
图1 CMC浓度和SA浓度对机械压力影响的立体分析图及等高线图Fig.1 Three-dimensional contours and the corresponding were of CMC concentration and the concentration of SA mechanical pressure
为了进一步验证实验结果,在优化条件下进行重复实验3次,测得机械压力平均值为15.32N。与机械压力的最大预测值15.46N比较吻合,证明响应面分析法优化海藻酸钙包囊获得的回归方程的可靠性。
2.4 包囊膜的微结构分析
用扫描电镜对包囊横切面进行了观察,结果见图4。
由图4可见,海藻酸钙包囊的切面是致密的多孔网状结构,微孔比较致密,且存在着一定的孔隙。由于包囊内部为液态,这样的结构为固定化细胞的栖居和繁殖提供了良好的微环境。


3 结 论
通过Plackett-Burman实验设计与响应面软件设计分析,得知影响SA-CMC/CaCl2-CA 液芯包囊制备的主要因素为CMC浓度、SA浓度和凝胶反应时间,优化的最佳值分别为:CMC浓度1.08%,SA 浓度0.66%,凝胶反应时间21.19 min。此时机械压力的最大预测值为15.46N,与实际值15.32N接近。扫描电镜结果表明包囊具有致密的网状结构。
[1]Yasemin Numano Glu,Sibel Sungur.P-Galactosidase from Kluyreromyles lactis cell disvrption and enzyme immobilized using a cellulose-gelatin carier system [J].Process Biochemistry,2004:703-709.
[2]张志军,李凤美,周永斌,等.细胞固定化技术在食用菌方面的应用 [J].食品研究与开发,2011,32(6):188-189.
[3]KOYAMA K,SEKI M.Cultivation of yeast and plant cells entrapped in the low-viscous liquid core of alginate membrane capsule prepared using polyethylene glycol[J].J Biosci Bioeng,2004,97(2):111-118.
[4]包永华,董明盛.液芯海藻酸钙包囊固定化技术 [J].中国酿造,2008,(21):14-16.
[5]刘袖洞,何 洋,刘 群,等.微胶囊及其在生物医学领域的应用 [J].科学通报,2000,45(23):2476-2485.
[6]陈 国,黄世丰.制备中空海藻酸钙胶囊新方法的研究 [J].山西大学学报:自然科学版,2008,31(1):119-123.
[7]R.Dembczynski,T.J.Growth characteristics and acidifying activity of Lactobacillus rhamnosus in alginate/starch liquid-core capsules [J].Enzyme and Microbial Technology,2002,33:111-115
[8]朱敏莉,薛伟明,赵彬然,等.ACA液芯微胶囊制备工艺优化 [J].化工进展,2010,29(1):124-129.
[9]Pan CM,Fan YT,Xing Y,et al.Statistical optimization of process parameters on biohydrogen production from glucose by Clostridium sp.Fanp21 [J].Bioresource Technology,2008,99(8):3146-3154.
[10]杨唐仪,李朝霞,丁 成,等.响应面法优化海藻酸钠-壳聚糖-粉末活性炭生物微胶囊制备工艺 [J].化学通报,2011,74(3):252-258.
[11]Shu Liu,Yaowei Fang,Mingsheng Lv.Optimization of the production of organic solvent-stable protease by Bacillus sphaericus DS11with response surface methodology [J].Bioresource Technology,2010,101,7924-7929.
