高效液相色谱法测定缓释微球中酮康唑的含量
2012-07-06张艳红孙丽建赵冬梅王清文
张艳红,孙丽建,李 强,赵冬梅,王清文
(1.东北林业大学 生物质材料科学与技术教育部重点实验室,哈尔滨 150040;2.黑龙江大学 化学化工与材料学院,哈尔滨 150080;3.黑龙江东方学院 食品与环境工程学部,哈尔滨 150086)
酮康唑(Ketoconazole)是一种咪唑类广谱抗真菌药,通过抑制霉菌细胞膜中麦角甾醇的生物合成达到抗真菌的作用[1]。随着近年来真菌病的发病率迅猛增长,越来越多的科研机构致力于酮康唑的研究及开发[2]。目前,国内外文献中测定酮康唑所采用的HPLC法多用于粉剂、片剂、霜剂以及生物体液中酮康唑的检测,但对于载药微球缓慢释放溶出液中酮康唑的含量测定,尚未见报道。本文建立了一种适用于测定微球中酮康唑含量的高效液相色谱(HPLC)测定法。
1 仪器与试剂
岛津LC-10AT高效液相色谱仪,配有SPD-10A型检测器。甲醇(色谱纯),三乙胺(分析纯),磷酸(优级纯),水(双蒸馏水),酮康唑对照品(湖北恒硕化工有限公司),酮康唑缓释微球(实验室自制)。
2 方法与结果
2.1 酮康唑缓释微球的制备
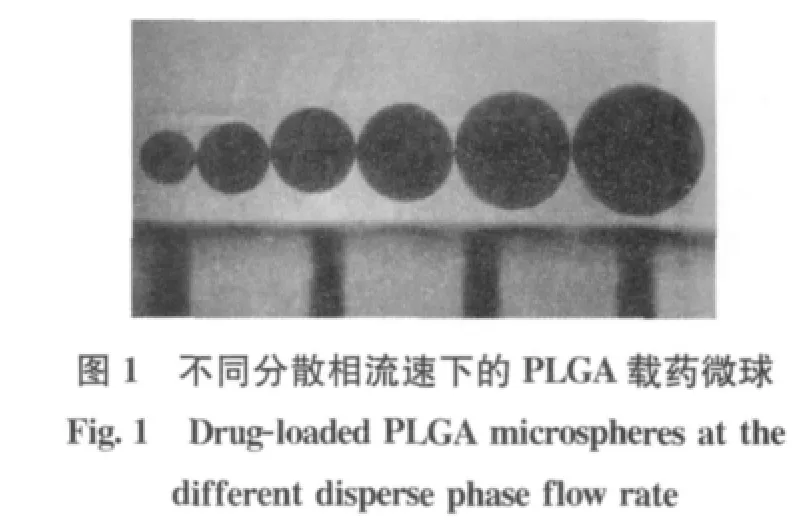
将乳酸-羟基乙酸共聚物(PLGA)溶于混合溶剂(苯/1,2-二氯乙烷=17/10)中,再加入酮康唑,使其溶解成作为分散相的均一透明溶液,采用微流控装置,将分散相滴入8%聚乙烯醇水溶液中制备载药微球。将分离干燥后的微球装入密封袋中保存。图1是放大40倍的显微镜下观察到的不同分散相流速下的PLGA载药微球的照片,通过调整微流控装置中分散相的流速即可得到不同粒径的微球。图2是在放大40倍的显微镜下观察到的微球照片,所得微球表面光滑,粒径较均一。
2.2 供试品溶液的制备
精密称取一定量微球样品置于烧杯中,加入一定量的苯使微球溶解,将溶解后的溶液置于分液漏斗中,加入一定量的甲醇溶液萃取,连续萃取3次,合并萃取液并定容,即得供试品溶液。
2.3 色谱条件

色谱柱为 ODS C18(250mm×4.6mm,5μm,迪马公司),流动相为甲醇:磷酸缓冲盐=80/20(磷酸缓冲盐:0.34mL磷酸与200mL双蒸馏水混合,用三乙胺调节pH=3.0),检测波长为242nm,流量为0.80mL/min,柱温为室温,进样量为20μL。
2.4 标准曲线的绘制
精密称取一定量80℃减压干燥至恒重的酮康唑对照品,用流动相配制成浓度分别为1.0、2.5、5.0、10、15、20、30μg/mL的对照品溶液,各进样20μL,按上述色谱条件测定峰面积。以酮康唑浓度(C)对峰面积(A)进行线性回归,得回归方程为Y=27298 X+159.39(r=0.9999)。该结果表明酮康唑在1.0~30.0μg/mL线性关系良好。
最低检出限确定:取不同浓度的对照品溶液进行色谱分析,当主峰峰高为噪音峰高3倍时的浓度即为仪器的最低检出限,酮康唑的最低检出限为10.8ng/mL。
2.5 专属性试验[1]
在2.3色谱条件下,分别对供试样溶液、对照品溶液和阴性对照品溶液(不含酮康唑的微球处理液)进行色谱分析,色谱图见图3。可见供试品与对照品溶液的色谱图分别在保留时间(tR)5.89 min和5.63min处出现单一酮康唑吸收峰,阴性对照品溶液色谱图在tR=5.89min附近没出现任何吸收峰,表明专属性好。理论塔板数按酮康唑峰计算应≥2000。

图3 色谱图Fig.3 Chromatograms
2.6 精密度试验(重复性)
取6份同一批次制备的缓释微球,按2.2方法将药物萃取并定容,制成浓度约为2.50μg/mL的对照品溶液,进行色谱分析,计算实际测得的浓度,结果见表1。
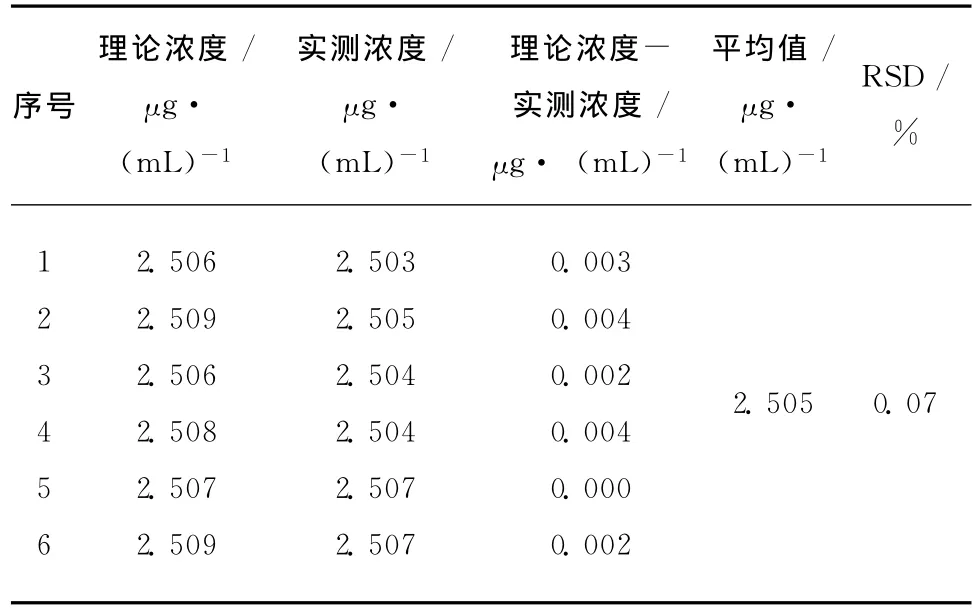
表1 精密度试验(重复性)结果Table1 Precision experiment(repeatability)
2.7 回收率试验
取3份空白微球置于烧杯中,分别精密加入一定量的酮康唑,按2.2方法进行萃取、定容、进行色谱分析,计算回收率,结果见表2。
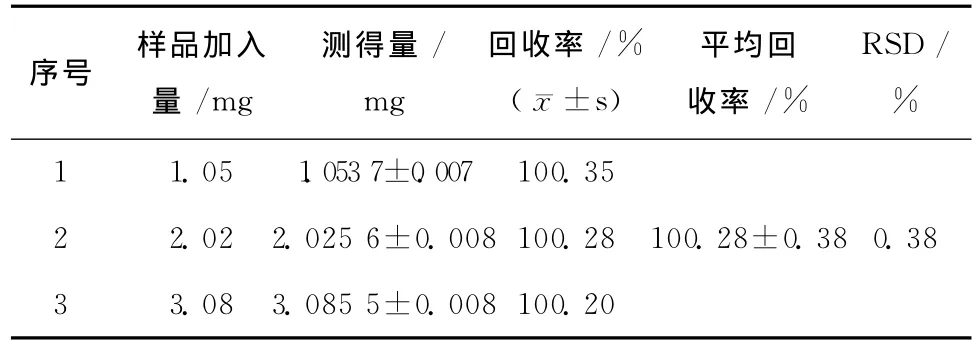
表2 回收率试验(n=3)Table2 Recovery rate test(n=3)
2.8 微球样品中酮康唑含量的测定
按2.2方法制备供试品溶液,按2.3中的色谱条件进样20μL,记录色谱图,按照工作曲线法计算样品中酮康唑含量。载药量为20%的PLGA微球中酮康唑的释放曲线见图4。
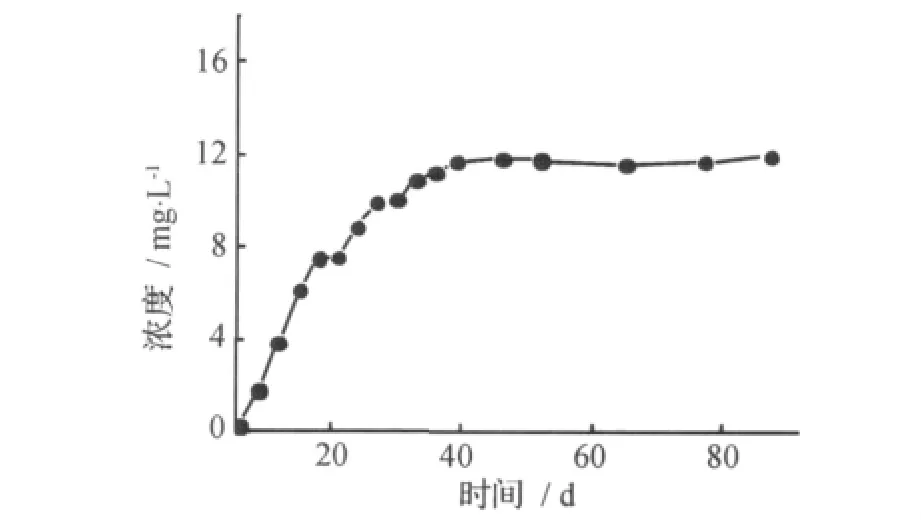
图4 载药量为20%的PLGA微球的释药曲线Fig.4 Release profile of 20%drug-loaded PLGA microspheres
3 结 论
药典中HPLC法测定酮康唑制剂含量的流动相为0.2%的二异丙胺的甲醇溶液和0.5%的醋酸铵溶液(77/23)[3]。但在实际测定时,出峰时间较长约7 min,且峰形不好。其他文献中流动相多为70%~90% 甲醇[4-6]。本文采用甲醇/缓冲盐(80/20)时,由于加入三乙胺扫尾剂,可以改善色谱峰形,得到的是较为尖锐、对称的峰形。该方法保留时间仅为5.89min,因此该方法优于药典中的方法。
实验表明,HPLC法分离效率高、速度快,流动相可选择范围宽、灵敏度高、色谱柱可反复使用,适用于酮康唑微球中酮康唑含量的测定。
[1]徐兰琴,黄 雁.高效液相色谱法直接测定酮康唑含量[J].广州医学院学报,1997,25(4):84-86.
[2]杜继红,王娅芳,周艳飞,等.高效液相色谱法测定复方酮康唑溶液中酮康唑的含量 [J].中国动物保健,2009,(1):103-104.
[3]国家药典委员会.中华人民共和国药典(二部)[M].北京:化学工业出版社,2010:1066.
[4]叶杰胜,孙 莉.HPLC法测定复方酮康唑软膏中酮康唑含量的不确定度评定 [J].安徽医药.2011,15(10):1216-1218.
[5]田随安,张向兵,李永利.消毒洗剂中酮康唑的高效液相色谱测定法 [J].环境与健康杂志,2007,24(10):809-810.
[6]倪 华,范义凤.高效液相色谱法测定复方酮康唑凝胶中酮康唑的含量 [J].交通医学,2008,22(3):317-318.
