HIF-1α及其抑制剂对新生大鼠缺氧缺血性脑损伤时神经细胞凋亡的影响
2012-07-05闫焕利阴怀清范泽卫
闫焕利,阴怀清,杜 洪,范泽卫
缺氧/缺血性脑损伤(hypoxia-ischemia brain damage,HIBD)是新生儿时期最常见且严重的神经系统损伤,其发病机制至今不明,目前缺乏有效的治疗方法。缺氧诱导因子-1α(HIF-1α)是被低氧激活的核转录因子,可以通过调节其靶基因的表达促进或者抑制细胞凋亡[1,2]。有研究显示,抑制HIF-1α的表达在脑缺血后的成年动物模型中产生神经保护作用[3,4],但是HIF-1α及其抑制物在新生动物模型中的作用目前国内外报道甚少,本实验应用HIF-1α的抑制剂2-甲氧基雌二醇(2ME2)作用于新生大鼠缺氧缺血模型,以期为新生儿缺氧缺血性脑损伤的发病机制阐明和治疗提供新思路和理论依据。
1 材料与方法
1.1 试剂与药品 一抗(兔抗鼠 HIF-1α、Bax、Bcl-2)和二抗(即用型SABC试剂盒)及TUNEL细胞凋亡检测试剂盒均购自武汉博士德生物技术有限公司。2ME2系美国Cayman公司提供,由于2ME2是脂溶性粉末物质,本实验采用二甲基亚砜(DMSO)溶解后,用PBS稀释使有毒物质DMSO的浓度降为5%,制成2ME2溶液。
1.2 动物分组及模型制备 120只清洁级、封闭群、新生7d龄Wistar大鼠,体重11g~15g,雌雄不限,购自山西医科大学生理实验室动物房。随机分成假手术组(Sham组,n=8)、缺氧缺血模型组(HIBD组,n=56)、2ME2干预组(2ME2组,n=56)。后两组根据处死时间不同又分为7个亚组:3h、6h、12h、24h、48h、72h、7d,每亚组各8只。Sham组给予麻醉后切开颈部皮肤,游离左侧颈总动脉后缝合皮肤;HIBD组给予麻醉后切开颈部皮肤,结扎左侧颈总动脉,缝合皮肤后休息90min,置于缺氧仓中(含8%氧气)2h。2ME2组同HIBD组制作HIBD模型,各亚组在缺血缺氧后10min给予一次性腹腔注射2ME2溶液(其中2ME2的含量为15mg/kg)。Sham组、HIBD组仅给予等量的DMSO+PBS。
1.3 标本的制备 各组分别在模型制备后3h、6h、12h、24h、48h、72h和7d处死各组动物,断头取左侧脑组织,10%多聚甲醛室温固定24h,切块,石蜡包埋后,连续做冠状切片。
1.4 HE染色 常规石蜡切片→二甲苯脱蜡→梯度酒精脱水→苏木素、伊红染色→二甲苯透明→中性树胶封片→显微镜下观察。
1.5 免疫组化
1.8 统计学处理 应用SPSS 13.0统计学软件,数据以均数±标准差(±s)表示,采用单因素方差分析,两两比较用SNK-q检验,P<0.05为差异有统计学意义。
2 结 果
2.1 组织病理学观察(HE染色) Sham组各时间点脑组织结构层次清晰,细胞排列整齐、形态正常,核仁清楚。HIBD组神经细胞水肿、坏死,胞体溶解,胞浆淡染,核固缩、碎裂、溶解及胶质细胞增生明显。2ME2组各时间点脑组织病理变化较HIBD组明显减轻,细胞排列尚规则,可见斑点状神经元变性、坏死。
2.2 各指标的表达情况(免疫组化)
2.2.1 HIF-1α的免疫组化染色 光镜下观察:HIF-1α阳性染色呈棕黄色的细颗粒沉积,阳性细胞表达主要见于大脑皮层和海马,阳性着色在细胞核和细胞质均可见。阴性对照切片中HIF-1α的免疫反应产物较其他两组明显减少。HIF-1α在Sham组表达微弱;在HIBD组于HIBD后3h增强,12h达高峰,之后下降,至7d时表达最低,但仍高于Sham组(P<
1.5.1 HIF-1α的检测 切片常规脱蜡至蒸馏水,至3%H2O2,室温孵育15min,枸橼酸缓冲液高压热修复2min,降温至室温,PBS液洗,加 HIF-1α的一抗(1∶150),湿盒置于4℃冰箱内过夜,复温至室温,PBS液洗,加二抗,湿盒置于37℃恒温箱内孵育15min,PBS液洗,DAB显色剂显色,自来水中终止,苏木素复染,脱水,透明,中性树胶封片。阴性对照切片用PBS液代替一抗,余步骤相同。
1.5.2 Bax、Bcl-2的检测 用Bax、Bcl-2的一抗代替 HIF-1α的一抗,稀释浓度热修复时间及余步骤与HIF-1α的检测相同。
1.6 TUNEL计数细胞凋亡 严格按照试剂盒提供的实验步骤操作。
1.7 图像分析 采用BI-2000医学图像分析系统(成都泰盟科技有限公司)进行图像采集与分析,在相同光亮强度和放大倍数(10×40)条件下统计阳性细胞平均灰度值(无单位),平均灰度值越高,阳性表达越弱,而平均灰度值越低,阳性表达越强。每只鼠3张片子,每张片子取4个视野,求其均数进行比较和分析。TUNEL计数:高倍镜下(×400)在缺血侧皮质区随机选取10个非重叠视野,计数500个细胞,计算阳性率即凋亡指数(AI)=阳性细胞数/观察细胞数×100%。0.05);2ME2组的表达趋势和 HIBD组相同,但表达水平降低 (P<0.05)。详见表1。

表1 HIF-1α在新生鼠脑组织中的表达(x±s) 平均灰度值
2.2.2 Bax的表达 光镜下观察:Bax阳性染色呈棕黄色的细颗粒沉积,阳性细胞表达主要见于大脑皮层和海马,阳性着色主要位于神经元胞浆。阴性对照切片中免疫反应产物明显减少。Bax在Sham组各时间点低水平表达;在HIBD组,于HIBD后3h即明显增强,至24h达高峰,之后降低,但始终高于Sham组(P<0.05);2ME2组各时间点Bax的表达趋势先降低后升高,2 4h表达最低,各时间点表达水平较HIBD组明显降低(P<0.05)。详见表2。
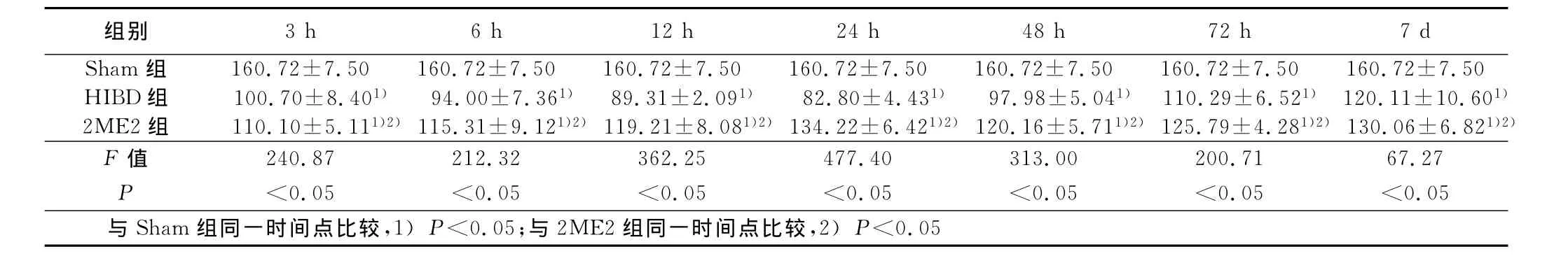
表2 Bax在新生鼠脑组织中的表达(x±s) 平均灰度值
2.2.3 Bcl-2的表达 Bcl-2阳性染色呈棕黄色的细颗粒沉积,阳性细胞表达主要见于大脑皮层和海马,阳性着色主要位于神经元胞浆。阴性对照切片中免疫反应产物明显减少。Bcl-2在Sham组各时间点呈低水平表达;在HIBD组于HIBD后3h增强,至2 4h达高峰,之后降低,但始终高于Sham组(P<0.05);2ME2组各时间点的表达趋势同HIBD组,表达量升高,差异有统计学意义(P<0.05)。详见表3。
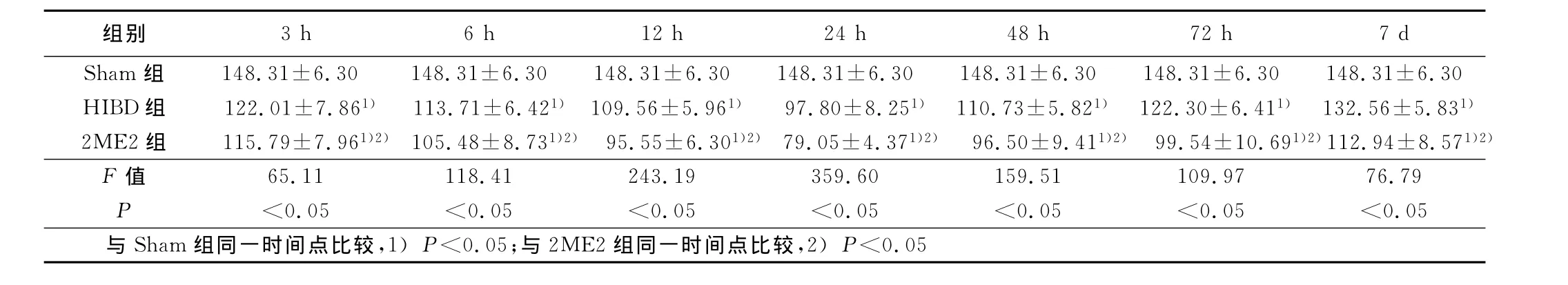
表3 Bcl-2在新生鼠脑组织中的表达(x±s) 平均灰度值
2.2.4 Bax/Bcl-2灰度值的比值 Sham 组为1.08±0.54;HIBD组3h、6h、1 2h、2 4h、4 8h、7 2h、7d各亚组为0.8 3±0 .07、0.82±0.07、0.82±0.05、0.85±0.09、0.89±0.06、0.91±0.06、0.98±0.07;2ME2组各亚组的比值为0.96±0.08、1.07±0.13、1.27±0.14、1.68±0.14、1.27±0.17、1.27±0.14、1.23±0.25。与Sham组比较,HIBD组各个时间点的Bax/Bcl-2平均灰度值比值均低,即表达量比值高,即脑组织的损伤较Sham组重。2ME2组各时间点的Bax/Bcl-2平均灰度值比值较HIBD组均高,即表达量比值较低,提示脑组织的损伤较HIBD组减轻。与Sham组比较,12h之前,2ME2组平均灰度值比值较低,而之后较高,表明12h之内仍表现为对脑组织的损伤作用,12h之后则表现为保护作用。
2.3 脑细胞凋亡情况 TUNEL阳性细胞呈深褐色,主要见于大脑皮层和海马区。HIBD组的脑细胞凋亡最多,2ME2组较之明显减少,Sham组凋亡细胞少见。详见表4。
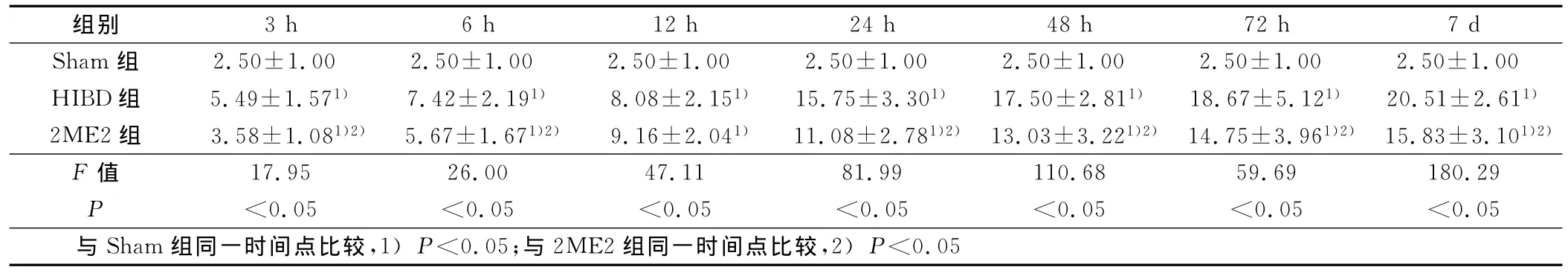
表4 Tunnel法计数脑细胞凋亡(x±s)%
3 讨 论
HIF-1对维持机体的氧平衡有重要作用,由HIF-1α和HIF-1β两个亚基组成,其中HIF-1α亚基在缺氧诱导的细胞凋亡中起关键作用[5]。本实验结果显示,HIF-1α的表达在缺氧缺血先升高后降低,考虑与复氧后泛素系统的活性恢复、HIF-1α降解增加有关。有关HIF-1α在缺氧缺血性脑损伤中究竟是促进还是抑制细胞凋亡,目前尚存在争议。
Bax在未成熟脑中呈高表达,Bax依赖性的细胞凋亡机制在未成熟脑中占明显优势[6]。Bcl-2家族蛋白在细胞凋亡的调节中发挥关键作用[7]。本实验选用的指标Bax和Bcl-2分别是Bcl-2家族蛋白中促凋亡和抗凋亡的重要成员,参与Bax依赖性的细胞凋亡机制。
2ME2是雌激素的正常代谢产物,存在于人体的血液与尿液中,是一种有效的缺氧诱导因子-1α阻滞剂,且专一的影响H IF-1α亚基,并没有影响HIF-1β或其他转录因子[8]。本研究结果显示,应用2ME2抑制HIF-1α后,HIF-1α在 HIBD后的表达明显降低,促进凋亡的蛋白Bax的表达明显降低,抑制凋亡的蛋白Bcl-2的表达明显升高,引起Bax/Bcl-2表达量比值降低,最终脑细胞凋亡明显减少,脑损伤减轻,表明HIF-1α的过度表达对缺氧缺血性脑损伤是有害的,这与 Helton等[9]和Chang等[4]的结果是一致的。Helton和Chang等分别通过特异性的敲除脑组织的HIF-1α基因和使用川芎嗪抑制HIF-1α后发现缺氧缺血性脑损伤减轻。另外Calvert等[10]指出高压氧和正常氧治疗后,HIF-1α的表达较非治疗组均降低,而脑损伤减轻,也可以从一个侧面反映HIF-1α的过度表达对HIBD是有害的。
然而也有报告如Baranova等[11]认为神经元特异性的失活HIF-1α会增加短暂局灶性脑缺血损伤,HIF-1α整体上来说介导的是一个有益的反应。有意义的是Baranova等[11]研究证实,对野生型小鼠MCAO(大脑中动脉缺血)6h~12h后缺氧缺血区的促凋亡基因BNIP3和NIX在mRNA和蛋白水平均上升,在缺氧缺血急性期(<12h)HIF-1α促进细胞凋亡。这和本研究的结果是相同的。因此,推测2ME2发挥神经保护作用的机制是它在缺氧缺血早期抑制HIF-1α表达从而减少此时的促凋亡基因的表达。然而,2ME2的其他性质已报告,如抗新血管生成和改变炎症反应等,这些性质本身也可以减轻缺氧缺血性脑损伤。本实验尚不能肯定2ME2的神经保护作用是通过抑制HIF-1α表达产生的,尚待进一步的研究证实。
另有报告,如Sheldon等[12]采用Cre/Lox技术使前脑主要的神经元特异性的失活HIF-1α,认为HIF-1α缺失会增加新生儿缺氧缺血性脑损伤。但是这个模型中小鼠在缺氧环境中仅仅暴露30min,产生的是中度的脑损伤,这与本实验缺氧程度、动物种类及模型制备等是不同的。目前有研究指出,HIF-1α在缺氧缺血性脑损伤中发挥促进和抑制凋亡的双重作用,可能由于缺氧缺血持续的时间[13]及程度不同引起所调节的靶基因不同产生的。轻、中度缺氧时,HIF-1α的复合物稳定,引起VEGF、EPO等具有神经保护作用的靶基因表达[14]。但在严重或持续缺氧时,HIF-1α使细胞内的p53、BNIP3等水平增高,导致神经毒性[15]。另外,HIF-1α究竟是发挥哪种作用,还依赖于病理刺激的类型[16]及涉及反应的细胞类型[17]等。
综上所述,HIF-1α在缺氧缺血性脑损伤究竟是发挥促进还是抑制脑细胞凋亡的作用,和众多因素有关。本研究表明缺氧缺血后HIF-1α的过度表达对HIBD是有害的。2ME2通过降低急性期HIF-1α的表达,使促凋亡蛋白Bax的表达降低,抑凋亡蛋白Bcl-2的表达升高,Bax/Bcl-2表达量比值降低,改善脑损伤。HIF-1α的抑制剂给新生儿缺氧缺血性脑损伤的治疗带来新的希望。
[1] Semenza GL.Targeting HIF-1for cancer therapy[J].Nat Rev Cancer,2003,3(10):721-732.
[2] Lee JW,Bae SH,Jeong J W,et al.Hypoxia-inducible factor-1(HIF-1)alpha:zts protein stability and biological functions[J].Exp Mol Med,2004,36(1):1-12.
[3] Chen C,Hu Q,Yan J,et al.Multiple effects of 2ME2and D609on the cortical expression of HIF-1alpha and apoptotic genes in a middle cerebral artery occlusion-induced focal ischemia rat model[J].J Neurochem,2007,102:1831-1841.
[4] Chang Y,Hsiao G,Chen SH,et al.Tetramethylpyrazine suppresses HIF-1alpha,TNF-alpha,and activated caspase-3expression in middle cerebral artery occlusion-induced brain ischemia in rats[J].Acta Pharmacol Sin,2007,28(3):327-333.
[5] Carmeliet P,Dor Y,Herbert JM,et al.Role of HIF-1αin hypoxia-mediated apoptosis,cell rolifition and tumor angiogenesis[J].Nature,1998,394:485-490.
[6] Wang X,Carlsson Y,Basso E,et al.Developmental shift of cyclophilin D contribution to hypoxic-ischemic brain injury[J].J Neurosci,2009,29 (8):258-296.
[7] Kroemer G,Galluzzi L,Brenner C.Mitochondrial membrane permeabilization in cell death[J].Physiol Rev,2007,87(1):99-163.
[8] Mabjeesh NJ,Escuin D,LaVallee TM,et al.2ME2inhibits tumor growth and angiogenesis by disrupting microtubules and dysregulating HIF[J].Cancer Cell,2003,3:363-375.
[9] Helton R,Cui J,Scheel JR,et al.Brain-specific knock-out of hypoxia-inducible factor-1alpha reduces rather than increases hypoxic-ischemic damage[J].J Neurosci,2005,25:4099-4107.
[10] Calvert JW,Cahill J,Yamaguchi-Okada M,et al.Oxygen treatment after experimental hypoxia-ischemia in neonatal rats alters the expression of HIF-1alpha and its downstream target genes[J].J Appl Physiol,2006,101:853-865.
[11] Baranova O,Miranda LF,Pichiule P,et al.Neuron-specific inactivation of the hypoxia inducible factor 1alpha increases brain injury in a mouse model of transient focal cerebral ischemia[J].J Neurosci,2007,27:6320-6332.
[12] Sheldon RA,Oserdka RD,Lee CL,et al.HIF-1alpha-deficient mice have increased brain injury after neonatal hypoxia-ischemia[J].Dev Neurosci,2009,31(5):452-458.
[13] Haherman MW,Federoff HJ.HIF-1αand P53promote hypoxiainduced delayed neuronal death in models of CNS ischemia[J].Experi Neurol,1999,159(1):65-72.
[14] Mu D,Chang YS,Vexler ZS,et al.Hypoxia-inducible factor-1alpha and erythropoietin up regulation with deferoxamine salvage after neonatal stroke[J].Exp Neurol,2005,195(2):407-415.
[15] Greijer AE,Vander Wall E.The role of hypoxia inducible factor 1(HIF-1)in hypoxia induced apoptosis[J].J Clin Pathol,2004,57(10):1009-1014.
[16] Anfinova LR,Chavez JC,Lee J,et al.Prosurvival and prodeath effects of hypoxia-inducible factor-1alpha stabilization in a routine hippocampal cell line[J].J Biol Chem,2005,280(5):3996-4003.
[17] Vangeison G,Carr D,Federoff HJ,el al.The good,the bad,and the cell type-specific roles of hypoxia inducible factor-1alpha in neurons and astrocytes[J].J Neurosci,2008,28(8):1988-1993.
