雷帕霉素对脓毒症大鼠肝损害的保护作用
2012-07-02尹建亚汤石林彭登高谢黎明卿国忠
尹建亚 汤石林 彭登高 谢黎明 卿国忠
脓毒症(sepsis)通常导致多器官功能衰竭(MODS),而肝脏损害是脓毒症MODS的最常见表现。研究发现,肿瘤坏死因子α(TNF-α)、白细胞介素6(IL-6)等炎症因子的过量释放是脓毒症诱发肝脏损害的关键因素[1]。哺乳动物雷帕霉素靶蛋白(The mammalian target of rapamycin, mTOR)是调节细胞增殖、凋亡等的重要信号蛋白,近来研究发现其在炎症反应的病理生理过程中扮演重要角色[2]。Kimball等[3]发现,在脓毒症诱发肝损害中mTOR起着重要作用。雷帕霉素是与mTOR结合并使其失活的临床常用免疫抑制剂,其能否减轻脓毒症所致肝脏损害目前尚不明确[4]。本试验拟建立脓毒症大鼠肝损害模型,观察雷帕霉素对肝脏损害的保护作用及其机制。
1 资料与方法
1.1 实验动物及分组 50只Wistar雄性大鼠,购自南华大学实验动物中心,随机分成三组:假手术组(10只)、脓毒症+雷帕霉素组(20只)和脓毒症+PBS组(20只)。雷帕霉素购自华北制药集团(1mg/mL),按1mg/kg/d在实验前2h进行灌胃处理。
1.2 脓毒症模型制作 参照金惠铭的方法[5],采用盲肠结扎穿刺法(CLP)制作脓毒症模型。大鼠经乙醚麻醉后,常规消毒腹部,经正中切口打开腹腔后小心分离盲肠,然后用3号丝线环形结扎盲肠。结扎完毕后仔细检查肠道通畅情况。在与肠系膜相对的盲端肠壁浆膜面用9号针头穿刺二次(针孔间距约3mm),第一针孔距盲端约3mm。轻轻将肠道放回原处,关闭腹腔并缝合后补充生理盐水(5mL/100g体重)。假手术组打开腹腔,但不进行CLP处理。
1.3 肝脏功能生化指标检测 从大鼠眼眶取血约2mL,离心后予-20℃冰箱冻存,采用终点法检测不同时间点血清丙氨酸氨基转移酶(ALT)和天门冬氨酸氨基转移酶(AST)水平。
1.4 炎症因子水平的检测 采用双抗体夹心ELISA法检测血清TNF-α和IL-6的水平。按说明书方法,将100μL血清样品和标准品加入板孔,盖上封板膜后室温孵育1h。洗板3次后加入生物素标记TNF-α和IL-6抗体,经过温育、洗涤、显色等过程后,用450nm波长读OD值,绘制标准曲线,求出TNF-α和IL-6浓度。
1.5 统计学方法 采用SPSS13.0软件对数据进行分析,数据以(±s)表示,多组间均数比较采用单因素方差分析,P<0.05为差异有统计学意义。
2 结果
2.1 雷帕霉素对大鼠ALT和AST水平的影响 假手术组大鼠不同时间点(3、6、12、24h)血清ALT和AST浓度较低。CLP术后,血清ALT和AST浓度迅速升高,ALT于24h到达高峰,AST于12h到达高峰。使用雷帕霉素处理后,血清ALT和AST水平相对于CLP+PBS组明显降低,两组在不同时间点(6、12、24h)差异存在显著性(P<0.05)(如图1所示)。
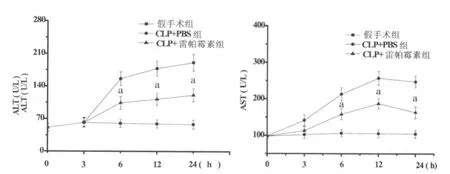
图1 大鼠血清ALT和AST表达的变化(CLP+雷帕霉素vs CLP+PBS,aP<0.05)
2.2 雷帕霉素对大鼠TNF-α和IL-6表达水平的影响 假手术组大鼠不同时间点(3、6、12、24h)血清TNF-α和IL-6表达水平较低。CLP术后,血清TNF-α和IL-6浓度迅速升高,于12h到达高峰。使用雷帕霉素处理后,血清TNF-α和IL-6水平相对于CLP+PBS组明显降低,两组在不同时间点(6、12、24h)差异存在显著性(P<0.05)(如图2所示)。

图2 大鼠血清TNF-α和IL-6水平的变化(CLP+雷帕霉素vs CLP+PBS,aP<0.05)
3 讨论
脓毒症主要是由感染因素引起的全身炎症反应,炎症因子的过度释放在其病理生理过程中起着重要作用[6]。炎症因子通过与其受体结合,激活胞内信号途径,直接参与对多种组织细胞的损伤过程。脓毒症易并发MODS,肝脏损害是其主要表现。在本实验中,我们采用CLP术建立了大鼠脓毒症模型,结果发现脓毒症大鼠肝细胞损伤的指标ALT和AST水平明显增高,这与其他文献的报道一致[1]。主要促炎因子TNF-α和IL-6在脓毒症并发MODS中发挥了重要的作用,我们发现CLP术后3h大鼠血清的TNF-α和IL-6水平显著增高,提示TNF-α和IL-6可能参与了脓毒症大鼠肝脏的损伤。
mTOR是哺乳动物细胞合成的一种丝/苏氨酸蛋白激酶,能够整合细胞内多条信号途径,参与细胞的增殖、分化及对免疫炎症的调节作用[7]。在脓毒症动物模型中,研究者发现mTOR信号被激活,并参与了肝脏和骨骼肌组织中多种炎症因子的释放[3]。雷帕霉素通过与FKBP12组成复合物,抑制mTOR的活性[2]。在本研究中,相对于PBS组,雷帕霉素组血清ALT和AST的水平明显降低,提示雷帕霉素对脓毒症大鼠肝脏损害具有保护作用。虽然雷帕霉素对脓毒症大鼠肝脏损害的保护作用机制还有待进一步探讨,但雷帕霉素下调血清TNF-α和IL-6的水平,提示抑制炎症反应可能是其肝脏保护的作用机制之一。张元晴等[8]发现雷帕霉素通过抑制淋巴细胞增殖抑制刀豆素A诱发的肝脏损害及其炎症反应。Fielhaber等[9]发现雷帕霉素通过抑制核因子kB(NF-kB)的激活下调肺脏炎症因子的表达。雷帕霉素是否通过调节淋巴细胞增殖、NF-kB激活或者直接抑制mTOR活性来降低脓毒症大鼠肝脏损害和炎症反应将在后续研究中进一步探讨。
[1]Wang YY,Ryg U,Dahle MK,et al.Liver X receptor protects against liver injury in sepsis caused by rodent cecal ligation and puncture[J].Surg Infect(Larchmt),2011,12(4):283-289.
[2]Frost RA,Lang CH.mTor signaling in skeletal muscle during sepsis and inflammation:where does it all go wrong?[J].Physiology (Bethesda),2011,26(2):83-96.
[3]Kimball SR,Orellana RA,O'Connor PM,et al.Endotoxin induces differential regulation of mTOR-dependent signaling in skeletal muscle and liver of neonatal pigs[J].Am J Physiol Endocrinol Metab,2003,285(3):E637-644.
[4]郑传东,苟欣,张力,等.雷帕霉素对肾缺血再灌注大鼠肝脏功能和超微结构的保护作用[J].中国医药科学,2012,2(1):25-26.
[5]金惠铭.盲肠结扎穿刺后的大鼠败血症模型[J].中国病理生理杂志,1990,6(2):126-127.
[6]Orellana RA,Jeyapalan A,Escobar J,et al.Amino acids augment muscle protein synthesis in neonatal pigs during acute endotoxemia by stimulating mTOR-dependent translation initiation[J].Am J Physiol Endocrinol Metab,2007,293(5):E1416-425.
[7]Torres VE,Boletta A,Chapman A,et al. Prospects for mTOR inhibitor use in patients with polycystic kidney disease and hamartomatous diseases[J].Clin J Am Soc Nephrol,2010,5(7):1312-1329.
[8]Zhang Y,Xiao X,Li X,Wei H.Rapamycin prevents concanavalin A-induced liver injury by inhibiting lymphocyte activation[J].J Gastroenterol Hepatol,2009;24(8):1457-62.
[9]Fielhaber JA,Carroll SF,Dydensborg AB,et al.Inhibition of Mammalian Target of Rapamycin Augments Lipopolysaccharide-Induced Lung Injury and Apoptosis[J].J Immunol,2012,188(9):4535-4542.
