视黄酸对乳鼠心肌细胞凋亡及凋亡相关因子表达的影响*
2012-06-29聂园园仇小强
聂园园,仇小强
(桂林医学院:1.附属医院心内科;2.公共卫生学院,广西桂林541001)
先天性心脏病(先心病)的发病率约占全部活产婴儿的0.6%~0.9%,估计我国每年有15万左右的先心病患儿出生。先心病已严重影响我国婴幼儿的身心健康及人口生存质量。有关先心病的病因,目前认为主要是遗传因素、环境因素、母体自身的因素或各危险因素综合作用所致。在怀孕早期母体受到某些病毒或药物的影响,使心肌细胞的发育、增殖、凋亡过程受到影响,都将有可能导致心脏发育的畸形[1-2]。
视黄酸(retinoic acid,RA)是维生素A在体内一种重要的生物活性物质,在胚胎和胎儿发育的关键时期发挥着重要作用[3]。在心脏发育中,视黄酸能影响早期心肌前体细胞区域化,心脏前后轴建立、左右决定、心内膜垫的形成,对心肌细胞和成纤维细胞具有抗生长活性,过量或缺乏视黄酸均可导致心脏发育的畸形,但其导致心脏畸形的确切机制目前尚不明确。本实验通过检测视黄酸对心肌细胞凋亡与凋亡相关蛋白、基因的影响,探讨视黄酸对未成熟心肌细胞影响的机制,为进一步研究先心病的发病机制及预防途径提供理论依据。
1 材料与方法
1.1材料 (1)实验动物:0~2日龄的Balb/c小鼠乳鼠30只,购自桂林医学院实验动物中心。采用胰蛋白酶+Ⅱ型胶原酶逐次消化获得乳鼠心肌细胞。(2)试剂与主要仪器:20%胎牛血清(FBS)、含各种氨基酸和葡萄糖的培养基(DMEM)、胰蛋白酶均购自Gibco公司,Ⅱ型胶原酶、5-溴脱氧尿苷(5-Brdu)、视黄酸购自Sigma公司,TRizol购自大连宝生物公司,逆转录试剂盒购自美国Promiga公司,Taq酶购自日本TaKaRa公司,引物合成购自上海生工生物公司,PCR扩增仪、凝胶成像仪购自北京天能公司,BCA蛋白浓度测定试剂盒购自上海碧云天公司,一抗兔抗小鼠Fas,Fasl购自美国Santa Cruz公司,辣根过氧化物酶(HRP)标记羊抗兔购自北京中杉金桥生物公司。
1.2方法
1.2.1乳鼠心肌细胞的分离及纯化 无菌条件下取出Balb/c小鼠乳鼠心脏,剪成约1.0mm×1.0mm×1.0mm的小块,加入0.08% 胰蛋白酶+Ⅱ型胶原酶,37℃水浴7~8min,吸取上清液,加入适量培养基终止消化,重复消化约5~6次,至组织块成透明状为止。收集每次消化的细胞,1 000r/min离心10min。再加入含有5-Brdu的20%FBS的DMEM高糖培养液充分混悬,接种于培养皿中,置5%CO2培养箱中培养1.5~2.0h后重新接种在96孔板中,采用差速贴壁法和化学药物抑制法去除成纤维细胞,纯化心肌细胞。将培养72h的心肌细胞分组处理,用于实验。
1.2.2实验分组 心肌细胞培养72h后进行干预。将其分为5组,对照组,不同浓度视黄酸(0.5、1.0、2.0、4.0μmol/L)干预组(即0.5干预组、1.0干预组、2.0干预组、4.0干预组)。对照组用20%FBS的DMEM培养液培养,其他各组用含有不同浓度视黄酸的培养液培养,在用药干预24h后观察细胞形态、检测相关因子。每组设6个复孔。
1.2.3倒置显微镜下观察细胞形态 纯化后的心肌细胞呈圆形,细胞培养6h左右开始贴壁生长,逐渐变成梭形、多边形、不规则形等不同的形状,约12h可见细胞自发性搏动,搏动的频率和节律不规则。72h后细胞逐渐伸出伪足相互连接成细胞簇,似菊花状。心肌细胞搏动有力、同步,搏动频率为60~110次/min。
1.2.4流式细胞仪检测细胞凋亡率 收集药物干预24h后不同用药浓度组的心肌细胞,制成单细胞悬液,离心弃上清液,PBS洗涤3次,70%乙醇固定,4℃放置1h后,离心收集固定细胞,PBS洗去固定液,加入20μL Rnase A,37℃孵育30 min,暗处加PI染液,冰浴30min,染色后以300目筛网过滤。调整细胞浓度为1×105/mL后用流式细胞仪,在波长488nm下用Multicycle DNA分析软件行凋亡率测定,实验重复3次。
1.2.5RT-PCR检测Fas、Fasl mRNA基因的表达 培养72 h的心肌细胞,加入不同浓度的视黄酸(0.5,1.0,2.0,4.0 μmol/L),继续培养24h后,收集各种细胞。用TRizol试剂提取高质量的mRNA。按照反转录试剂盒说明合成cDNA。鼠内参 β-actin 上 游 引 物:5′-CCT TCT TGC AGC TCC TCC GTC-3′,下游引物:5′-TCT CCA TAT CGT CCC AGT TGG TG-3′;Fas上游引物:5′-ACA AAG TTC CAA TTA TAA GCT CC-3′,下游引物:5′-GAG ACA TTC ATT GGC ACA C-3′;FasL上游引物:5′-CAT GCC AGA AGA TAC CAG T-3′,下游引物5′-GTA TTG TTC AAT GAC GAC CTG-3′;采用一步法RT-PCR系统做反转录聚合酶链反应,扩增产物进行2%琼脂糖凝胶(含EB)电泳,溴化乙淀染色,用图像分析仪进行分析。
1.2.6Western blot检测Fas、Fasl蛋白的表达 取出已用药24h的心肌细胞,加入适量细胞裂解,离心后取上清液,BCA法测定蛋白质含量。聚丙烯酰胺凝胶电泳后行Western blot。相应蛋白表达值为条带的灰度值除以β-actin内参校正。
1.3统计学处理 采用SPSS13.0统计软件进行分析,各组间比较采用多样本均数比较的方差分析,以P<0.05为差异有统计学意义。
2 结 果
2.1倒置显微镜下观察细胞损伤情况 对照组心肌细胞交织成细胞簇,同步收缩,搏动。24h后显微镜下观察各组细胞损伤情况。0.5干预组及1.0干预组的心肌细胞损伤不明显。细胞搏动稍减弱,细胞凋亡在20%以下。2.0干预组和4.0干预组心肌细胞数量明显减少,凋亡率大于30%;细胞变圆、团缩,细胞搏动力减弱,速率减慢。随着药物浓度的增加,细胞损伤更明显,凋亡率更高。
2.2流式细胞仪检测细胞凋亡率 用药24h不同浓度视黄酸干预后心肌细胞细胞静止期(G0)、DNA合成前期(G1)、DNA合成期(S)、DNA合成后期(G2)及细胞分裂期(M)的凋亡率,见表1。
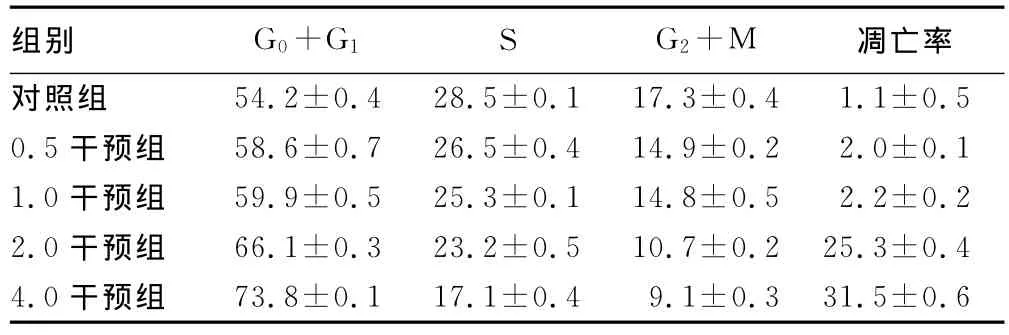
表1 各组心肌细胞在不同细胞周期的比例及细胞凋亡率的比较(%)
2.3凋亡相关基因Fas、Fasl mRNA表达 与对照组比较,2.0、4.0干预组Fas,Fasl mRNA表达水平均上升(P<0.05),且随着浓度的越高表达越强。0.5、1.0干预组与对照组比较Fas,Fasl mRNA表达有所增强,但差异无统计学意义(P>0.05),见图1、2。
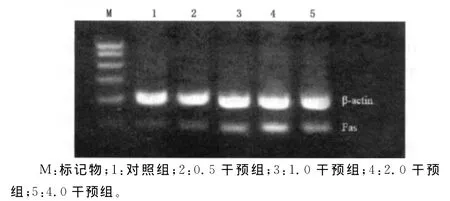
图1 用药24h后各药物浓度组Fas mRNA表达水平
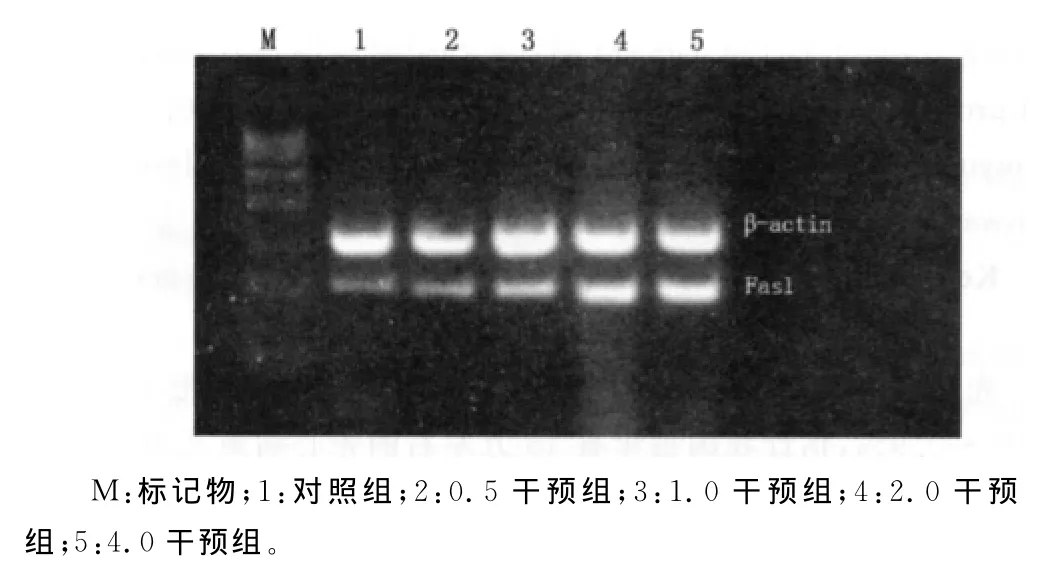
图2 用药24h后各药物浓度组Fasl mRNA表达水平
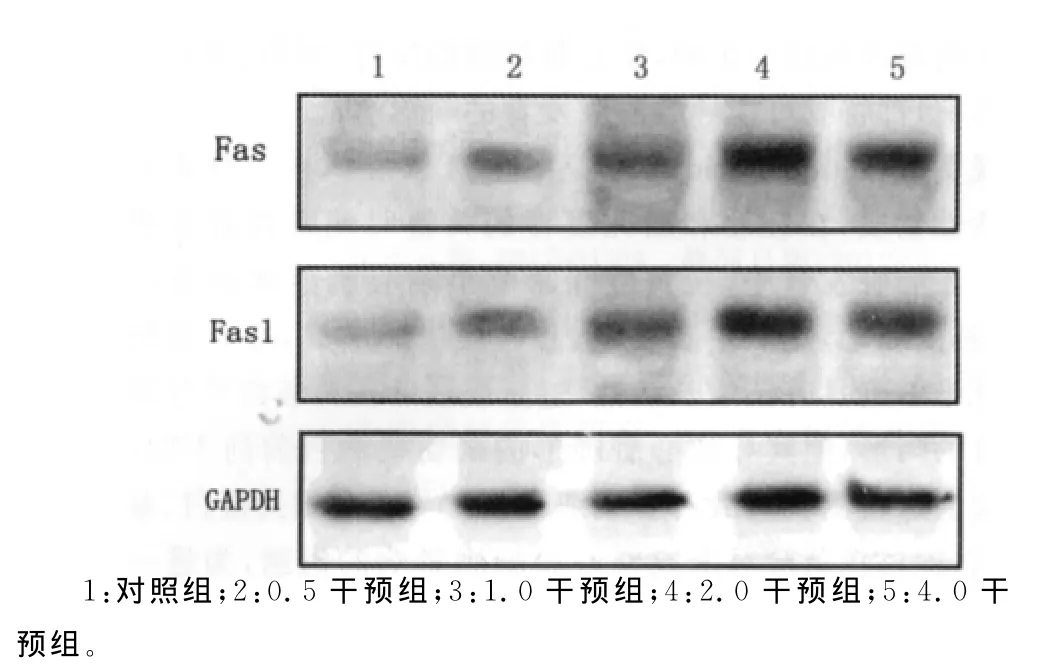
图3 用药24h后各药物浓度组Fas、Fasl蛋白表达水平
2.4Western blot检测Fas,Fasl蛋白的表达 以甘油醛-3-磷酸脱氢酶(GAPDH)为内参,与对照组比较,2.0、4.0干预组Fas、Fasl蛋白表达水平均增强(P<0.05),且随着浓度增高表达增强。0.5、1.0干预组与对照组比较,Fas、Fasl蛋白水平表达有所增强,但差异无统计学意义(P>0.05),见图3。
3 讨 论
视黄酸与脊椎动物从受孕至死亡的整个过程密切相关,参与调控细胞的分化、增殖和凋亡。视黄酸作为内源性信号分子,通过与细胞核内的视黄酸受体结合改变特异基因的转录,其在脊椎动物心脏发育的各阶段(包括心脏原基的出现、心管形成、左右不对称发育、心脏环化、腔室形成、内流系统形成、心壁形成及传导系统发生等阶段)发挥重要的调节功能[4-6]。生理剂量视黄酸在细胞增殖、分化、凋亡及生殖、视觉、各种动物的胚胎模式形成等生物学事件中发挥重要作用,是胚胎发育过程中不可或缺的形态发生素[7]。然而视黄酸也是一种致畸因子,胚胎发育过程中,过多摄入视黄酸或视黄酸缺乏均可导致哺乳动物神经管、心脏和颜面部等多种畸形的发生[8-9]。
以视黄酸为致畸原的动物实验,即在小鼠不同孕期给予一定剂量的视黄酸,将导致唇腭裂、先心病、短肢畸形、颜面、脊椎骨畸形等出生缺陷的动物模型已经建立。然而以视黄酸为致畸原对细胞凋亡影响的研究发现,视黄酸对细胞的影响与细胞类型和视黄酸的浓度密切相关[10]。Chang等[11]和 Zhang等[12]的研究均进一步验证了此观点。本实验通过采用不同药物浓度视黄酸作用于心肌细胞,在连续培养细胞时观察到视黄酸0.5、1.0μmol/L干预组在用药24h后心肌细胞损伤不明显,细胞搏动稍减弱,细胞凋亡在20%以下;视黄酸2.0、4.0 μmol/L干预组心肌细胞受损明显,细胞搏动力减弱,搏动频率降低;细胞凋亡明显增加,呈逐渐增强趋势;本研究与刘苗等[13]研究采用不同浓度视黄酸干预胚鼠心肌细胞使心肌细胞损伤结果相一致,但在导致细胞损伤的最佳药物浓度及作用时间上有差异,以及检测的凋亡信号因子也有所不同。Fas及Fasl在心肌细胞有丰富的表达,Fas主要位于心肌细胞膜上,Fasl是Fas的天然配体,当表达Fas的心肌细胞和活性细胞的Fasl交联后,激活Fas/Fasl信号凋亡途径,最终导致靶细胞凋亡。本实验结果显示,Fas、Fasl mRNA基因与蛋白表达明显增加。实验提示一方面视黄酸通过上调细胞膜表面Fas蛋白的表达,直接启动细胞凋亡的信号传导系统,促使细胞凋亡的发生。这与文献[14-15]研究相一致,即药物通过影响Fas受体表达,上调或下调Fas蛋白的表达,促进或抑制细胞凋亡的发生,提示该药可能对这种细胞有毒性或保护作用。另一方面视黄酸作用于心肌细胞后,Fas表达增加,心肌细胞对Fas/Fasl介导的凋亡更加敏感,使细胞凋亡不断发生。然而细胞凋亡是一个非常精密、复杂的调控系统,在其过程中又受到不同诱导因子的调节,虽然国内外学者对视黄酸致畸的机制进行了大量深入的研究,但其确切的作用机制尚不能确定。
综上所述,Fas/Fasl介导的死亡受体信号转导途径为细胞凋亡三大途径之一,在本实验中随着视黄酸药物浓度增加心肌细胞的凋亡率不断增加,而Fas、Fasl的基因及蛋白表达均增加,提示视黄酸诱导心肌细胞的凋亡,其作用机制与Fas/Fasl介导死亡受体途径导致细胞凋亡密切相关,是否与细胞凋亡其他途径相关及详细机制还有待进一步研究。
[1]Lin SC,DolléP,Ryckebüsch L,et al.Endogenous retinoic acid regulates cardiac progenitor differentiation[J].PNAS,2010,10(7):9234-9239.
[2]Sato H,Shiraishi I,Takamatsu T,et al.Detection of TUNEL-positive cardiomyocytes and c-kit-positive progenitor cells in children with congenital heart disease[J].J Mol Cell Cardiol,2007,43(3):254-261.
[3]González-Reyes S,Martínez L,Tovar JA.Effects of prenatal vitamins A,E,and C on the hypoplastic hearts of fetal rats with diaphragmatic hernia[J].J Pediatr Surg,2005,40(8):1269-1274.
[4]Choi YH,Cowan DB,Moran AM,et al.Myocyte apoptosis occurs early during the development of pressure-overload hypertrophy in infant myocardium[J].J Thorac Cardiovasc Surg,2009,137(6):1356-1362.
[5]Guadix JA,Ruiz-Villalba A,Lettice L.Wt1controls retinoic acid signalling in embryonic epicardium through transcriptional activation of Raldh2[J].Development,2011,13(8):1093-1097.
[6]Pan J,Baker KM.Retinoic acid and the heart[J].Vitam Horm,2007,75(2):257.
[7]Brade T,Kumar S,Cunningham TJ.Retinoic acid stimulates myocardial expansion by induction of hepatic erythropoietin which activates epicardial Igf2[J].Development Jan,2011,138(6):139-148.
[8]韩静,肖颖,林久祥,等.全反式视黄酸致小鼠腮弓畸形的机制研究[J].癌变·畸变·突变,2006,18(3):194-197.
[9]Zile MH.Vitamin a requirement for early cardiovascular morphogenesis specification in the vertebrate embryo:insights from the avian embryo[J].Exp Biol Med,2004,229(7):598-606.
[10]Armstrong JL,Redfern CP,Veal GJ.13-cis retinoic acid and isomerisation in paediatric oncology——is changing shape the key to success?[J].Biochem Pharmacol,2005,69(9):1299-2306.
[11]Chang Q,Chen Z,You J,et al.All-trans-retinoic acid induces cell growth arrest in a human meduloblastoma cell line[J].J Neurooncol,2007,84(3):263-267.
[12]Zhang YL,Nie YH,Xu JN,et al.Efects of A11-trans retinoic acid on the rat Miller cell in vitro[J].Eye Sci,2007,23(3):163-167.
[13]刘苗,吴小燕,徐佳伟,等.外源性视黄酸调节胚鼠心肌TBX1基因表达的研究[J].华中医学杂志,2008,32(3):158-160.
[14]Xie ZL,Koyama T,Abe K,et al.Effect of an angiotensinconverting enzyme inhibitor on the expression of Fas protein and on apoptosis in rat ventricles subjected to reperfusion after ischemia[J].Eur J Cardiovasc Prev Rehabil,2005,12(2):164-168.
[15]Yamaoka M,Yamaguchi S,Suznki T,et al.Apoptosis in rat cardiac myocytes induced by Fas ligand:priming for Fas-mediated apoptosis with doxorubicin[J].J Mol Cell Cardiol,2000,32(4):881-889.
