肝癌细胞疫苗对荷瘤小鼠脾淋巴细胞IFN-γ生成及肿瘤浸润淋巴细胞的影响*
2012-06-29李正芳王智彪
苏 立,周 颦,李正芳,傅 敏,白 平,刘 楠,王智彪
(1.重庆市中医院肿瘤科 400011;2.重庆市中医院内分泌科 400011;3.重庆医科大学医学超声工程研究所 400016)
研究发现高强度聚焦超声(high intensity focused ultrasound,HIFU)辐照肿瘤细胞制备的肿瘤疫苗(简称瘤苗)可使免疫小鼠获得一定的抗同源肿瘤的免疫力[1],但瘤苗诱导的动物体内免疫功能的变化尚不清楚。T淋巴细胞介导的细胞免疫是抗肿瘤免疫反应的主体,体内某些细胞因子的增多是细胞免疫活化的标志,而淋巴细胞在肿瘤中的浸润程度通常被认为与肿瘤宿主的预后相关[2-3]。本实验以H22荷瘤小鼠为模型,在观察HIFU瘤苗免疫小鼠大体抗肿瘤效应的基础上,探讨免疫后的荷瘤小鼠脾淋巴细胞干扰素-γ(IFN-γ)生成以及肿瘤浸润淋巴细胞(tumor infiltrating lymphocyte,TIL)的变化,以了解HIFU瘤苗免疫对小鼠免疫功能的影响。同时以高温凝固方法制备的瘤苗作对照,比较HIFU瘤苗效能。
1 材料与方法
1.1材料 HIFU肿瘤治疗系统由重庆医科大学超声工程研究所提供;雌性BALB/c小鼠共108只,6~8周龄,体质量18~22g,由重庆医科大学实验动物中心提供;H22小鼠肝癌细胞株由重庆医科大学实验细胞库提供;兔抗小鼠CD4及兔抗小鼠CD8抗体购自北京博奥森公司,免疫组化SP试剂盒、DAB显色试剂盒及小鼠IFN-γELISA试剂盒购自北京中杉金桥公司;ELX800酶标仪购自美国Bio-Tek公司。
1.2方法
1.2.1制备HIFU和高温瘤苗 将H22细胞调整浓度为1×107/mL,HIFU辐照该细胞悬液制成HIFU瘤苗,HIFU参数为:声强1 054W/cm2、焦距110mm、频率0.8mHz、时间80s。另取相同的细胞悬液65℃高温水浴1h制备高温瘤苗。
1.2.2小鼠肿瘤体积测量 将60只小鼠,随机分为3组,每组20只,每组分别接受HIFU瘤苗、高温瘤苗及生理盐水皮下注射,每只0.2mL,每周1次,连续4周,第5周以对数生长期的H22细胞4×106个/只小鼠腋前皮下注射。接种后游标卡尺每周测量小鼠瘤体长径(a)与横径(b),以(a×b2)/2计算肿瘤体积[4]。
1.2.3小鼠脾淋巴细胞IFN-γ生成水平检测 小鼠18只,分3组,每组6只,每组分别接受HIFU瘤苗、高温瘤苗、生理盐水皮下注射及再接种H22细胞同前,接种H22细胞后1周处死,无菌取脾,于金属筛网上剪碎研磨,收集匀浆以小鼠淋巴细胞分离液梯度离心,获得脾淋巴细胞悬液。取此淋巴细胞2×104个与H22细胞2×103个混合加入96孔板,在含10%FBS的RPMI1640中共育48h,每组设3个复孔,之后1 500r/min离心10min,取上清液用ELISA法测IFN-γ。ELISA按试剂盒说明步骤进行,以酶标仪测492nm波长处吸光值。
1.2.4免疫组化 将30只小鼠,分3组,每组10只,按同样方法分别免疫并接种,接种H22细胞2周后处死小鼠,切取其皮下肿瘤,4%中性多聚甲醛固定、常规脱水、石蜡包埋,5μm切片。免疫组化按照试剂盒说明书进行。
1.2.5TIL半定量分析 镜下细胞膜或细胞质显现棕黄色判定为CD4+或CD8+细胞。阳性细胞半定量分析参考文献[2-3]方法:每个标本镜下随机选取10个高倍视野(×200),以肿瘤内部阳性细胞分布最丰富的3个视野作为计数范围。根据视野内平均阳性细胞数(1~<20、20~<50、≥50),将细胞浸润程度分为Ⅰ、Ⅱ、Ⅲ3个等级。计数时排除肿瘤边缘及坏死区域。
1.3统计学处理 采用SPSS13.0统计软件进行数据分析,肿瘤体积数据用析因方差分析,肿瘤淋巴细胞浸润结果行Mann-Whiney U秩和检验,其他数据行单因素方差分析,计量数据结果以s表示,以P<0.05为差异有统计学意义。
2 结 果
2.1各组小鼠肿瘤体积和生存期比较 因生理盐水组小鼠在接种H22细胞21d后出现较多死亡,故记录21d内各组的肿瘤体积。21d内生理盐水组小鼠死亡2只,按死亡时肿瘤体积记录,结果显示各组小鼠间肿瘤体积有差异,21d时生理盐水组肿瘤体积为(3 509±524)mm3,高温瘤苗组为(2 001±472)mm3,HIFU瘤苗组为(1 601±383)mm3(P<0.05),见图1。观察生存情况至6周,各组小鼠生存期存在明显差异,平均生存期生理盐水组为(23.3±1.0)d、高温瘤苗组为(31.8±0.9)d,HIFU瘤苗组为(35.7±1.1)d(P<0.05),见图2。
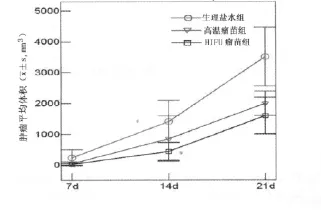
图1 接种H22细胞21d内各组小鼠的肿瘤体积比较
2.2小鼠脾淋巴细胞分泌IFN-γ水平 各组小鼠免疫后在H22细胞的再刺激下,其脾淋巴细胞IFN-γ分泌水平为:生理盐水组(1 133±208)pg/mL,高温瘤苗组(6 333±351)pg/mL,HIFU瘤苗组(9 366±1 026)pg/mL,组间比较差异有统计学意义(P<0.05)。
2.3瘤苗对各组小鼠TIL的影响 两种瘤苗免疫的荷瘤小鼠肿瘤组织中CD4+、CD8+细胞浸润均较明显。根据阳性细胞浸润分级计算,高温瘤苗及HIFU瘤苗组肿瘤组织内CD4+、CD8+细胞浸润程度较生理盐水组有显著提高(P<0.05),两种瘤苗组间TIL浸润程度差异无统计学意义(P>0.05),见表1。

图2 接种H22细胞后各组小鼠的生存曲线
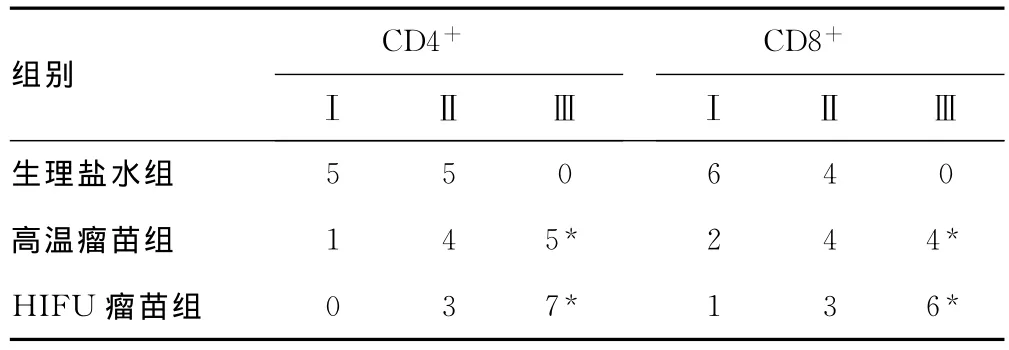
表1 各组小鼠肿瘤淋巴细胞浸润程度的分布(n=10)
3 讨 论
肿瘤疫苗作为肿瘤免疫治疗的重要部分被广泛研究,其种类较多,包括肿瘤细胞疫苗、树突状细胞疫苗、肿瘤肽类疫苗及肿瘤DNA疫苗等[5],又可依据针对肿瘤抗原的不同分为全肿瘤细胞即多表位疫苗和特定抗原表位疫苗。全肿瘤细胞疫苗携带了完整的肿瘤抗原库,无需筛选肿瘤特异性抗原,这是全肿瘤细胞疫苗相对特定抗原疫苗的优势。目前灭活肿瘤细胞已获得全肿瘤细胞疫苗的方法有:反复冻融、热凝固、放射辐照、紫外线照射、甲醛固定及光动力杀伤等,但有的方法效果并不理想[6],本研究以HIFU辐照肿瘤细胞制备疫苗,为研制肿瘤疫苗提供了一种新方法,HIFU瘤苗免疫小鼠后大体观察发现肿瘤生长受抑制,小鼠生存期延长,提示HIFU瘤苗具有提高实验动物抗肿瘤免疫力的效果。
抗肿瘤免疫的主体是细胞免疫,由1型辅助性T细胞(Th1)介导,而2型辅助性T细胞(Th2)介导免疫应答向体液免疫发展。Th1细胞产生的细胞因子主要是IFN-γ、IL-2,而Th2细胞主要分泌IL-4、IL-5。Th1类和Th2类细胞因子的平衡决定了哪种免疫反应占主导地位,Th细胞由分泌Th1类细胞因子向Th2类因子转换可能是抗肿瘤免疫失效的机制之一[7]。IFN-γ也可由活化的CD8+细胞分泌,主要是细胞毒性T淋巴细胞(cytotoxic T lymphocyte,CTL)分泌,故IFN-γ水平增高可以作为是细胞免疫增强和CTL活化的标志,这对抗肿瘤是有益的。本实验发现经HIFU瘤苗免疫,荷瘤小鼠脾淋巴细胞在同源肿瘤再刺激下IFN-γ生成较未免疫小鼠成倍增加,提示经瘤苗免疫小鼠体内产生了对该肿瘤敏感的淋巴细胞群,也表明细胞免疫的增强及CTL细胞激活。
免疫组化结果显示两种瘤苗免疫后小鼠TIL数量较未免疫组有显著提高。文献报道TIL数量是有利于宿主的预后因子,如CD4+和CD8+细胞浸润较多的食管鳞癌患者有较长的生存期[3],而CD3+细胞在肿瘤周边浸润较少是宫颈癌复发的高危因素[8]。有研究表明肿瘤实质中的TIL数量比肿瘤间质或边缘的TIL数量和预后的关系更加确切[9],本实验中以肿瘤实质内的TIL为观察对象,发现瘤苗组肿瘤浸润CD4+和CD8+细胞较未免疫组增多,这与观察到的免疫小鼠肿瘤生长受抑制是吻合的。肿瘤生长抑制和动物生存期延长在HIFU瘤苗组较高温瘤苗组更加明显,但两种瘤苗组间TIL浸润程度无显著差异,其原因可能在于除TIL的数量外,宿主预后与TIL之间还存在其他的影响因素[10],如TIL的具体类型被认为是另一重要的预后因素,CD4+辅助细胞被认为对诱导CTL产生及维持CTL记忆有明确作用,而CD4+细胞中的调节T细胞(Treg)亚群,则可能下调抗肿瘤免疫反应[7]。本实验中未能区分CD4+细胞的具体亚群,另外由于本实验中样本数较少且免疫组化及半定量的方法检验效能有限,可能未显示出两组潜在的差别。
为了衡量HIFU瘤苗的效能本研究以热凝固方法制备高温瘤苗作对照,理论上二者同属全肿瘤细胞疫苗,包含了相同的肿瘤抗原,且在本实验参数条件下HIFU辐照对细胞也产生65℃左右的热效应,但实验结果显示HIFU瘤苗效能优于高温瘤苗,其机制并不清楚,这可能与HIFU辐照对细胞产生的特殊的生物学效应有关,HIFU辐照除产生热效应外,还对细胞形成特有的机械效应及空化效应。近来研究认为细胞死亡时的某些物质释放能激活免疫,这是一些被称作“危险信号”或“损伤相关分子形式”的物质,如:热休克蛋白(heat shock protein,HSP)、核苷酸、钙网蛋白等[11-13]。研究显示 HIFU 的机械和空化效应比HIFU的热效应更有利于辐照细胞“危险信号”的释放[14],而HIFU的辐照也促使细胞释放“损伤相关分子形式”之一的HSP[15],这可能是HIFU辐照瘤苗比单纯热凝固细胞瘤苗免疫效能更高的原因之一。
综上所述,HIFU制备瘤苗的免疫能明显抑制同源移植肿瘤在动物体内的生长,延长实验动物的生存期。肿瘤刺激下HIFU瘤苗免疫动物的脾淋巴细胞IFN-γ生成增高,提示机体细胞免疫被激活。肿瘤生长受抑制可能与增多的淋巴细胞浸润有关。
[1]周颦,付敏,王智彪,等.高强度聚焦超声固化瘤苗的实验研究[J].中国超声医学杂志,2002,18(8):569-571.
[2]Naito Y,Saito K,Shiiba K,et al.CD8+ T cells infiltrated within cancer cell nests as a prognostic factor in human colorectal cancer[J].Cancer Res,1998,58(16):3491-3494.
[3]Cho Y,Miyamoto M,Kato K,et al.CD4+CD8+ T cell Cooperate to improve prognosis of patients with esophageal carcinoma[J].Cancer Res,2003,63(7):1555-1559.
[4]Euhus DM,Hudd C,La Regina MC,et al.Tumor measurement in the nude mouse[J].J Surg Oncol,1986,31(4):229-234.
[5]Kochenderfer JN,Gress RE.A comparison and critical analysis of preclinical anticancer vaccination strategies[J].Exp Biol Med,2007,232(9):1130-1141.
[6]Copier J,Dalgleish A.Overview of tumor cell-based vaccines[J].Int Rev Immunol,2006,25(5/6):297-319.
[7]Yu P,Fu YX.Tumor infiltrating lymphocytes:friends or foes[J].Lab Invest,2006,86(3):231-245.
[8]Nedergaard BS,Ladekarl M,Thomsen HF,et al.Low density of CD3+,CD4+ and CD8+ cells is associated with increased risk of relapse in squamous cell cervical cancer[J].Br J Cancer,2007,97(8):1135-1138.
[9]Shunyakov L,Ryan CK,Sahasrabudhe DM,et al.The influence of host response on colorectal cancer prognosis[J].Clin Colorectal Cancer,2004,4(1):38-45.
[10]Du C,Wang Y.The immunoregulatory mechanisms of carcinoma for its survival and development[J].J Exp Clin Cancer Res,2011,30(1):12-21.
[11]Matzinger P.The danger model:a renewed sense of self[J].Science,2002,296(5566):301-305.
[12]Green DR,Ferguson T,Zitvogel L,et al.Immunogenic and tolerogenic cell death[J].Nat Rev Immunol,2009,9(5):353-363.
[13]Tesniere A,Panaretakis T,Kepp O,et al.Molecular characteristics of immunogenic cancer cell death[J].Cell Death Differ,2008,15(1):3-12.
[14]Hu Z,Yang XY,Liu Y,et al.Release of endogenous danger signals from HIFU-treated tumor cells and their stimulatory effects on APCs[J].Biochem Biophys Res Commun,2005,335(1):124-131.
[15]Hundt W,O′Connell-Rodwell CE,Bednarski MD,et al.In vitro effect of focused ultrasound or thermal stress on HSP70expression and cell viability in three tumor cell lines[J].Acad Radiol,2007,14(7):859-870.
