羊口疮病毒TaqMan实时荧光定量PCR检测方法的建立及应用
2012-06-29李富祥彭海生鲁富有张乔明李华春
姚 俊,李富祥,彭海生,鲁富有,张乔明,李华春*
(1.云南省畜牧兽医科学院,云南省热带亚热带动物病毒病重点实验室,云南 昆明 650224;2.云南省普洱市动物疫病预防控制中心,云南 普洱 665000)
羊口疮(Orf)也叫羊接触传染性脓疱性皮炎(Sheep contagious pustular dermatitis),是由羊口疮病毒(Orf virus)引起的绵羊和山羊的一种接触传染性、嗜上皮性传染病[1]。本病特征是在口唇、眼、乳房、鼻孔周围的皮肤上出现丘疹和水疱,并迅速变为脓疱,最后形成痂皮或疣状病变——桑椹状痂垢[1]。羊口疮的发病率为30%~50%,死亡率差异较大,在饲养卫生条件不良的羊群中,羔羊的死亡率可高达20%[1]。人在接触病羊时,常可发生感染。病变大多发生于手、腕或脸。先是丘疹,随后变为水疱或脓疱,周围皮肤红肿,局部疼痛,淋巴结肿大,最后结痂自愈[1]。2005年8月福建省永安市有8名羊场养殖工人因感染羊传染性脓疱病毒而发病[2]。因此,羊传染性脓疱不但严重危害肉羊产业的健康发展,而且威胁人类的身体健康,是一种危害较为严重的人畜共患传染病[3]。
本病最早于1920年发现于欧洲,现已广泛分布于世界各地,我国新疆、甘肃、青海、内蒙以及东北三省的主要养羊地区均有本病发生的报道[1,4]。2010年底至2011年初云南省普洱市放牧山羊暴发、流行羊口疮。2011年12月保山市放牧山羊也出现羊口疮的发生与流行。
由于本病发病羊只在口唇、眼、鼻、乳房、肛门、外阴等部位出现与山羊痘相似的丘疹结节,在临床上没有经验的兽医人员仅凭临床观察很难对本病做出确诊,因此,有必要建立一种灵敏、特异、快速、安全、可靠的病原检测方法。目前国内建立了羊口疮病原的PCR检测方法[5],羊痘病毒和羊口疮病毒二重 PCR鉴别检测方法[6-7],羊传染性脓疱病毒SYBR GreenⅠ实时荧光定量PCR检测方法[8]。传统PCR检测方法耗时、费力、容易污染、容易出现假阳性,电泳过程中所使用的核酸染料溴化乙锭(EB),对环境及检测人员具有较大危害性。国内报道的羊传染性脓疱病毒SYBR GreenⅠ实时荧光定量PCR检测方法灵敏度太低,仅能检测到为9.4×104copies/μL,特异性试验仅仅检测了绵羊痘病毒(SPV),扩增采用3步法,检测时间较长,耗时2h[8]。国外有为数不多的羊口疮病毒SYBR GreenⅠ和TaqMan real-time PCR的建立及应用报道[9-11]。国内至今未见羊口疮病毒TaqMan实时荧光定量PCR检测方法建立及应用的报道。研究建立的羊口疮病毒TaqMan实时荧光定量PCR检测灵敏度达1×101copies/μL,上机检测时间不超过40min,羊痘及禽痘病毒检测均为阴性,组内及组间重复试验变异系数均低于2%,更适合于羊口疮临床样品的早期检测。
1 材料与方法
1.1 材料
1.1.1 样品及毒株 2份送检的可疑羊口疮口唇组织病料,1份采集自云南普洱市,1份采集自云南保山市;羊口疮病毒牛睾丸细胞适应毒株,作为阳性对照使用,山羊痘病毒XW毒株牛睾丸细胞适应毒、禽痘病毒疫苗毒株,均为云南省热带亚热带动物病毒病重点实验室保存。
1.1.2 引物及探针 根据GenBank公布的羊口疮病毒基因组(AY386264)中ORFVgORF121和ORFVgORF122基因DNA序列,应用Beacon Designer 7.7软件,设计出一对TaqMan实时荧光定量PCR引物和一条探针:
Taq-ORFVgORF121-122-F:5′-TCTATCGTC GCTACATAC-3′;
Taq-ORFVgORF121-122-R:5′-GCTTCTTAT TTCACATTACAG-3′;
ORF121-122-probe:FAM-5′-CTAAGACACT ACTCGCCACGC-3′-BHQ1。
探针5′端的报告荧光为FAM,3′端的淬灭基团为BHQ1,扩增片段位于基因组DNA序列第121834bp~122032bp处,扩增片段长度为199 bp,最适合退火温度为(Ta opt)59.9℃。
1.1.3 主要试剂及仪器 小量病毒柱式DNA抽提试剂盒为上海生工生物工程技术服务有限公司产品;普通琼脂糖凝胶DNA回收试剂盒(TIANgel Midi Purification Kit)及2×Taq PCR Master Mix为天根生化科技(北京)有限公司产品;2×Premix Ex TaqTM(Probe qPCR)、50× ROX Dye Ⅱ、PMD18TSimple连接试剂盒及DH5α受体菌为宝生物工程(大连)有限公司产品。紫外分光光度计(Nanovue plus)为美国 GE公司生产;PCR仪为ABI(applied biosystems Inc.)公司生产的Gene Amp PCR System 9700;定量PCR仪为ABI(applied biosystems Inc.)公司生产的7500Fast PCR System。
1.2 方法
1.2.1 DNA抽提 将送检组织病料匀浆后3500 r/min离心5min,取上清液按小量病毒柱式DNA抽提试剂盒说明书抽提病毒DNA,将羊口疮病毒牛睾丸细胞培养物及禽痘病毒弱毒活疫苗按同样方法抽提病毒DNA。
1.2.2 pMD18T克隆质粒的构建及质粒标准品的制备 以提取的羊口疮病毒(ORFV)牛睾丸细胞适应毒株DNA为模板,以本文设计的TaqMan实时荧光定量PCR引物作为扩增引物,进行PCR扩增。采用50μL反应体系,95℃10min;95℃20s,55℃30s,72℃35s,35个循环;最后72℃5min。对PCR产物进行切胶回收,16℃30min连接PMD18T质粒,连接产物转化DH5α感受态细胞,转化细菌经37℃振荡培养复苏后,涂抹于含有Amp的LB平板,进行阳性克隆筛选。随机挑取5个白色菌落进行PCR扩增鉴定,鉴定出的阳性克隆经增菌培养后,抽提重组质粒送宝生物工程(大连)有限公司测序,测序结果与GenBank序列比对无误后,应用紫外分光光度计测定出重组质粒的浓度(ng/μL),根据重组质粒的分子质量与质量浓度,计算其拷贝数浓度,在-80℃ 保存备用。计算公式为:拷贝浓度(copies/μL)= (6.02×1023)×(重组质粒浓度ng/μL×10-9)/(660×碱基数)。
1.2.3 TaqMan real-time PCR 的建立、最佳引物、探针浓度筛选 根据所采用Premix Ex TaqTM(Probe qPCR)预混液中酶的特性,以及扩增目的DNA片断的最佳退火温度,确定反应条件为95℃30s,95℃5s、60℃30s,根据试验目的可进行35个~60个循环。
最佳引物浓度筛选:20μL反应体系:2×Premix Ex TaqTM (Probe qPCR)10μL,50×ROX DyeⅡ0.4μL,1×107copies/μL重组质粒1μL作为模板,10μmol/L的探针0.8μL(终浓度为400 nmol/L),选择10μmol/L 上下游引物各1.2、1、0.8、0.6、0.4、0.2、0.1μL(对应的终浓度分别为600、500、400、300、200、100、50nmol/L),添加 PCR级无离子水补足20μL后进行qPCR扩增,95℃30s,95℃5s、60℃30s扩增45次循环。
1.2.3.1 最佳探针浓度筛选 20μL反应体系:2× Premix Ex TaqTM(Probe qPCR)10μL,50×ROX DyeⅡ0.4μL,1×107copies/μL重组质粒1μL作为模板,10μmol/L上下游引物各0.4μL,选择10μmol/L探针各1.2、1、0.8、0.6、0.4、0.2、0.1 μL(对应的终浓度分别为600、500、400、300、200、100、50nmol/L),添加PCR级无离子水补足20μL后进行qPCR扩增,95℃30s,95℃5s、60℃30 s,扩增45次循环。
1.2.3.2 TaqMan real-time PCR 的 建 立 20μL反应体系:2× Premix Ex TaqTM(Probe qPCR)10 μL,50×ROX DyeⅡ0.4μL,保山及普洱临床组织样品抽提DNA各1μL为模板,10μmol/L上下游引物各0.4μL(终浓度200nmol/L),10μmol/L探针0.6μL(终浓度300nmol/L),添加PCR级无离子水补足20μL后,95℃30s,95℃5s、60℃30s扩增45次循环,同时设立阴阳性对照。
1.2.4 TaqMan real-time PCR的重复性检测 选择同一模板不同稀释度进行4个重复和4个不同模板样品进行4个重复,检验本试验建立的羊口疮TaqMan real-time PCR的组内重复及组间重复的稳定性。方法参照1.2.3。
1.2.5 TaqMan real-time PCR 特 异性试 验 以1.2.1中抽提的山羊痘牛睾丸细胞适应毒XW毒株、禽痘病毒疫苗毒株DNA作为特异性检测模板。以羊口疮病毒(ORFV)标准毒株抽提DNA作阳性对照,PCR级超纯水作为阴性对照,进行TaqMan real-time PCR特异性试验。方法参照1.2.3。
1.2.6 TaqMan real-time PCR灵敏度试验 选择1×104copies/μL至1×100copies/μL PMD18T重组质粒作为模板进行qPCR扩增,以测定所建立的TaqMan real-time PCR方法的最低检测极限模板量。方法参照1.2.3。
1.2.7 羊口疮临床组织病料定量检测 将重组质粒10倍梯度系列稀释,选取1×108copies/μL至1×105copies/μL共4个稀释度的质粒作为标准品,建立以质粒拷贝数为单位的绝对定量标准曲线来对云南保山、普洱送检羊口疮(Orf)临床组织病料进行定量检测,同时设立阴阳性对照。
2 结果
2.1 PCR扩增结果
PCR扩增出长度约199bp的目的片段,见图1。
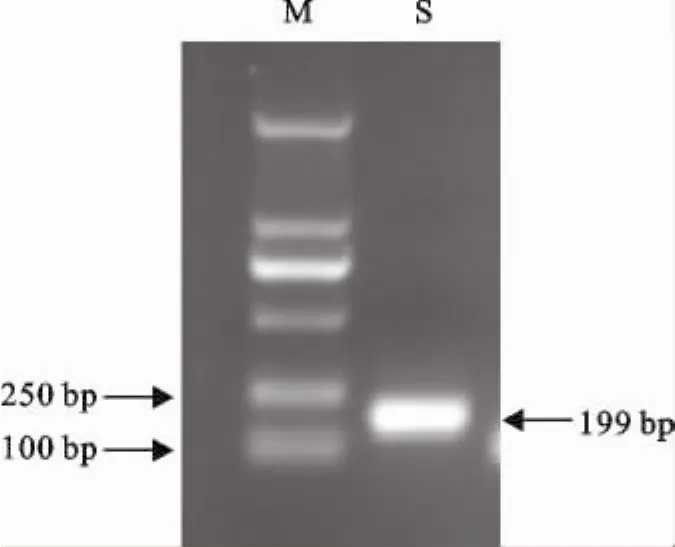
图1 目的DNA片段的PCR扩增结果Fig.1 PCR results of target DNA fragment
2.2 阳性克隆PCR鉴定结果
据图2显示,随机挑选的1~5号菌落均扩增出预期长度的DNA片段,3号菌落扩增出单一、明亮的DNA片段,而1、2、4、5号菌落扩增出的目的片段较模糊。挑取3号菌落接种于含有Amp的LB培养液震荡培养过夜,抽提质粒测序,测序结果显示插入片段DNA序列与目的片段序列完全吻合。

图2 阳性克隆PCR鉴定结果Fig.2 Identification of positive colonies by PCR
2.3 最佳引物、探针浓度筛选结果
200nmol/L~500nmol/L引物浓度范围扩增出的S型曲线线形均匀、一致,浓度较低的且峰线靠右侧的200nmol/L可作为最佳引物浓度(图3)。
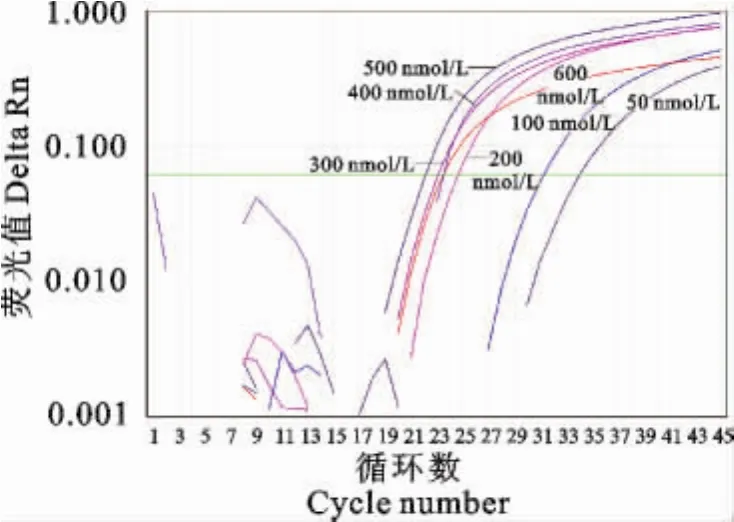
图3 最佳引物浓度筛选扩增图Fig.3 The amplification plot of screening for the optimal primer concentration
200、300、500、600nmol/L 的探针浓度扩增出的S型曲线线形均匀一致,200nmol/L~300 nmol/L的浓度范围可作为最佳探针浓度(图4)。
2.4 TaqMan real-time PCR检测方法扩增图
保山、普洱送检样品及阳性对照均扩增出S形曲线,阴性对照未扩增出S形曲线(图5)。当域值为0.02时,BS、PE和阳性对照的 Ct值分别为20.4336、23.6446、27.5835。

图4 最佳探针浓度筛选扩增图Fig.4 The amplification plot of screening for the optimal probe concentration
2.5 稳定性试验结果
组内重复试验和组间重复试验变异系数均低于2%,说明试验稳定,重复性好,结果见表1、表2。
2.6 特异性试验结果
除了羊口疮病毒DNA模板扩增出S形曲线外,羊痘及禽痘病毒DNA模板均未能扩增出S形曲线(图6)。
2.7 灵敏度检测结果
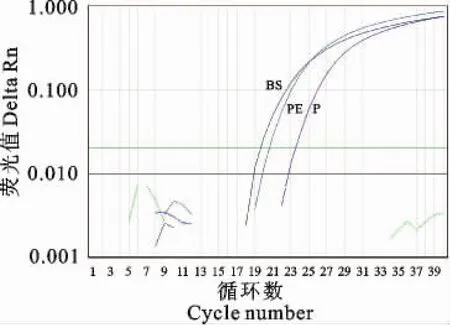
图5 羊口疮临床组织样品TaqMan real-time PCR扩增图Fig.5 The amplification plot of the clinical samples of orf and positive control by TaqMan real-time PCR
1×104copies/μL至1×101copies/μL稀释度的重组质粒均扩增出了S形曲线,而1×100copies/μL稀释度的重组质粒和阴性对照未扩增出任何峰线,结果显示所建立方法的检测最低极限为1×101个病毒拷贝(图7),图中S型曲线由左到右分别由1×104~1×101拷贝重组质粒作为模板扩增而得。
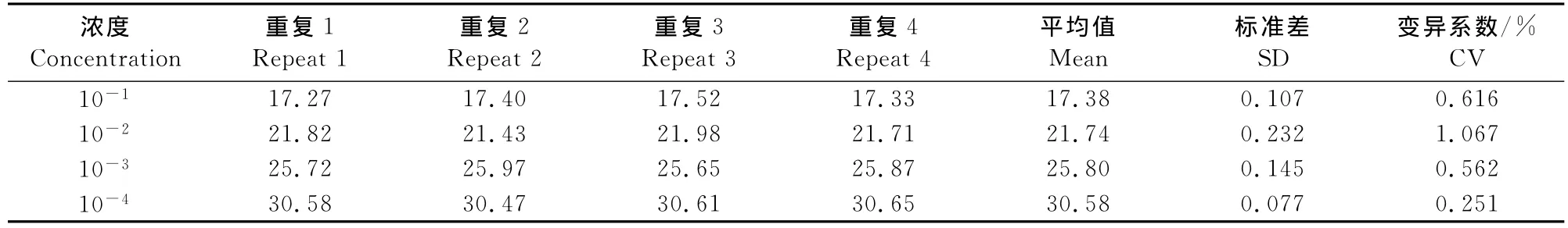
表1 同一样品不同浓度的组内重复试验结果(Ct值)Table1 The experimental data of four replicates of the same sample at different concentrations
表2 不同样品的组间重复试验结果(Ct值)Table2 The inter-assay experimental data of four replicates of different samples

图6 TaqMan real-time PCR特异性试验结果Fig.6 The amplification figure for specific test of TaqMan real-time PCR
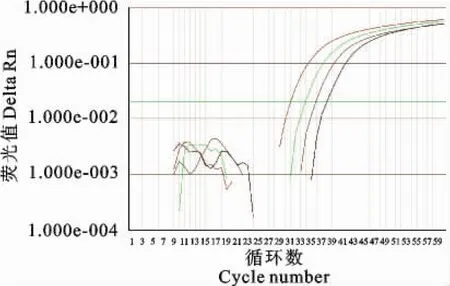
图7 灵敏度试验扩增图Fig.7 The amplification plot of Taq Man real-time PCR for the sensitivity
2.8 云南保山、普洱送检羊口疮临床组织样品定量检测结果
1×108copies/μL至1×105copies/μL共4个稀释度的重组质粒及阳性对照均扩增出S形曲线,保山市及普洱市送检的羊口疮(Orf)临床组织样品均扩增出S型曲线(图8)。其抽提的DNA洗脱液
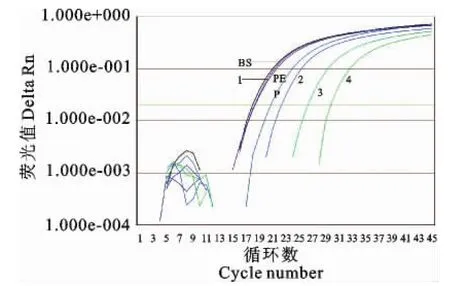
图8 羊口疮临床组织样品TaqMan法实时荧光定量PCR扩增图Fig.8 The amplification figure of the clinical samples of orf by TaqMan real-time fluorescence quantitative PCR
3 讨论
作为诊断及疫病防控目的,实时荧光定量PCR通常被运用来对临床样品进行病毒定量检测。截止到目前,国内未见有羊口疮病毒TaqMan real-time PCR检测方法的建立与运用报道。本文就针对羊口疮病毒建立了一种灵敏、特异、稳定、安全、快速的TaqMan实时荧光定量PCR检测方法,并运用于临床组织样品的定量检测。文中real-time PCR采用的TaqMan探针是特异性结合于靶序列,在进行延伸反应时,聚合酶的5′外切酶活性将探针切断,使得荧光基团与淬灭基团分离进而发出荧光,而荧光染料SYBR Green I是非特异性嵌合于PCR产物的DNA双链时发出荧光,因而容易造成假阳性及导致荧光信号本底高。TaqMan探针法实时荧光定量PCR与传统PCR比较而言,扩增及检测均在同一PCR管内完成,不需开盖取样检测,不仅更灵敏、更特异,还省去了PCR产物的电泳检测过程,最重要的是避免了具有致癌性的物质溴化乙锭(EB)的使用。所建立的方法检测灵敏度达10copies/μL,因此,本方法更易检测出潜伏期或早期羊口疮临床样品中的病毒。中病毒拷贝数分别为1.35×108copies/μL和9.62×107copies/μL,阳性对照毒株抽提的DNA洗脱液中病毒拷贝数为2.33×107copies/μL。所建立的标准曲线斜率(Slope)为-3.809654,截距(Intercept)为50.380341,相关系数(R2)为0.998088(图9)。
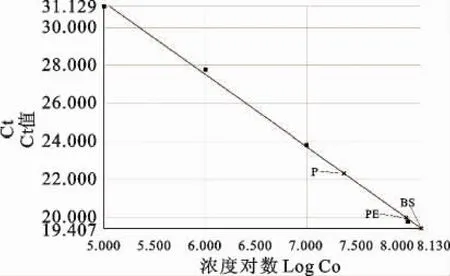
图9 绝对定量标准曲线Fig.9 Standard curve
本文在建立标准曲线时,曾测定羊口疮组织病料或羊口疮病毒牛睾丸细胞培养物抽提的病毒DNA浓度,然后根据分子质量与质量浓度,计算出每微升DNA洗脱液中所含病毒拷贝数,并以此病毒拷贝数来建立绝对定量标准曲线,但在灵敏度试验中,检出的最低极限值仅为105个病毒拷贝数,检出率明显偏低。原因可能是组织或细胞样品抽提出的是总DNA,其中含有很大一部分细胞或组织的基因组DNA,因而导致了OD260nm测定值偏高,最终换算出来的单位体积内抽提DNA样品中所含病毒拷贝数要比真实的拷贝数多很多,才导致了极限检出率偏低的误差,因此本方法不可取。在以重组质粒为单位建立的标准曲线在最低检测极限的试验中,最低检测极限可达10个病毒拷贝数,可能是因为抽提出的重组质粒DNA纯度高,且片段比山羊痘病毒基因组DNA片段要小很多,因此与引物碰撞的几率也要大很多,而事实上能否从送检样品抽提的DNA中检测到10个真实的病毒还有待于进一步试验证实。国内外有以抽提病毒DNA浓度换算病毒拷贝数为定量单位来进行绝对定量研究的报道,也有以重组质粒和病毒TCID50为单位的绝对定量研究报道。国外有建立羊口疮病毒TaqMan re-al-time PCR文献报道称,为了尽可能模拟真实病毒基因组线性DNA,扩增、克隆一段比检测目的DNA片段更长的DNA片段,酶切重组质粒,使其成为线性DNA,然后测定浓度,并以此已知拷贝数的线性DNA作为标准品建立标准曲线来定量检测送检样品[9]。综合分析评估看来,建立以病毒TCID50为单位的标准曲线来对病毒样品进行绝对定量检测要更准确、更有参考价值一些,其次以酶切的重组质粒作为标准品进行定量检测,也可以作为一种病毒定量分析方法的参考。
本文在对所建立的羊口疮病毒TaqMan探针法荧光定量PCR的特异性试验中,未能收集到痘病毒科各属代表病毒株,仅仅检测了羊痘病毒属的山羊痘病毒和禽痘病毒属的鸡痘病毒,有待收集更多其他痘病毒属的毒株进行特异性试验。在本文所建立方法的运用检测中,临床样品数量偏少,有待收集更多的地方流行毒株进行检测,以便进一步验证该方法的可靠性。
[1]殷 震,刘景华.动物病毒学 [M].北京:科学出版社,1997:977-980.
[2]张家确,吴景央.一起人畜共患羊传染性脓疱病的调查[J].中国兽医杂志,2006,9(42):53-54.
[3]张克山,何继军,尚佑军,等.羊传染性脓疱病毒湖北株的鉴定及分子特征分析[J].畜牧兽医学报,2010,41(9):1154-1157.
[4]Zhang K S,Lu Z X,Shang Y J,et al.Diagnosis and phylogenetic analysis of Orf virus from goats in China:a case report[J].J Virol,2010,7:78.
[5]向智龙,程振涛,卓建华,等.羊口疮病毒PCR检测方法的建立与应用[J].贵州农业科学,2010,38(7):145-147.
[6]郑 敏,金宁一,刘 棋,等.羊痘病毒和羊口疮病毒二重PCR鉴别检测方法的建立[J].中国兽医科学,2007,37(11):931-934.
[7]颜新敏,张 强,吴国华,等.双重PCR快速鉴别羊痘病毒和羊口疮病毒[J].中国人兽共患病学报,2008,24(10):945-948.
[8]李 超,赵 魁,赵 权,等.羊传染性脓疱病毒SYBR Green I实时荧光定量PCR检测方法的建立[J].中国兽医科学,2010,40(3):270-273.
[9]Gallina L.A real time PCR assay for the detection and quantification of orf virus[J].J Virol Meth,2006,134:140–145.
[10]Bora D P.TaqMan real-time PCR assay based on DNA polymerase gene for rapid detection of Orf infection[J].J Virol Meth,2011,178(1-2):249-252.
[11]Nitsche A.Real-time PCR detection of parapoxvirus DNA[J].Clin Chem,2006 ,52(2):316-319.
