辅酶Q10联合曲美他嗪治疗对缺血性心力衰竭患者心率变异性的影响
2012-06-29周海生
周海生
慢性心力衰竭是影响人民健康的常见病和多发病,大量基础和临床研究均证实交感神经系统激活和心脏自主神经功能受损是心力衰竭启动和转恶的重要机制[1]。自1987年Kleiger等[2]报道急性心肌梗死患者心率变异性(heart rate variability,HRV)降低与严重心脏事件密切相关后,HRV在评价自主神经功能方面和心血管疾病方面中的价值受到越来越多的重视[3-5]。研究证实,HRV分析对于心衰预后的评估及指导心衰的治疗具有重要作用。辅酶Q10是一种脂溶性抗氧化剂,于1957年在美国被发现,同年英国爱丁堡大学彼得·麦克博士因在研究辅酶Q10与细胞能源关系方面的贡献获得诺贝尔奖[6]。研究证实,辅酶Q10对于心脏具有保护作用,并可增加心脏HRV[7,8]。曲美他嗪是抗心肌缺血的派嗪类药物,其通过抑制耗氧较多游离脂肪酸氧化,促进葡萄糖氧化,利用有限的氧产生更多ATP从而增加心肌收缩功能:同时该药物还可以减少游离脂肪酸代谢产生的乙酰辅酶A,刺激丙酮酸脱氢酶,间接促进葡萄糖氧化[9,10]。先前研究证实[11,12]曲美他嗪可以调节梗死后心肌HRV的自我控制,减少交感神经过度活化,增加自主神经的作用。本研究的目的就是评价联合辅酶Q10和曲美他嗪对于缺血性心力衰竭患者HBV和心功能的影响。
1 资料与方法
1.1 研究对象 28例缺血性心肌病心力衰竭患者,已常规使用利尿剂、血管紧张素转换酶抑制剂/血管紧张素受体抑制剂、β受体组滞剂、醛固酮拮抗剂及洋地黄制剂,心功能为NYHAⅡ级~Ⅲ级。排除标准:心功能为NYHAⅣ级;3个月内发生急性心肌梗死;左室射血分数(LVEF)>40%;严重瓣膜疾病;酒精性心肌病;植入起搏器;肾功能不全(血清肌酐>2.0 mg/dL);慢性肺疾病或全身系统性疾患;使用抗心律失常药。28例中男25例,女3例;年龄38岁~70岁(59.3岁±11.7岁);糖尿病3例,高血压15例。
1.2 治疗方法 在常规基础上加用辅酶Q10和曲美他嗪各20 mg,3次/日,连用3个月。
1.3 观察指标 分别于入院后即刻、治疗3个月后作超声心动图和Holter检查。超声心动图按照常规方法检测LVEF。Holter由分析系统中的计算机处理,进行HRV时域分析。SDNN(总体标准差):正常R-R间期标准差;SDANN(均值标准差):连续5 min正常R-R间期均值的标准差;SDNNI(标准差均值):连续5 min正常R-R间期标准差均值;r MSSD(差值的均方根):相邻正常R-R间期差值均方根;RNN50:相邻正常R-R间期差值超过50 ms的百分比。
2 结 果
平均收缩压为(121.5±16.5)mm Hg,平均舒张压为(75.8±11.2)mm Hg。治疗前后患者的血压情况无显著变化。患者基础LVEF为(32.5±5.1)%,使用辅酶 Q10和曲美他嗪3个月后,LVEF升高为(37.6±5.3)%(P<0.05)。心率变异性分析表明,SDNN和SDANN较用药前明显增加(P<0.05)。详见表1。
表1 治疗前后24 h心率变异性指数变化(±s)
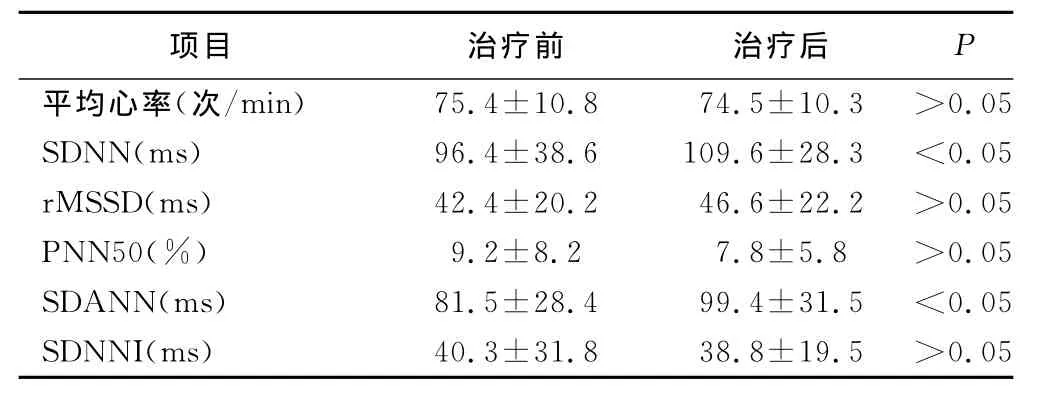
表1 治疗前后24 h心率变异性指数变化(±s)
项目 治疗前 治疗后P 0.05 SDNN(ms) 96.4±38.6 109.6±28.3 <0.05 r MSSD(ms) 42.4±20.2 46.6±22.2 >0.05 PNN50(%) 9.2±8.2 7.8±5.8 >0.05 SDANN(ms) 81.5±28.4 99.4±31.5 <0.05 SDNNI(ms) 40.3±31.8 38.8±19.5 >0.05平均心率(次/min) 75.4±10.8 74.5±10.3 >
3 讨 论
心力衰竭是临床常见疾患,特别是老年人入院的多发原因。研究表明,神经内分泌(包括交感神经系统、肾素-血管紧张素系统等)的过度激活是加速心力衰竭恶化的重要机制。其中交感神经系统过度驱动是心力衰竭患者疾病严重程度的标志,也是心衰随时间加重的主要原因。交感神经的激活始终存在于慢性心力衰竭的过程中,与心肌损害的严重程度,患者的预后直接相关,在心衰的发生发展过程中起着重要的作用[1,2]。
HRV是新近发展的一种反应心血管自主神经活性及其平衡的非侵入性、可重复操作、能定量的检测方法。Nakagawa等[13]对2例陈旧性心肌梗死心衰患者猝死前2年所测得的3次HRV进行观察,发现其LVEF及心功能均进行性降低,提示HRV降低,是心衰预后不良的危险指标。Ponikowski等[14]随访了102例心衰患者平均(584±405)d,其中18例死亡,死亡组HRV明显低于存活组。研究发现[15,16],SDNN 和SDANN是失代偿心力衰竭患者出院后存活的重要预测指标。与传统临床检测相比,SDNN减低能更好地预测心衰患者的死亡危险[17]。本研究发现辅酶Q10能显著增加SDNN和SDANN,提示辅酶Q10也许能降低心衰患者死亡危险。
因心肌缺血因素持续存在,导致心肌供血、供氧下降,三磷酸腺苷(ATP)产生减少,心肌能量供血不足,导致心肌收缩功能下降。近年来对缺血性心肌病心力衰竭的研究表明,除了血流动力学紊乱、神经内分泌激活外,能量耗竭也是临床迫切需要解决的问题。辅酶Q10是一种存在于自然界的脂溶性醌类化合物,其结构与维生素K、维生素E与质体醌相似。在人类身体细胞内参与能量制造及活化,是预防动脉硬化形成最有效的抗氧化成分[8]。辅酶Q10在体内主要有两个作用:一是在营养物质在线粒体内转化为能量的过程中起重要的作用:二是有明显的抗脂质过氧化作用。它是细胞线粒体中的能量转换剂,它通过转移和传递电子参与“三羧酸循化”ATP,即能量因子供细胞代谢使用[6]。而曲美他嗪可选择性地抑制了线粒体酶-长链3-酮酰辅酶A硫解酶(KAT),部分抑制脂肪酸β氧化,增进葡萄糖氧化,以提高心肌细胞能量的产生,增加心肌细胞氧的利用与氧效价,改善心肌功能[10,18]。本研究结果表明,使用辅酶Q10和曲美他嗪3个月后,患者心功能明显改善,左心室收缩功能增加,表明辅酶Q10和曲美他嗪联合使用有利于增加缺血性心肌病心力衰竭患者的心脏收缩力,提高心排血量,改善症状。
综上所述,在常规抗心力衰竭治疗的基础上加用辅酶Q10和曲美他嗪能有效地增加HBV,改善心力衰竭的心肌舒缩功能,从而进一步提高心力衰竭的疗效,提高心力衰竭患者的生活质量。
[1] Kishi T.Heart failure as an autonomic nervous system[J].J Cardiol,2012,59(2):117-122.
[2] Kleiger RE,Miller JP,Bigger JT,et al.Decreased heart rate variability and its association with increased mortality after acute myocardial infarction[J].Am J Cardiol,1987,59(4):256-262.
[3] Sookan T,Mc Kune AJ.Heart rate variability in physically active individuals:Reliability and gender characteristics[J].Cardiovasc J Afr,2012,23(2):67-72.
[4] Huikuri HV,Stein PK.Clinical application of heart rate variability after acute myocardial infarction[J].Front Physiol,2012,3:41.
[5] Buccelletti E,Gilardi E,Scaini E,et al.Heart rate variability and myocardial infarction:Systematic literature review and metanalysis[J].Eur Rev Med Pharmacol Sci,2009,13(4):299-307.
[6] Emmanuele V,Lopez LC,Berardo A,et al.Heterogeneity of coenzyme Q10 deficiency:Patient study and literature review[J].Arch Neurol,2012,69(8):978-983.
[7] Singh RB,Weydahl A,Otsuka K,et al.Can nutrition influence circadian rhythm and heart rate variability[J].Biomed Pharmacother,2001,55(Suppl 1):115s-124s.
[8] Singh U,Devaraj S,Jialal I.Coenzyme Q10 supplementation and heart failure[J].Nutr Rev,2007,65(6 Pt 1):286-293.
[9] Gunes Y,Guntekin U,Tuncer M,et al.Improved left and right ventricular functions with trimetazidine in patients with heart failure:A tissue Doppler study[J].Heart Vessels,2009,24(4):277-282.
[10] Zhang L,Lu Y,Jiang H,et al.Additional use of trimetazidine in patients with chronic heart failure:A meta-analysis[J].J Am Coll Cardiol,2012,59(10):913-922.
[11] Topal E,Ozdemir R,Barutcu I,et al.The effects of trimetazidine on heart rate variability in patients with slow coronary artery flow[J].J Electrocardiol,2006,39(2):211-218.
[12] Birand A,Kudaiberdieva GZ,Batyraliev TA,et al.Effects of trimetazidine on heart rate variability and left ventricular systolic performance in patients with coronary artery disease after percutaneous transluminal angioplasty[J].Angiology,1997,48(5):413-422.
[13] Nakagawa M,Saikawa T,Ito M.Progressive reduction of heart rate variability with eventual sudden death in two patients[J].Br Heart J,1994,71(1):87-88.
[14] Ponikowski P,Piepoli M,Amadi AA,et al.Reproducibility of heart rate variability measures in patients with chronic heart failure[J].Clin Sci(Lond),1996,91(4):391-398.
[15] Nolan J,Batin PD,Andrews R,et al.Prospective study of heart rate variability and mortality in chronic heart failure:Results of the United Kingdom heart failure evaluation and assessment of risk trial(UK-heart)[J].Circulation,1998,98(15):1510-1516.
[16] Yi G,Goldman JH,Keeling PJ,et al.Heart rate variability in idiopathic dilated cardiomyopathy:Relation to disease severity and prognosis[J].Heart,1997,77(2):108-114.
[17] Aronson D,Mittleman MA,Burger AJ.Measures of heart period variability as predictors of mortality in hospitalized patients with decompensated congestive heart failure[J].Am J Cardiol,2004,93(1):59-63.
[18] Gao D,Ning N,Niu X,et al.Trimetazidine:A meta-analysis of randomised controlled trials in heart failure[J].Heart,2011,97(4):278-286.
