逆转录病毒介导系统感染原代培养人皮肤成纤维细胞
2012-06-28张清华蒋知新
张清华 艾 民 蒋知新 沙 杭 高 毅 卢 海
(中国人民解放军三零五医院,北京 100017)
胚胎干细胞(ESCs)是具有无限增殖,自我更新和多向分化潜能的一种未分化细胞,在体外可被诱导分化为神经细胞〔1〕、平滑肌细胞、心肌细胞〔2〕、造血细胞〔3〕而用于多种疾病的治疗,具有广阔的研究和临床应用前景。目前,ESCs研究也存在着一些问题,如免疫排斥反应和伦理学问题的争论。诱导多潜能干细胞技术是将多能性基因转染到已分化的体细胞,将其重编程为类似于ESCs的多潜能干细胞,并被命名为“诱导多潜能干细胞”(iPSCs),简称“iPS细胞”〔4〕。iPS细胞回避了 ESCs免疫排斥反应和伦理学的争论问题,近年来成为干细胞领域的研究热点。本实验拟采用包装生产携带绿色荧光蛋白(GFP)基因的逆转录病毒感染原代培养人皮肤成纤维细胞(HSF),判断逆转录病毒对HSF细胞的感染情况,为下一步HSF细胞重编程实验提供技术保证。
1 材料与方法
1.1 材料与主要试剂 皮肤标本来源于南方医科大学第二临床学院,经患者及其家属同意签字后方可取标本。高糖型DMEM、10%FBS、PBS、明胶、pMX-GFP、pCL 包装质粒、polybrene、磷酸钙转染用试剂盒。
1.2 原代培养HSF细胞〔5〕手术取患者上臂内侧至真皮层2 cm×2 cm皮肤组织标本,用PBS将组织标本清洗3遍后剪碎至1 mm×2 mm左右,将其平铺到包被明胶的培养皿中,添加HSF细胞培养基(高糖型DMEM+10%FBS),置于37℃ 5%CO2培养箱培养,每天更换HSF细胞培养基。
1.3 包装生产逆转录病毒 采用磷酸钙转染法将GFP基因转染到293T细胞内,具体步骤如下:先加水,再加pMX-GFP和pCL包装质粒混匀。向混合液中加入2 mol/L CaCl2颠倒混匀。再向混合液中加入2×HBS反复吸吹混匀。在室温下静置2 min,加入等体积的293T细胞培养基(高糖型DMEM+10%FBS),将钙转液逐滴均匀滴加到293T细胞中,置于37℃,5%CO2培养箱培养,12~16 h后更换培养液,36~48 h收集病毒上清液。
1.4 收集病毒感染HSF细胞 应用巴氏吸管收集病毒上清液,经0.45μm滤过膜过滤到15 ml离心试管中,加入终浓度为8 ng/ml polybrene混匀,感染前更换新的HSF细胞培养基,将收集过滤的病毒上清液感染HSF细胞。
1.5 HSF细胞观察 显微镜下观察原代培养HSF细胞的生长过程和包装生产逆转录病毒感染HSF细胞情况,并拍照。
2 结果
2.1 原代培养HSF细胞 人皮肤组织块接种1 w左右,可见少量的HSF细胞从组织块周围爬出,呈长梭形、不规则形。2 w左右组织块周围HSF细胞数量逐渐增多,部分细胞生长密度超过90%,呈放射状、栅栏状或漩涡状排列。见图1。
2.2 包装生产逆转录病毒 利用磷酸钙法将pMX-GFP和pCL包装质粒转染到293T细胞,48 h后荧光显微镜下观察,293T细胞正在包装生产携带GFP基因的逆转录病毒。见图2。
2.3 病毒感染HSF细胞 收集病毒上清液感染HSF细胞,48 h后倒置荧光显微镜下观察,包装生产的逆转录病毒感染绝大多数HSF细胞,被病毒感染的HSF细胞能够稳定表达外源性GFP基因。见图3。
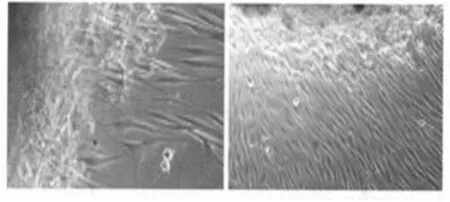
图1 原代培养HSF细胞(×100)

图2 293T细胞(×100)
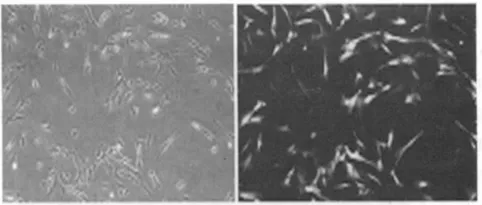
图3 病毒感染HSF细胞(×100)
3 讨论
HSF细胞位于人皮肤真皮层中,细胞来源广泛充足,取材容易方便,而HSF细胞来源的iPS细胞在干细胞领域具有广阔的研究空间和应用前景,故本实验选择HSF细胞作为逆转录病毒感染的候选细胞。采用组织块贴壁法在体外分离培养出HSF细胞,镜下观察HSF细胞培养过程。一些组织块周围首先出现角质细胞,呈薄膜状,而另一些组织块周围有少量脂肪细胞出现,可能切除皮肤组织标本过厚(至脂肪层)引起。1 w左右部分组织块周围爬出少量HSF细胞,随着细胞培养时间延长HSF细胞数量逐渐增多,形态呈长梭形、不规则形。2 w左右HSF细胞生长密度超过90%,排列呈放射状、栅栏状或漩涡状,此时可进行HSF细胞传代培养和冻存。组织块贴壁法分离培养HSF细胞时间周期相对较长,因此在培养的过程中要注意防止细胞污染。HSF细胞对数生长期为3~6 d,此时HSF细胞生长未受抑制、活力最佳,为逆转录病毒感染HSF细胞最佳研究阶段。
目前,可利用逆转录病毒〔4〕、慢病毒〔6〕、腺病毒〔7〕或转座子〔8〕等介导方式,将外源性目的基因导入体细胞内将其重编程为iPS细胞。本实验利用逆转录病毒为载体将GFP基因导入HSF细胞,评价逆转录病毒感染HSF细胞及被导入外源性基因在细胞内的表达情况。逆转录病毒为携带逆转录酶的RNA病毒,可与多种细胞表面蛋白相结合而进入到细胞内,然后以病毒RNA为模板,在逆转录酶的作用下将RNA转录为cDNA,进一步整合到宿主细胞染色体内,随宿主细胞DNA复制、转录、翻译和表达。逆转录病毒作为载体感染体细胞具有感染细胞范围广、病毒滴定度高、携带外源性基因容量大、整合到细胞DNA中能够使外源性基因在细胞内稳定表达等优点。首先,应用磷酸钙法将pMX-GFP和pCL包装质粒转染到293T细胞后,倒置荧光显微镜对比明、暗视野下不带绿色荧光和带绿色荧光293T细胞。结果显示,逆转录病毒成功的感染293T细胞,表明携带GFP基因已转染到293T细胞内,293T细胞成功包装生产携带GFP基因的逆转录病毒。在pMX-GFP和pCL包装质粒转染293T细胞48 h后,收集病毒上清液感染原代培养HSF细胞,48 h后在倒置荧光显微镜下对比带绿色荧光(暗视野)和不带绿色荧光(明视野)HSF细胞。结果显示大多数HSF细胞被包装生产后的逆转录病毒感染,逆转录病毒将外源性GFP基因成功的转染到HSF细胞内,细胞能够稳定的表达外源性GFP基因。上述实验表明逆转录病毒可作为有效的基因转移载体,将外源性基因转移到HSF细胞内,为下一步将其重编程为iPS细胞提供技术保障。
1 Carpenter MK,Inokuma MS,Denham J,et al.Enrichment of neurons and neural precursors from human embryonic stem cells〔J〕.Exp Neurol,2001;172(2):383-97.
2 Mummery C,Ward D,van den Brink CE,et al.Cardiomyocyte differentiation of mouse and human embryonic stem cells〔J〕.JAnat,2002;200(Pt 3):233-42.
3 Kaufman DS,Hanson ET,Lewis RL,et al.Hematopoietic colony-forming cells derived from human embryonic stem cells〔J〕.Proc Natl Acad Sci USA,2001;98(19):10716-21.
4 Takahashi K,Yamanaka S.Induction of pluripotent stem cells from mouse embryonic and adult fibroblast cultures by defined factors〔J〕.Cell,2006;26(4):663-76.
5 Park IH,Lerou PH,Zhao R,et al.Generation of human-induced pluripotent stem cells〔J〕.Nat Protoc,2008;3(7):1180-6.
6 Yu J,Vodyanik MA,Smuga-Otto K,et al.Induced pluripotent stem cell lines derived from human somatic cells〔J〕.Science,2007;318(5858):1917-20.
7 Stadtfeld M,Nagaya M,Utikal J,et al.Induced pluripotent stem cells generated without viral integration〔J〕.Science,2008;322(5903):945-9.
8 Kaji K,Norrby K,Paca A,et al.Virus-free induction of pluripotency and subsequent excision of reprogramming factors〔J〕.Nature,2009;458(7239):771-5.
