老年大肠息肉患者临床特点、内镜下处理及安全性分析
2012-06-28罗庆锋唐永莲
罗庆锋 石 蕾 唐永莲 许 乐
(卫生部北京医院消化内科,北京 100730)
大肠息肉是老年人的常见疾病,与大肠癌关系密切,去除大肠息肉是预防大肠癌的主要措施;内镜下息肉切除术是最常用的处理方法,最常见的并发症是术后出血。因老年患者体弱且并发疾病多,一旦出血,其后果更加严重。因此,研究老年人大肠息肉的临床特征,如何合理选用不同的内镜治疗方法,预防并发症的发生具有重要临床意义。本文旨在探讨老年人大肠息肉的临床特点、内镜下处理的策略和安全性。
1 资料与方法
1.1 资料
1.1.1 一般资料 老年组:我科2009年1月至2010年7月门诊及病房诊治的行结肠镜检查的老年人(≥60岁)1 463例,检出大肠息肉407例(检出率27.8%)共941枚,其中男275例,女132例,年龄60~94〔平均(74.4±12.9)〕岁。中青年组:同期中青年人(<60岁)行肠镜检查3 576例,检出大肠息肉225例(6.3%)共305枚,其中男128例,女97例,年龄20~59(平均47.9)岁。
1.1.2 仪器设备 采用Olympus QF-240/260型及富士能4400电子结肠镜、ERB型氩气发生器,电烧器、活检钳、圈套器、内镜注射针、三爪钳、金属止血夹等相关辅助器械。
1.2 诊治方法 治疗前检测血常规和出凝血时间,服用阿司匹林等抗血小板或其他抗凝药物者术前停药1 w。检查前应用聚乙二醇电解质散(PEG)或洗肠盐进行清肠等常规准备。循腔进镜至回盲部,然后边退镜边进行全结肠观察,对发现的息肉明确数目和解剖部位,估计测量大小,观察表面和基蒂特征。根据息肉大小、形态的不同,选用不同的方法进行治疗:微小息肉(直径≤0.5 cm),可在肠镜下用活检钳夹除;直径>0.5 cm但<1 cm、有蒂或亚蒂的小息肉,采用圈套器给予高频电一次性切除;直径≥1 cm、大的广基或压蒂息肉可黏膜下注射生理盐水后一次或分次切除;大的长蒂息肉可予尼龙绳套扎后电切除或电切除后放置金属夹预防迟发出血;巨大广基息肉或癌变者不适合内镜下切除,取活检送病理诊断,以后手术治疗。治疗时将圈套器或活检钳经内镜活检孔送入,在内镜直视下张开,直接夹除息肉或用圈套器套住息肉根部,然后轻轻将圈套器收紧,使之与息肉紧密接触,调节息肉与镜头的位置,选择电凝或混合电流(3.0~4.0)通电行息肉摘除,残端根据情况可用氩气处理,标本回收后送病理检查。多发性息肉分次由近端到远端进行摘除。记录术后并发症的发生及处理情况。
1.3 统计学方法 应用SPSS12.0软件进行统计学分析,计数资料组间比较采用χ2检验。
2 结果
2.1 大肠息肉的分布 直肠、乙状结肠均是结肠息肉的好发部位,老年人较中青年人右半结肠息肉明显增多。见表1。
2.2 大肠息肉的数目、大小、形态 老年组多发性息肉较中青年组明显增多,≥2 cm的息肉及分叶状息肉比例相对增多。见表2。
2.3 息肉的病理类型 老年人及中青年组腺瘤比例分别为63.0%及46.2%,二者有显著差异(P<0.05)。老年人及中青年组息肉伴癌变率有显著差异(P<0.05)。老年组息肉伴癌变1例来源于增生性息肉,其余均来源于腺瘤,其中绒毛状腺瘤癌变15枚,管状腺瘤癌变8枚,绒毛管状腺瘤癌变10枚;有6例是活检病理报告为腺瘤而息肉切除后病理结果为腺瘤伴癌变。而中青年组绒毛状腺瘤癌变3枚,管状腺瘤癌变1枚,绒毛管状腺瘤癌变2枚,炎性息肉及增生性息肉未见癌变。见表3。
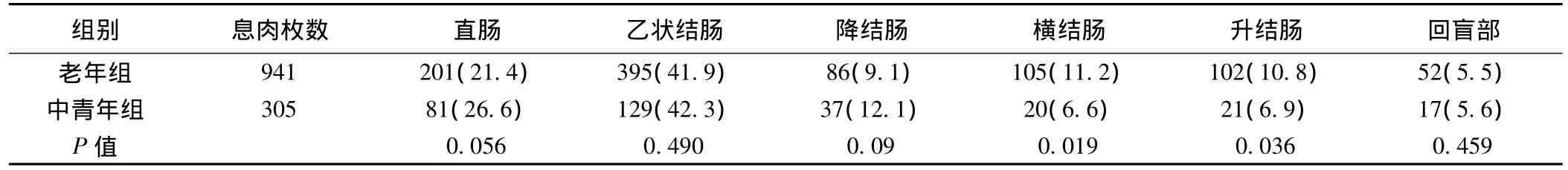
表1 息肉在各大肠段的分布情况〔枚(%)〕

表2 大肠息肉的数目、大小和形态〔枚(%)〕
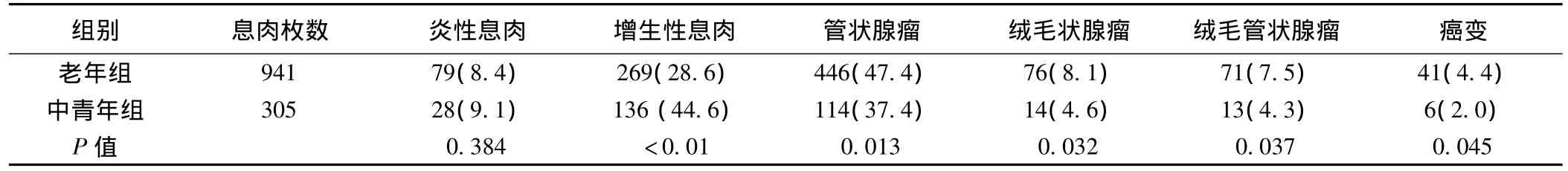
表3 大肠息肉的病理类型和癌变情况〔枚(%)〕
2.4 大肠息肉的治疗及并发症情况 老年组407例941枚息肉中,活检钳除662枚(70.3%),高频电切223枚(23.7%),因癌变或息肉较大需外科手术治疗56枚(6.0%)。效果及并发症:均成功切除息肉,无治疗相关肠穿孔及死亡病例。老年组内镜治疗后,有7例并发出血,均为套圈电切术后出血,活检钳除者未见出血并发症;其中,早发性出血(EPPB)(术中至术后24 h内)2例,迟发性出血(DPPB)(术后24 h以上至2 w)5例;4例为单发息肉,3例为多发息肉;6例息肉直径1 cm以上,其中息肉直径超过2 cm的有4例;2例为无蒂息肉;有3例为术后放置止血夹预防出血;5例并发高血压,4例并发糖尿病;1例因术前一直误服阿司匹林且未停用;1例术后第3天开始恢复抗血小板药物,术后第19天出现消化道出血。患者表现为便鲜血或暗红色血,急症肠镜下多表现为息肉残端渗血、滴血或新鲜血痂;4例不同程度血红蛋白下降;3例经内科药物保守治疗好转;4例采用急诊结肠镜下注射、喷洒药物或放置金属夹止血等方法止血,无血管造影栓塞及外科手术治疗。中青年组305枚息肉中,活检钳除232枚(76.1%),高频电切63枚(20.6%),外科手术治疗10枚(3.3%),术后有2例并发出血,均为直径1 cm以上息肉,1例保守治疗后好转,1例急诊肠镜放置金属夹后止血。
3 讨论
老年人大肠息肉的检出率各家报道不一〔1,2〕,多为15% ~45%,且随着年龄的增长发病率增高。大肠息肉好发于直肠及乙状结肠,但老年人升结肠及横结肠息肉的发病率却明显高于中青年人。因此,老年人大肠镜检查应尽量检查全大肠,不能只局限于远端大肠病变;另一方面,因右半结肠肠壁薄、位置深、腔内粪渣多等原因,息肉切除时并发症相对其他部位多,因此应引起重视。
病理学检查是最终的诊断和随访的重要依据。何晋德等〔3〕研究显示电切前息肉活检组织与电切后整体息肉组织的病理诊断存在明显的差异,不符合率占33.3%。活检对于腺瘤性息肉的大体类别判断仍较准确,但对腺瘤性息肉的具体分型差异较大,不符合率占23.9%。对于电切前活检诊断为炎性息肉的病例尤其要注意,由于有的息肉表面存在糜烂,因而影响了活检的病理诊断,所以活检诊断为炎性息肉的患者电切前后的病理诊断存在较大差异,不符合率达60%。因此对于切除后的息肉标本(特别是右半结肠息肉容易丢失)应尽量回收送检,以免遗漏重要的病理信息而影响进一步处理。
息肉的恶变与其大小、形态及病理类型有关,息肉体积大、基底部宽、绒毛成分多、表面糜烂出血、结节状或分叶状容易癌变〔1,4〕。大肠癌的发生与大肠腺瘤性息肉有密切的关系。文献报道直径1~2 cm的腺瘤性息肉恶变率为10%左右,而直径≥2 cm的腺瘤恶变率接近50%〔4〕。一般认为随着腺瘤的增大,腺瘤中的绒毛状成分逐渐增多,不典型增生加重,因而绒毛状腺瘤较管状腺瘤更容易发生癌变。
国外研究显示,考虑到发展为高级腺瘤的概率低及潜在的手术风险,对于微小息肉(≤0.5 cm)或小息肉(0.6~1 cm)是否需要处理存在争议〔5〕;但我国目前对于大肠息肉,不论大小、部位均应常规活检并摘除。进镜时如发现微小息肉一般立即夹除,以免在退镜时不易找到。文献报道大号活检钳优于标准活检钳〔6〕。小息肉以及大息肉(≥1 cm)多用内镜下套圈电切除,同时辅以根部注射、尼龙绳、金属夹等。对于那些内镜不能摘除的巨大息肉以及有癌变的息肉则应手术治疗。
息肉切除后出血(PPB)是内镜下治疗最常见的并发症〔7〕。研究表明,PPB原因有息肉、病人、操作三个方面的因素〔8〕。相关危险因素包括:年龄超过65岁、合并心血管疾病、慢性肾脏疾病、术前应用抗凝药、息肉直径大于1 cm、肠道准备欠佳、电凝电切模式选择、无意中切除等。预防出血方法包括息肉根部注射、应用止血夹、结扎装置等方法,但是其效果各家研究争议较大。在息肉因素中与出血相关最明显的因素为息肉直径,而与息肉形态、组织学特征、切除方法无明显关系;在病人因素中与延迟出血相关最明显的是高血压病史,而且出血间隔时间延长〔9〕。PPB老年人多合并高血压、糖尿病、血管硬化,一旦出血不易自止,小量出血者可以内科药物保守治疗;而出血较多者,急诊肠镜检查并进行止血是可行、有效的方法。
息肉切除后必须进行随访。随访有两个目的:一是查出并摘除上次检查遗漏的或新的息肉;另外,确立患者是否有形成晚期腺瘤的趋势。关于息肉术后的随访间隔,各家报道不一。一般认为,单个腺瘤切除术后1年随访1次,如检查阴性者每3年随访1次;多个腺瘤切除、腺瘤>2 cm,腺瘤伴有不典型增生或伴原位癌、广基的绒毛状或混合性腺瘤者为复发的高危患者,每3~6个月复查1次,阴性则每1年复1次,连续两次阴性者改为每3年复查1次,随访时间不少于15年。过去认为增生性息肉不列入随访计划,后长期观察发现其有癌变可能,因此,在这类人群中也应全面检查和随访。
1 郑芝田.胃肠病学〔M〕.北京:人民卫生出版社,2002:702-6.
2 Liu HH,Wu MC,Peng Y,et al.Prevalence of advanced colonic polyps in asymptomatic Chinese〔J〕.World JGastroenterol,2005;11(30):4731-4.
3 何晋德,刘玉兰,廖小云,等.大肠息肉电切前活检与电切后的临床病理比较〔J〕.中国内镜杂志,2003;9(6):39-41.
4 Coe SG,Wallace MB.Colonoscopy:new approaches to better outcomes〔J〕.Curr Opin Gastroenterol,2012;28(1):70-5.
5 Hassan C,Pickhardt PJ,Kim DH,et al.Systematic review:distribution of advanced neoplasia according to polyp size at screening colonoscopy〔J〕.Aliment Pharmacol Ther,2010;31(2):210-7.
6 Draganov PV,Chang MN,Alkhasawneh A,et al.Randomized,controlled trial of standard,large-capacity versus jumbo biopsy forceps for polypectomy of small,sessile,colorectal polyps〔J〕.Gastrointest Endosc,2012;75(1):118-26.
7 Peterlejtner T,Szewczyk T,Buczyńska E,et al.Colonoscopic polypectomyevaluation of the effectiveness and safety(single center experience)〔J〕.Pol Przegl Chir,2011;83(8):438-42.
8 Kimdo H,Lim SW.Analysis of delayed postpolypectomy bleeding in a colorectal clinic〔J〕.J Korean Soc Coloproctol,2011;27(1):13-6.
9 Ahlawat SK,Gupta N,Benjamin SB,et al.Large colorectal polyps:endoscopic management and rate of malignancy:does size matter〔J〕?J Clin Gastroenterol,2011;45(4):347-54.
〔2011-09-05收稿 2012-04-20修回〕
