均质条件对明胶乳液膜物理性能及控释性的影响*
2012-06-25尹寿伟马雯徐航唐传核杨晓泉
尹寿伟 马雯 徐航 唐传核 杨晓泉
(华南理工大学轻工与食品学院,广东广州510640)
聚乙烯等生物不可降解包装材料的使用造成了严重的环境污染问题[1].随着人们环保意识的增强以及对食品品质要求的提高,生物可降解材料已成为食品包装领域的发展方向.利用多糖、蛋白、油脂等天然高分子构建的膜材料具有良好的生物相容性和可降解性,可以用来替代塑料包装材料[2],其中,蛋白基可食性膜材料因具有营养性和良好的成膜性而备受重视[3].明胶是一种由动物皮肤、韧带和肌腱中的胶原降解而得的蛋白,其资源丰富,价格低廉,是一种很有潜力的成膜原料[4].但是,蛋白基膜材料具有亲水性和较差的水汽阻隔性[5],致使其应用受到限制.
在蛋白基质中添加疏水性油脂制备乳液膜材料可以明显改善蛋白膜材料的水汽阻隔性[6].制备乳液膜材料的传统方法是采用高速分散处理成膜乳液后浇注成膜.高速分散常用于食品流体搅拌以及高黏度液体的混合,在食品工业中应用广泛[7],利用高速分散可以形成微米级别的粒子[8].因此,膜材料油滴粒径较大会弱化膜材料的微结构.
高压微射流是一种环境友好的物理加工技术[9].样品处理过程中,高速流动的生物大分子溶液快速通过具有一定几何形状的腔体,物料同时受到高速剪切、高频震荡、空穴效应和对流撞击等机械力作用和相应的热效应,由此引发的机械力化学效应可诱导生物大分子物理、化学及结构性质的变化.文献[10]中利用动态超高压微射流技术制备了亚微米级的乳状液;文献[11]探讨了微射流处理对热变性乳液的影响.初步研究表明,乳液的稳定性在某种程度上与乳液中油滴粒子的粒径及分布有关[12].但是有关高压微射流对乳液膜材料微结构(油滴尺寸及分布)及特性的影响目前尚未见报道.
本研究采用高速分散和高压微射流技术制备明胶-橄榄油乳液膜材料,初步探讨了成膜乳液粒径与膜材料微结构及物理特性之间的构效关系,并研究了微射流技术制备的乳液膜材料对溶菌酶的控释性,以期为制备新型抗菌膜材料奠定理论基础.
1 材料与方法
1.1 实验材料及主要仪器
主要实验材料及仪器如下:明胶(美国Sigma公司),甘油(美国Sigma公司),橄榄油(上海嘉里粮油有限公司),T25 IKA高速分散机(德国IKA公司),M110-EH纳米微射流均质机(美国 MFIC公司),恒温恒湿箱(上海一恒科学仪器有限公司),MasterSizer 2000激光粒度仪(英国马尔文公司),质构分析仪(英国SMS公司),TCS SP5激光扫描共聚焦显微镜(德国莱卡仪器公司),原子力显微镜(美国Veeco公司).
1.2 明胶乳液膜的制备
称取5 g明胶溶于100 mL蒸馏水中,制成0.05g/mL的成膜溶液,50℃下水合2h,然后加入2g甘油作为塑化剂,再加入1 g橄榄油制备乳液.膜材料中可溶性固形物及其含量(质量分数)分别是:明胶62.5%,甘油25%,橄榄油12.5%.用1 mol/L的NaOH溶液调节成膜液pH值至8.0,磁力搅拌器搅拌均匀,用不同均质条件(A为明胶对照膜,未添加橄榄油;B为10000 r/min下高速均质4 min;C为高速均质4min,加微射流69MPa下进行3次循环)处理,不添加橄榄油的明胶溶液作为空白成膜液.乳液均质后立即放置于真空箱中脱气3min,量取一定体积的成膜液倒入有机玻璃盒中,于25℃、40%相对湿度的恒温恒湿箱中干燥24h后揭膜,将膜裁成一定规格尺寸,以进行下一步实验.实验前,所有的膜材料在相对湿度为58%的环境中平衡48h.
1.3 成膜液粒径的测定
将成膜溶液用蒸馏水稀释至折光比为10%的溶液,用MasterSizer 2000激光粒度仪测定成膜溶液的粒径分布[13].样品溶液的体积平均直径 D3,2、表面积平均直径D4,3用以下公式计算:

式中,ni为一定粒径范围的粒子数目;di为粒子直径.
1.4 膜厚度的测定
用千分尺(精确到0.001mm)在膜上随机取6个点,测量其厚度,结果取平均值.
1.5 膜机械性能的测定
膜的抗拉强度(TS)和断裂伸长率(EB)采用TA-XT2i质构分析仪测定,每种膜选定9个样品,膜表面不能有气孔或瑕疵,膜尺寸为2.5cm×8 cm,安装在测试爪盘上,顶部和底部的爪盘初始距离为50mm,测试速率为2 mm/s,爪盘拉伸样品直至断裂.抗拉强度用膜在拉伸测试中所承受的最大应力与其横截面积之比表示,断裂伸长率用膜断裂时两爪盘间距与初始间距的比值表示[14],每种膜测定9个样,取平均值.
TS和EB的计算如下:

式中:F为膜在断裂时所能承受的最大应力,N;S为膜的断面面积,m2;E为膜在断裂时所达到的长度,mm;E0为膜的初始长度,mm.
1.6 膜的水汽透过性测定
采用ASTM E96—95[15]的标准,稍作修改后测量膜的水汽透过系数.测试用杯的杯口直径为50 mm,深30 mm.在杯中放置蒸馏水,水面至杯口高度为8mm.将膜剪裁成直径为80 mm的圆形,遮住杯口,膜与杯口连接处用石蜡密封后放置于装有五氧化二磷的干燥器内,于25℃下每隔3h将测试杯取出,精确称量其质量变化,通过公式计算水汽透过系数(WVP):

式中:W为量杯水分增加量,g;t为时间,s;S'为膜覆盖杯杯口面积,m2;L为膜厚度,m;Δp为水蒸气压差,Pa.
1.7 激光共聚焦显微镜(CLSM)分析
乳液膜的微观结构利用装有20HCPL APO/0.70NA物镜的莱卡 DMRE-7(SDK)倒置显微镜(TCS SPS)进行观察[16].将样品膜裁成 20 mm ×20mm的尺寸,放置于载玻片中央,用1%的 Nile Blue和0.1%的Nile Red混合染料染色.小心地用盖玻片将膜固定,以防止产生气泡,在盖玻片边缘涂上硅油以防止水分蒸发.将载玻片倒置于载物台上,用100倍的物镜观察,激光器发射波长为514和633nm.
1.8 原子力显微镜(AFM)分析
原子力显微镜用于观察膜表面的微观形貌,将膜剪裁成4mm×4mm大小,用双面胶粘在载物台上进行扫描,选用轻敲模式(Tapping Mode)[17],图像的扫描范围为20 μm×20 μm,观察膜表面的形貌,并计算膜材料的表面粗糙度.
1.9 乳液膜对溶菌酶控释性的测定
膜材料(5cm×5cm)浸泡于50mL 66mmol/L的磷酸缓冲液(pH=7.0)中,于20℃、150 r/min条件下振荡,每隔一段时间(10、30、60、120、180、240、480、960、1440min)取样200μL,加入5mL 质量分数为0.015%的溶壁微球菌悬浮液,摇匀,450 nm波长下测定10min内吸光度的变化量,以0.001个吸光度的下降值为1个酶活单位.
2 结果与分析
2.1 成膜液的粒径
图1为不同均质条件处理得到的成膜液的粒径分布.高速分散机处理的成膜液粒径呈双峰状(1和20μm)分布,油滴粒径分散在1.0和50.0μm之间,而微射流处理后乳液粒径分布呈单峰状,集中分布于0.1~1.0μm之间.经过微射流二次处理,成膜乳液 D3,2、D4,3分别从 3.094 和 13.990 μm 降至 0.396和0.931μm.这与成膜乳液粒径分布图的变化是一致的.高速分散机末端高速运转的探头将成膜乳液吸入并分散成微米尺度的油滴;高压微射流处理过程中,高速流动的成膜乳液通过高压微射流纳米均质机的Z型腔体时,物料同时受到高速剪切、高频震荡、空穴效应和对流撞击等机械力作用和相应的热效应,由此引发的机械力化学效应促使形成纳米尺度且均匀分布的成膜乳液.

图1 不同均质条件处理的成膜液的粒径分布Fig.1 Particle size distributions of emulsions under different homogenization conditions
2.2 乳液膜的机械性能
表1示出了不同均质条件处理的膜材料的机械性能.从表1可以看出:明胶膜中添加油脂可增加膜的柔韧度,膜在断裂处的伸长度较大;单独使用高速分散机处理的乳液膜抗拉强度反而弱于对照膜;而经过微射流处理后的乳液膜抗拉强度明显提高,断裂伸长率是对照膜的2.5倍.原因可以结合乳液膜的微观结构来分析:高速分散处理后成膜液粒径较大且乳化稳定性差,成膜过程中油相迁移,富集在膜表面,膜内部结构不均匀,蛋白相和油相未能形成较强的相互作用,由于较大油滴破坏了膜材料网络的完整性,导致膜材料的机械强度比对照膜差;而经过微射流处理后,乳液粒径小、分布均匀且稳定性较好,形成柔韧的乳液膜,抗拉强度和伸长率明显提高.

表1 不同均质条件处理的膜材料的机械性能和水汽透过系数1)Table 1 Mechanical properties and water vapor permeability of the films under different homogenization conditions
2.3 乳液膜的水汽透过系数
实验中制备的乳液膜无论是高速分散还是微射流均质处理,都可以显著降低膜材料的水汽透过系数,且两者的WVP值之间没有显著差异(见表1).尽管两者均具有良好的水汽阻隔性,但相关机制是不同的:高速分散处理制备的膜材料形成类似双层膜的结构,即膜表面油相富集形成脂肪层,油脂的疏水性质阻挡水分子通过;微射流处理制备的膜材料内部形成致密均匀的蛋白相和油相交织的网络结构.均匀分布的疏水性油滴增加了水分子的扩散路径,因而降低了水分子的渗透速率,故橄榄油的添加显著提高了膜材料的水汽阻隔性.
2.4 不同均质条件乳液膜的CLSM结果
图2是对照膜和乳液膜的CLSM图.蛋白相为红色,油相为绿色.从图2(b)可以明显看到高速分散处理制备的乳液膜中油滴粒径大小不均匀,大至25μm,小至1 μm,油相离散分布于连续的蛋白相间;而经过微射流处理后油滴大小相对均一,且粒径都在5μm以下,油相均匀镶嵌在蛋白基质当中,形成网络结构相对紧密的乳液膜.
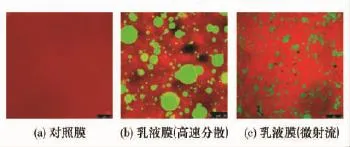
图2 激光共聚焦显微镜下乳液膜的微观图像Fig.2 Microscope images of emulsion films under CLSM
2.5 乳液膜的AFM结果

图3 乳液膜的原子力显微镜照片Fig.3 Images of emulsion films under AFM
AFM可以从微观角度提供膜表面粗糙度的相关信息,进而分析成膜液的组成和稳定性对膜表面结构的影响.图3为不同均质条件处理后的乳液膜和对照膜的表面直观微结构.由表2所示的乳液膜表面粗糙度发现,对照膜材料表面非常平整,表面粗糙度值仅有13.7nm.经过高速分散处理,乳液膜表面粗糙度升高到220.7 nm,而微射流处理制备的乳液膜表面比高速分散处理的膜材料平整很多,表面粗糙度下降为117.5 nm.这说明高压微射流能获得纳米尺度的成膜乳液,成膜后表面平整.

表2 不同均质条件处理的膜材料的表面粗糙度1)Table 2 Surface roughness of films under different homogenization conditions
2.6 乳液膜对溶菌酶的控释性
防止食品表面微生物污染的传统方法是在食品表面喷涂抗菌剂,该方法具有局限性,因为抗菌剂能快速向食品主体中扩散.蛋白基抗菌膜材料为食品表面微生物污染提供了新的解决途径,但蛋白膜材料的强吸湿性易造成膜结构松弛,抗菌剂快速释放.利用微射流技术制备的乳液膜材料对溶菌酶具有良好的控释性(见图4),这主要是因为均匀分散的油滴延缓了水向膜材料内部渗透,避免了膜结构的快速松弛,同时增加了溶菌酶在膜材料中的扩散路径.
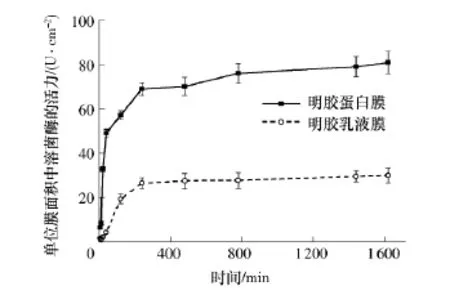
图4 微射流技术制备的乳液膜对溶菌酶的控释性Fig.4 Controlled release property to lysozyme from emulsion films prepared through microfluidization technique
3 结论
(1)采用微射流处理可制备得到纳米尺度的成膜乳液,以此制备的膜材料具有良好的机械性能、水汽阻隔性和对溶菌酶的控释性.
(2)高速分散处理制备的成膜乳液油滴粒为微米尺度,且均匀性差,成膜过程中部分油相富集在乳液膜表面,形成类似双层膜的结构,该材料具有良好的水汽阻隔性,但抗拉强度低.
(3)利用高速分散和微射流两种处理方法制备的成膜乳液在干燥过程中出现不同程度的团聚现象.乳液膜的机械性能和阻隔性与膜材料中的油滴大小及分布具有很大的关联.
[1]Debeaufort F,Quezada-Gallo J A,Voilley A.Edible films and coatings:tomorrow’s packagings:a review[J].Critical Reviews in Food Science,1998,38(4):299-313.
[2]Keste J J,Fennema O.Edible films and coatings:a review[J].Food Technology,1986,40(12):47-59.
[3]Ou S Y,Kwok K C,Kng Y J.Changes in vitro digestibility and available lysine of soy protein isolate after formation of film [J].Journal of Food Engineering,2004,64(3):301-305.
[4]Bialopiotrowicz T,Jańczuk B.Surface properties of gelatin films[J].Langmuir,2002,18(24):9462-9468.
[5]Kristo E,Biliaderis C G,Zamprake A.Water vapour barrier and tensile properties of composite caseinate-pullulan films:biopolymer composition effects and impact of beeswax lamination[J].Food Chemistry,2007,101(2):753-764.
[6]Perez-Mateos M,Montero P,Gomez-Guillen M C.Formulation and stability of biodegradable films made from cod gelatin and sunflower oil blends[J].Food Hydrocolloids,2009,23(1):53-61.
[7]Urban K,Wagner G,Schaffner D,et al.Rotor-stator and disc systems for emulsification processes[J].Chemical Engineering and Technology,2006,29(1):24-31.
[8]Pinnamaneni S,Das N G,Das D K.Comparison of oil-inwater emulsions manufactured by microfludization and homogenization [J].Pharmazie,2003,58(8):54-58.
[9]尹寿伟,唐传核,温其标,等.微射流处理对芸豆分离蛋白构象和功能特性的影响[J].华南理工大学学报:自然科学版,2009,37(10):112-116.Yin Shou-wei,Tang Chuan-he,Wen Qi-biao,et al.Effect of micro-fluidization treatment on conformational and functional properties of kidney bean(Phaseolus vulgaris L)protein isolates[J].Journal of South China University of Technology:Natural Science Edition,2009,37(10):112-116.
[10]Jafari S M,He Y,Bhandari B.Production of sub microne emulsions by ultrasound and microfluidization techniques[J].Journal of Food Engineering,2007,82(4):478-488.
[11]Iordache M,Jelen P.High pressure micro-fluidization treatment of heat denatured whey proteins for improved functionality[J].Innovative Food Science and Emerging Technologies,2003,4(4):367-376.
[12]Debeaufort F,Martin-Polo M,Volley A.Polarity,homogeneity and structure affect water vapour permeability of model edible films[J].Journal of Food Science,1993,58(2):426-429,434.
[13]Perez-Gago M B,Krochta J M.Lipid particle size effect on water vapour permeability and mechanical properties of whey protein/beeswax emulsion films[J].Journal of Agricultural and Food Chemistry,2001,49(2):996-1002.
[14]ASTM.D882-97,Standard test method for tensile properties of thin plastic sheeting[S].
[15]McHugh T H,Avena-Bustillos R,Krochta J M.Hydrophilic edible films:modified procedure for water vapour permeability and explanation of thickness effects[J].Journal of Food Science,1993,58(4):899-903.
[16]Wang L Z,Auty M A E,Rau A,et al.Effect of pH and addition of corn oil on the properties of gelatin-basedbiopolymer films [J].Journal of Food Engineering,2009,90(1):11-19.
[17]Fabra M J,Pérez-Masiá R,Talens P,et al.Influence of the homogenization conditions and lipid self-association on properties of sodium caseinate based films containing oleic and stearic acids[J].Food Hydrocolloids,2011,25(5):1112-1121.
