肺炎衣原体实时定量PCR 检测方法的建立
2012-06-22李林海陈丽丹廖杨陈建芸石玉玲
李林海,陈丽丹,廖杨,陈建芸,石玉玲
(广州军区广州总医院检验科,广东广州 510010)
肺炎衣原体(chlamydia pneumonia,Cpn)是一种在细胞内寄生的革兰染色呈阴性的微生物,是20世纪80年代发现的呼吸道致病微生物,可引起哮喘、肺炎以及急性支气管炎等疾病[1-3]。Cpn主要通过呼吸道的分泌物进行传播,因此,在人口较为密集的地方很容易出现流行。目前临床上检测肺炎衣原体的方法很多,主要有细胞培养分离法、直接或间接免疫荧光法、酶联免疫吸附法以及多聚酶链反应(polymerase chain reaction,PCR)法,但是以上方法均存在一定的局限性[4-5]。我院针对Cpn建立了实时定量PCR检测方法,现报道如下。
1 资料与方法
1.1 对象
研究对象为2010年1月至2011年5月于我院住院治疗的呼吸道感染患者,共200例,其中男124例,女76例,年龄4~67岁,平均34.5岁。所有患者均采集咽拭子样本,其中68例患者采集肺泡冲洗液样本。
1.2 材料、试剂和仪器
呼吸道病原微生物(肺炎支原体、肺炎双球菌、流感病毒、副流感病毒以及腺病毒等)由本院保存。
Cpn PCR根据primer 5.0设计由上海英骏生物公司合成;SYBR Green通用型qPCR Master Mix购自罗氏生物;Real-time PCR扩增仪购自Applied Biosystems;TWAR免疫荧光试剂盒购自美国Sigma公司。
1.3 实验方法
1.3.1 引物设计 根据GenBank已公布的肺炎衣原体基因序列,选取高特异和高保守的16S核糖体蛋白基因设计 PCR引物,引物序列如下:CpnF:5'-TGA AGT CGG AAT TGC TAG TAA TGG-3';CpnR:5'-GTG TGT ACA AGG CCC GGG AAC-3'。扩增基因片段长度为450 bp。
1.3.2 基因组 DNA的提取 将500 μl Cpn、肺炎支原体、肺炎双球菌、流感病毒、副流感病毒以及腺病毒等标准液置于1.5 ml离心管中,再加入等体积的酚 ∶氯仿 ∶异戊醇(25 ∶24 ∶1),在4 ℃下以12 000 r·min-1离心15 min,吸取上清;并向上清加入等体积预冷的异丙醇和1/10体积3 mmol·L-1醋酸铵溶液,轻轻混匀后,置于冰上30 min;待有絮状物形成后4℃下12 000 r·min-1离心15 min,弃上清;用70%冰乙醇洗涤沉淀2次,4 ℃下12 000 r·min-1离心 15 min,弃上清;最后溶解于50 μl TE缓冲液中,-20℃保存作为引物特异性分析的模板。
1.3.3 RT-PCR反应 反应体系:2×SYBR Green mix 12.5 μl,CpnF/CpnR 引物(10 μmmol·L-1)各 1 μl,模板1 μl,补双蒸水至终体积为25 μl。将上述的反应液加入 real time PCR 管中,以1 000 r·min-1离心 1 min,使反应液全部甩到管底。然后将PCR管放入PCR仪中进行反应,反应采用两步法进行。预变性:95℃,30 s;变性:95℃,3 s;退火延伸:60℃,30 s;构建溶解曲线。反应结束后对结果进行分析。
1.3.4 引物特异性分析 将Cpn、肺炎支原体、肺炎双球菌、流感病毒、副流感病毒以及腺病毒的基因组DNA稀释到50 ng·μl-1,按上述PCR反应体系以及条件进行反应,分析引物的特异性;将 Cpn的基因组DNA 倍比稀释为 6 个不同的浓度(200.0、40.0、8.0、1.6 ng·μl-1,320.0、64.0 pg·μl-1),模板 1 μl,按照上述反应体系和条件分析PCR的最低DNA检出浓度。
1.3.5 RT-PCR检测临床样本 直接以咽拭子样本和肺泡冲洗液样本作为模板,模板5 μl,按上述反应体系和条件进行PCR,分析样本的阳性率。
1.3.6 免疫荧光检测临床样本 采用免疫荧光呼吸道6种病原体IgM+IgG联合检测试剂盒,对咽拭子样本和肺泡冲洗液样本进行分析。6种呼吸道病原菌分别为Cpn、肺炎支原体、肺炎双球菌、流感病毒、副流感病毒以及腺病毒。
2 结 果
2.1 引物特异性以及溶解曲线分析
本实验以肺炎支原体、肺炎双球菌、流感病毒、副流感病毒以及腺病毒为对照,分析Cpn CpnF/CpnR引物的特异性。实验结果如图1所示,肺炎支原体、肺炎双球菌、流感病毒、副流感病毒以及腺病毒等均呈阴性,而肺炎衣原体呈阳性。由图2可知,熔解曲线峰单一,说明引物特异性高,无非特异产物出现。
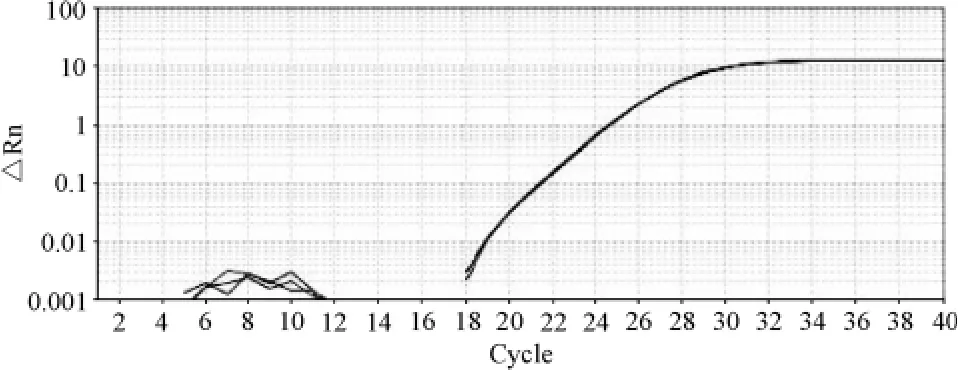
图1 CpnF/CpnR引物的特异性分析Fig 1 The specificity analysis of CpnF/CpnR primer

图2 CpnF/CpnR引物的熔解曲线Fig 2 The melt curve of CpnF/CpnR primer
2.2 敏感性和线性范围
肺炎衣原体标品DNA以1∶5连续稀释6个浓度梯度后(200.0、40.0、8.0、1.6 ng·μl-1,320.0、64.0 pg·μl-1)作为PCR的模板,进行实时定量PCR扩增。扩增曲线如图3所示。

图3 不同浓度肺炎衣原体标准DNA扩增曲线Fig 3 The amplification curve of Cpn standard DNA of different concentrations
由图3可知,6个浓度的标准DNA模板均呈阳性,采用本方法可以测得的最低DNA浓度为64 pg·μl-1,当低于 64 pg·μl-1时扩增曲线的重复性较差,因此,该方法可以检测的线性范围为 64.0 pg·μl-1~200.0 ng·μl-1,模板浓度在此范围内可以进行精确的定量。
2.3 临床样本检测分析
分别对200例患者的咽拭子样本和68例患者的肺泡冲洗液样本进行了RT-PCR检测,同时与荧光免疫检测的结果进行比较,结果见表1。

表1 RT-PCR和免疫荧光法对咽拭子和肺泡冲洗液中肺炎衣原体的检出率比较Tab 1 The detection rate analysis of chlamydia pneumoniae between RT-PCR and immunofluorescence in clinical samples
如表1所示:RT-PCR对咽拭子和肺泡冲洗液中的Cpn阳性检出率分别为94.34%和84.61%,免疫荧光法的阳性检出率分别为83.02%和73.08%。RTPCR的检出率高于免疫荧光法。
3 讨 论
Cpn感染在呼吸道疾病的发生中占有很大的比例,目前临床上诊断的方法有细胞培养分离法、直接或间接免疫荧光法以及PCR法[6-7]。细胞培养法操作复杂,周期较长,分离效率较低,不适合临床快速检测[8]。抗体免疫荧光检测法是一种比较灵敏的方法,但是由于Cpn与沙眼衣原体之间存在抗原交叉反应,给诊断带来了一定的困难;同时Cpn IgM抗体一般在患者发病后1周后才能检测到,而且免疫系统发育不完全患者出现假阳性的比率较高[9]。多聚酶链反应在临床检测Cpn感染中也被广泛使用,但是该技术只能对Cpn感染作定性分析,无法定量[10]。
近年来,随着荧光定量PCR的问世,该技术迅速应用于临床诊断。荧光定量PCR具有可实时监测、准确性高、效率高等优点,并能降低PCR交叉污染问题。目前,常用的PCR定量方法有SYBR GreenⅠ随机参入法和TaqMan探针法。TaqMan探针法特异性更高,但是其成本较高[11];SYBR GreenⅠ随机参入法无需探针,因此,成本低而且操作简单,适合于临床检测。我们针对Cpn 16S核糖体蛋白的保守序列设计了一对荧光定量PCR,通过特异性分析显示该引物具有极高的特异性,且在模板浓度 64.0 pg·μl-1~200.0 ng·μl-1范围内具有极好的线性,并比较了RT-PCR和免疫荧光法的阳性检出率,结果显示RT-PCR的阳性检出率高于免疫荧光法。本研究采用了200个咽拭子样本和68个肺泡冲洗液样本进行分析,通过大量的样本比较,增加了研究的准确性。综上所述,本实验成功建立了临床快速诊断Cpn的方法,灵敏度高且周期短,值得临床推广使用。
[1]KORPPI M,PALDANIUS M,HYVARINEN A,et al.Chlamydia pneumoniae and newly diagnosed asthma:a case-control study in 1 to 6-year-old children[J].Respirology,2004,9(2):255-259.
[2]黄海辉,张婴元,汪复,等.亚洲地区肺炎支原体和肺炎衣原体在成人社区获得性肺炎中的流行病学研究[J].中国感染与化疗杂志,2008,8(2):89-93.
[3]SENN L,JATON K,FITTING J W,et al.Does Respiratory infection due to chlamydia pneumoniae Still Exist?[J].Clin Infect Dis,2011,53(8):847-848.
[4]刘广超,吴移谋.肺炎嗜衣原体诊断方法的研究进展[J].微生物学免疫学进展,2006,34(4):71-75.
[5]叶刚强.肺炎衣原体血清学检测及临床价值[J].国际医药卫生导报,2006,12(3):59.
[6]LI Y,WANG Y,NIE F,et al.A nested multiplex polymerase chain reaction assay for the differential identification of three zooanthroponotic chlamydial strains in porcine swab samples[J].J Vet Diagn Invest,2011,23(4):673-681.
[7]BRITTAIN L R,NORD S,OLOFSSON S,et al.Multiplex realtime PCR for detection of respiratory tract infections[J].J Clin Virol,2008,41(1):53-56.
[8]方芳,窦常胜,浦春.外周血PCR和ELISA方法早期诊断婴幼儿 Cpn感染[J].中华全科医学,2008,6(7):667-668.
[9]郑广力,孙利炜,李丽红.荧光定量PCR在肺炎衣原体感染中的诊断评价[J].临床儿科杂志,2009,27(7):619-621.
[10]宫道华.小儿感染病学[M].北京:人民卫生出版社,2003:3-5.
[11]APFALTER P,BAROUSCH W,NEHR M,et al.Comparison of a new quantitative ompA-based real-time PCR TaqMan assay for detection of chlamydia pneumoniae DNA in respiratory specimens with four conventional PCR assays[J].J Clin Microbiol,2003,41(2):592-600.
