人CCR5基因真核表达质粒的构建及其鉴定
2012-06-22程林宋红勇吴喜林吴稚伟
程林,宋红勇,吴喜林,吴稚伟
(南京大学医学院公共健康医学中心,江苏南京 210093)
CC型趋化因子受体5(CC chemokine receptor 5,CCR5)是G蛋白偶联受体超家族的成员,主要表达于T淋巴细胞、巨噬细胞、树突状细胞等细胞膜上,是人类免疫缺陷病毒(human immunodeficiency virus,HIV)入侵机体细胞的主要辅助受体之一,也是HIV-1水平传播和垂直传播的最主要的辅助受体。因此,以CCR5为靶点的HIV-1受体拮抗剂受到越来越多的关注[1]。本研究通过构建人CCR5真核表达质粒,为进一步的CCR5基因疫苗的研究奠定基础。
1 材料和方法
1.1 材料
CHO-K1细胞和GHOST-X4细胞均为南京大学医学院公共健康医学中心保存,生长于含10%灭活胎牛血清(美国 Gibco公司)、2 mmol·L-1L-谷氨酰氨的DMEM培养基中。含人CCR5的原核表达质粒pETCCR5以及含荧光素酶(luciferase)报告基因的R5噬性HIV假病毒JR-FL均为本中心保存。高保真DNA聚合酶PrimeSTAR、T4 DNA连接酶和反转录试剂盒均购自大连Takara公司。核酸内切酶为美国Fermentas MBI公司产品。TRIzol试剂和转染试剂Lipofectamine 2000均购自美国Invitrogen公司。PE标记的鼠抗人CCR5单抗2D7为美国BD公司产品。去内毒素质粒中量提取试剂盒以及用于检测luciferase活性的细胞裂解液及底物均购自美国Promega公司。
1.2 方法
1.2.1 PCR引物的设计 根据 GenBank中人CCR5基因序列,用软件Oligo 6.0设计引物。上游引物加入HindⅢ限制性酶切位点和增强表达的Kozak序列[2];下游引物均引入XhoⅠ限制性酶切位点。上游引物:5'-ACA GAA GCT TGGA TTA TCA AGT GTC-3'(实线为HindⅢ酶切位点,虚线示Kozak序列);下游引物:5'-GTGTCT CGA GTC ACA AGC CCA CAG ATA TTT CC-3'(实线示XhoⅠ酶切位点)。引物由上海Invitrogen生物有限公司合成。
1.2.2 PCR扩增人 CCR5基因 以原核表达质粒pET-CCR5为模板,PCR扩增人CCR5基因。反应条件为94℃变性4 min,然后 98℃ 10 s、60℃ 10 s、72℃ 80 s,扩增30个循环;最后72℃延伸5 min。产物经1%琼脂糖凝胶电泳鉴定。
1.2.3 含CCR5基因重组真核表达质粒的构建与序列鉴定 用限制性内切酶HindⅢ和XhoⅠ双酶切1 μg真核表达质粒pcDNA3.1和纯化的PCR产物。酶切产物纯化后用 T4 DNA连接酶进行连接,并转化TOP10感受态细胞,37℃培养过夜。挑取氨苄青霉素平板上的菌落,扩增后通过核酸序列测定,选取100%同源的质粒命名为pcDNA3.1-CCR5。
1.2.4 RT-PCR检测 CCR5基因的转录 取2 μg重组质粒pcDNA3.1-CCR5,于6孔板内,按照试剂盒说明书转染CHO-K1细胞。阴性对照取2 μg pcDAN3.1载体质粒转染CHO-K1。转染48 h后,用TRIzol试剂裂解细胞,按试剂说明书提取基因组总RNA,取1 μg RNA为模板进行反转录合成cDNA。取1 μl cDNA为模板,PCR扩增CCR5基因,产物经过琼脂糖凝胶电泳鉴定[3]。
1.2.5 流式细胞术检测细胞膜CCR5蛋白表达 重组质粒pcDNA3.1-CCR5转染CHO-K1细胞48 h后,取2×105细胞,PBS洗涤后,用100 μl流式缓冲液重悬,加入2 μl抗人 CCR5荧光抗体,室温避光反应30 min,洗涤后用流式细胞仪检测。pcDAN3.1载体质粒转染CHO-K1作为阴性对照组。
1.2.6 HIV-1假病毒感染实验 96孔板中接种GHOST-X4细胞1×104孔-1,培养过夜后,转染重组质粒 pcDNA3.1-CCR5 0.2 μg·孔-1,48 h 后每孔加入200 TCID50的R5噬性HIV假病毒JR-FL,培养48 h后裂解细胞,检测luciferase活性。对照组转染载体质粒pcDNA3.1。每组设3个复孔,实验重复3次。
2 结 果
2.1 PCR扩增人CCR5基因
以质粒pET-CCR5为模板,PCR扩增人CCR5基因。扩增产物经1%琼脂糖凝胶电泳,在大约1 000 bp的位置上出现目的条带(图1)。
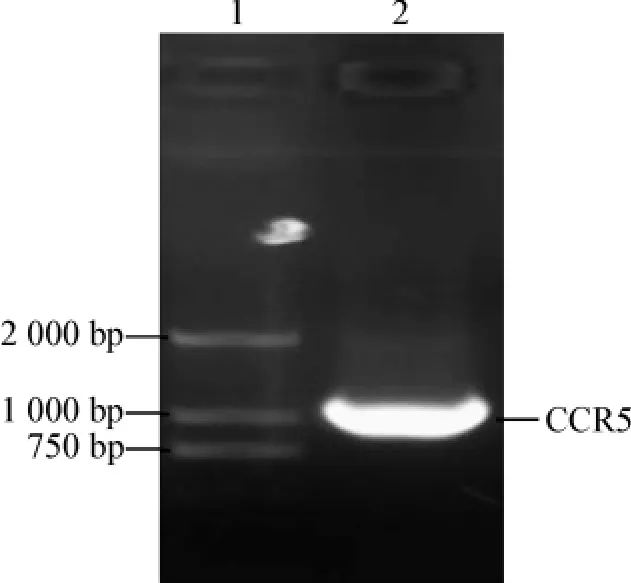
图1 人CCR5基因的PCR扩增Fig 1 The agarose gel electrophoresis analysis of PCR product of human CCR5 gene
2.2 真核表达质粒pcDNA3.1-CCR5的序列鉴定
重组质粒pcDNA3.1-CCR5核酸序列测定结果显示,目的基因全长1 059 bp。Blast结果进一步表明,目的基因序列和GenBank中已经登记的人CCR5基因序列100%同源。以上结果表明,人CCR5基因被成功克隆到pcDNA3.1中。
2.3 CCR5基因在CHO-K1细胞中的表达
重组质粒 pcDNA3.1-CCR5转染 CHO-K1 48 h后,提取细胞总RNA,RT-PCR检测CCR5基因的转录,产物经琼脂糖凝胶电泳在大约1 000 bp的位置上出现目的条带(图2),表明pcDNA3.1-CCR5已成功导入CHO-K1细胞内,并能正确转录合成mRNA。

图2 RT-PCR鉴定CCR5基因的转录Fig 2 RT-PCR analysis of CCR5 gene transcription
为了进一步鉴定该基因在蛋白水平的表达及膜定位情况,本研究用抗人CCR5蛋白的荧光抗体做流式分析,结果表明瞬时转染重组质粒pcDNA3.1-CCR5 48 h后,约25.6%的CHO-K1细胞表面表达CCR5蛋白(图3)。该结果进一步表明重组质粒pcDNA3.1-CCR5被成功导入CHO-K1细胞内,并得到正确的转录、翻译以及细胞膜定位。
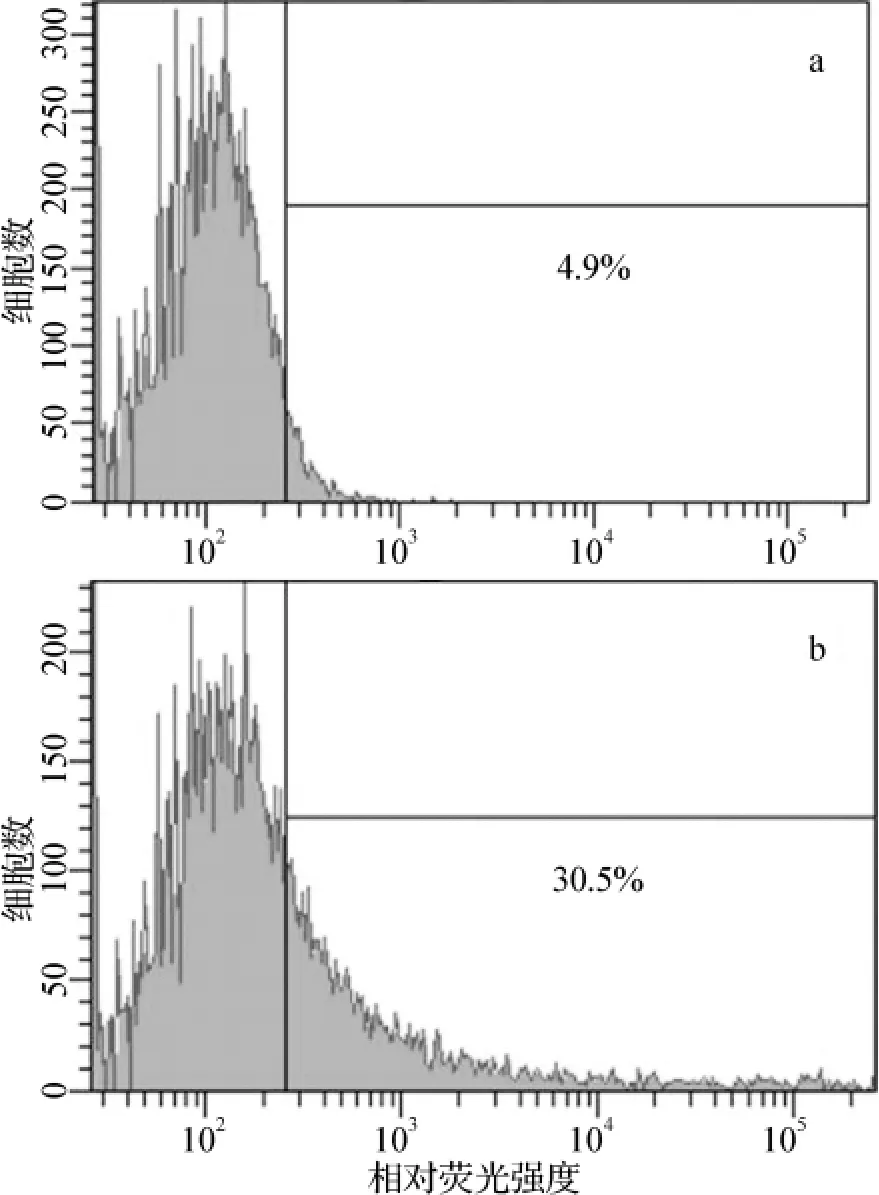
图3 流式细胞术检测细胞膜表面CCR5蛋白Fig 3 Flow cytometry detection of cell surface CCR5 protein
2.4 膜表达CCR5能够介导R5噬性HIV假病毒的感染
HIV-1假病毒JR-FL感染被重组质粒pcDNA3.1-CCR5转染的 GHOST-X4细胞48 h后,实验组luciferase活性是对照组的200倍以上,经t检验,P=0.003 99(图4),两组之间的差异有统计学意义。该实验结果表明,转染重组质粒pcDNA3.1-CCR5后,使GHOST-X4细胞具备了被R5噬性HIV-1假病毒感染的能力,进一步证实CCR5在GHOST-X4细胞内得到正确表达和细胞膜定位,而且具有介导R5噬性HIV-1假病毒感染的功能。
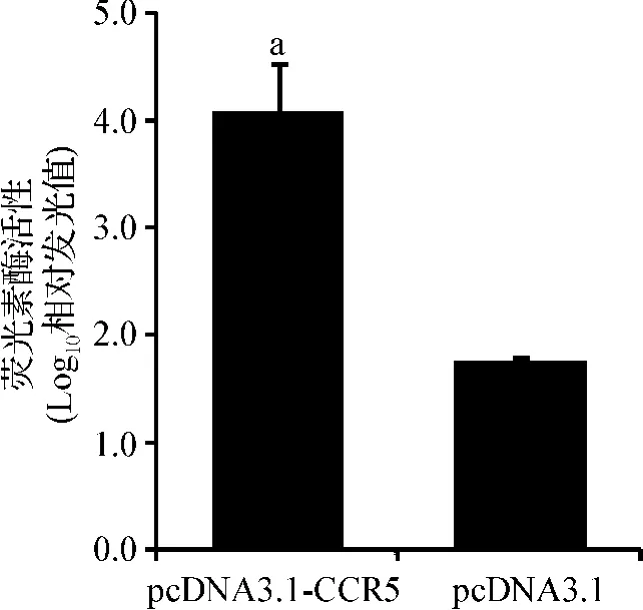
图4 荧光素酶活性检测Fig 4 Relative luciferase unit of JR-FL infected GHOSTX4 cells
3 讨 论
CCR5是β趋化因子(MIP-1α、MIP-1β和RANTES)的受体,主要表达于T淋巴细胞、单核细胞、树突状细胞等的细胞膜上,具有调控T细胞和单核和(或)巨噬细胞的迁移、增殖等免疫的功能。CCR5具有7个跨膜 α螺旋,结构上分为:胞外N末端,3个胞外环(ECL1-3),3个胞内环和胞内C末端。自1996年发现CCR5是HIV-1感染细胞的辅助受体以来,特别是在发现CCR5基因Δ32突变者在拥有正常的免疫功能和炎症反应的同时,还能够抵抗HIV-1的感染或抑制感染后疾病的进展之后[4],以CCR5为靶点的HIV受体拮抗剂成为研究的热点,且取得了明显的进展,目前主要有以下4种CCR5拮抗剂:趋化因子衍生物、非肽类小分子化合物、肽类化合物和单克隆抗体[5]。
CCR5的膜外结构域包括N末端及3个胞外环,可为单克隆抗体提供多个抗原表位,而识别不同表位的单克隆抗体与CCR5结合后对R5噬性HIV病毒具有不同的抑制效应[6]。CCR5通过其N末端和ECL2与HIV gp120相互作用,推动膜融合过程,从而介导HIV感染细胞[7]。因此,识别CCR5 N末端和ECL2的抗体对R5病毒一般具有不同程度的中和作用。近期的研究发现,识别ECL1的抗体能够促CCR5内化,下调细胞表面CCR5的量,从而抑制R5噬性HIV的感染[8]。
尽管已有多种 CCR5单克隆抗体如 PRO140、mAb004以及2D7进入临床开发阶段[9],但 CCR5单克隆抗体具有潜在的过敏反应,且长期使用易导致耐药毒株及中和抗-抗体等缺点。在HIV-1感染后长期不进展以及长期暴露而未被感染的人群中发现,针对CCR5 ECL1、具有抑制R5噬性HIV-1感染的自身抗体[10]。这些因素推动了 CCR5自身抗体的研究[11-12]。本研究构建了能够在真核细胞中正确表达、定位,且具有介导R5噬性HIV假病毒感染功能的人CCR5真核表达质粒,为进一步的基因疫苗的研究奠定基础。
[1]GILLIAM B L,RIEDEL D J,REDFIELD R R.Clinical use of CCR5 inhibitors in HIV and beyond[J].J Transl Med,2011,9(Suppl 1 S9):1-14.
[2]程林,卢春,陈秀英,等.人类疱疹病毒8型病毒干扰素调节因子编码基因的克隆及在真核细胞中的表达[J].南京医科大学学报:自然科学版,2006,26(12):1145-1149.
[3]郭莉婷,陈颖,程月新,等.胃癌组织中B7-H4的表达及其临床意义[J].东南大学学报:医学版,2010,29(3):306-311.
[4]ALLERS K,HUTTER G,HOFMANN J,et al.Evidence for the cure of HIV infection by CCR5 Δ32/Δ32 stem cell transplantation[J].Blood,2011,117(10):2791-2799.
[5]LI L,SUN T,YANG K,et al.Monoclonal CCR5 antibody for treatment of people with HIV infection[J].Cochrane Database Syst Rev,2010,8(12):1-9.
[6]SCHANZER J,JEKLE A,NEZU J,et al.Development of tetravalent,bispecific CCR5 antibodies with antiviral activity against CCR5 monoclonal antibody-resistant HIV-1 strains[J].Antimicrob Agents Chemother,2011,55(5):2369-2378.
[7]DA L T,WU Y D.Theoretical studies on the interactions and interferences of HIV-1 glycoprotein gp120 and its coreceptor CCR5[J].J Chem Inf Model,2011,51(2):359-369.
[8]PASTORI C,WEISER B,BARASSI C,et al.Long-lasting CCR5 internalization by antibodies in a subset of long-term nonprogressors:a possible protective effect against disease progression[J].Blood,2006,107(12):4825-4833.
[9]TENORIO A R.The monoclonal CCR5 antibody PRO-140:the promise of once-weekly HIV therapy[J].Curr HIV/AIDS Rep,2011,8(1):1-3.
[10]LOPALCO L.Natural anti-CCR5 antibodies in HIV-infection and-exposure[J].J Transl Med,2011,9(Suppl 1 S4):1-11.
[11]PASTORI C,CLIVIO A,DIOMEDE L.Two amino acid substitutions within the first external loop of CCR5 induce human immunodeficiency virus-blocking antibodies in mice and chickens[J].J Virol,2008,82(8):4125-4134.
[12]HUNTER Z,SMYTH H D,DURFEE P,et al.Induction of mucosal and systemic antibody responses against the HIV coreceptor CCR5 upon intramuscular immunization and aerosol delivery of a virus-like particle based vaccine[J].Vaccine,2009,28(2):403-414.
