巴斯德毕赤酵母表达的人抑瘤素M发酵条件及发酵产物分析
2012-06-20高海成刘国民周余来颜炜群
孔 宁,高海成,刘国民,陈 月,周余来,颜炜群
(1.吉林大学药学院医用生物材料学教研室,吉林 长春 130021;2.吉林大学药学院临床药学与药事管理学教研室,吉林 长春 130021;3.吉林大学第二医院骨科,吉林 长春 130041)
巴斯德毕赤酵母表达的人抑瘤素M发酵条件及发酵产物分析
孔 宁1,高海成2,刘国民3,陈 月1,周余来1,颜炜群1
(1.吉林大学药学院医用生物材料学教研室,吉林 长春 130021;2.吉林大学药学院临床药学与药事管理学教研室,吉林 长春 130021;3.吉林大学第二医院骨科,吉林 长春 130041)
目的:研究巴斯德毕赤酵母表达的人抑瘤素M(hOSM)大规模发酵条件。方法:利用hOSM毕赤酵母高表达菌株,于试管水平进行发酵pH条件的摸索,以补料分批培养方式在80L发酵罐中对hOSM工程菌进行3个批次的高密度发酵,控制和优化各种发酵条件,通过SDS-PAGE对发酵产物进行分析。结果:最终确定在pH 5.0的FM21培养基中扩增菌体,待菌体密度达190g·L-1时添加甲醇诱导,在发酵液pH 5.5的条件下,发酵温度稳定在28℃,通入空气的流量为2vvm,转速为650r·min-1,罐内压力为10P,溶解氧保持在25%左右,甲醇流加速度在9.3mL·h-1·L-1初始发酵液体积,诱导36h时结束发酵,hOSM占分泌总蛋白的28%,产量达到280mg·L-1。结论:应用hOSM工程菌能够进行稳定的发酵,为进行下一步生物学功能测定提供充足的物质基础。
抑瘤素M;毕赤酵母;发酵
抑瘤素 M(oncostatin M,OSM)是一种相对分子质量约为28 000的细胞生长调节因子,属于白细胞介素6(IL-6)家族中的一员,该家族成员之间显示出相似的生物学功能,并均通过受体gp130亚单位进行信号传递[1]。OSM具有广泛的生物学活性,包括参与炎症反应、神经元再生、造血作用、重塑细胞外基质及抑制多种肿瘤细胞的增殖等[2]。有报道[3-4]显示:OSM对肺癌、胃癌、骨肉瘤、肝癌等还具有抑制其生长并诱导其分化的作用。健康人血清中OSM含量仅为24ng·L-1,故人们尝试通过大肠杆菌[5]及哺乳动物细胞[6]等表达系统来获取OSM,但表达量均较低,无法满足对OSM的大量需求。毕赤酵母表达系统能在甲醇诱导下进行连续发酵,表达水平稳定,易于放大培养,适用于大规模工业化高密度发酵工艺,培养成本低廉,自身分泌的蛋白非常少,且可以分泌表达,十分有利于产物分离纯化[7]。同时,毕赤酵母表达系统还不存在原核表达系统的内毒素难以除去的问题,也不存在哺乳动物细胞表达系统的病毒和支原体污染等问题。本课题组前期已构建了毕赤酵母分泌型表达载体pPICZαC-hOSM,并获得了hOSM的高表达菌株[8]。在摇瓶规模发酵表达的基础上,本次研究进一步利用80L发酵罐对hOSM工程菌进行发酵,并对其发酵条件进行优化,为OSM的产业化生产及未来临床应用奠定物质基础。
1 材料与方法
1.1 菌株、主要试剂及仪器
巴斯德毕赤酵母hOSM菌株(PichiapastorisX33/Mut+)由本室构建并保存。YPD、BMGY、BMMY、FM21和PTM1培养基均采用Invitrogen公司提供的配方配制;蛋白质相对分子质量Marker(低)购自TaKaRa公司;Bioflo 5000发酵罐购自NewBrunswick Scientific公司;恒温摇床购自Forma Scientific公司;凝胶分析系统购自Pharmacia公司;发酵用其他试剂均为北京化学试剂厂产品。
1.2 毕赤酵母表达hOSM的pH值优化
选取表达量最高的酵母菌株,分别在pH 2.5~6.5的范围内以0.5个单位为间隔进行培养基pH值的优化实验。将选取菌株,于10mL YPD培养基中30℃、250r·min-1振荡培养24h。分别取BMGY 8mL,加入1mL由1mol·L-1Na2HPO4和0.5mol·L-1柠檬酸配制成不同pH值的缓冲液,混匀后各加入1mL YPD培养的工程菌菌液,30℃、250r·min-1振荡培养30h,使其光密度(A)600=5。室温3 000r·min-1离心5min,弃上清,沉淀中各加入BMMY 8mL,再加入1mL不同pH值的上述缓冲液,30℃、250r·min-1振荡培养,每24h补充1次甲醇至终浓度0.5%,同时补充灭菌去离子水,使发酵液总体积保持不变,诱导168h。分别取不同pH值的发酵液各0.5mL,离心取上清,进行SDS-PAGE分析。
1.3 种子液培养
将冻存的hOSM工程菌在YPD琼脂板上(含zeocin 100mg·L-1)30℃划线培养。至菌落长至约2mm,挑取单克隆菌落加入到10mL YPD培养液中,30℃、250r·min-1振荡培养24h。将上述培养物加入到2LYPD培养液中,30℃、250r·min-1振荡培养24h,至A600=10。
1.4 酵母细胞生物量的积累
配制40LFM21培养基,加入80L发酵罐中,121℃、30min高压灭菌。待发酵罐内培养基冷却到28℃,用氨水调节FM21培养基pH值至5.0,加入48mL PTM1和18mL生物素贮备液。将2LYPD种子液倒入发酵罐中开始培养,此为第1阶段即甘油培养扩增菌体,发酵罐参数为:搅拌速度600r·min-1,罐内压力10P,温度28℃,控制方式均为P-I-D,维持溶解氧值(DO)在25%~30%,必要时通入纯氧。24h后DO值上升至接近100%时,按每升培养基加入12mL PTM1的比例在高压灭菌后的50%甘油中加入PTM1,混匀后以18.2mL·h-1·L-1初始发酵液的速率泵入发酵罐中,至菌体湿重达190g·L-1。停止补加甘油后,待DO值上升至接近100%后,继续维持“甘油饥饿”状态30min,转入甲醇诱导阶段。
1.5 甲醇补料诱导hOSM表达
调节pH至最适诱导pH值,按照12mL·L-1比例在甲醇中加入PTM1,混匀后以3.6mL·h-1·L-1初始发酵液的速率加入到发酵罐中诱导表达,维持此低速率3h,以使酵母适应以甲醇为唯一碳源的环境。DO值稳定后,甲醇的速率升为7.2mL·h-1·L-1初始发酵液,以此速率维持2h。之后提高补加甲醇的速率至10mL·h-1·L-1初始发酵液,同时检测DO值和发酵液温度,并判断甲醇是否过量。若碳源受限,则加快补加甲醇的速率;若甲醇过量,则减慢补加甲醇的速率,直至合适的速度。甲醇诱导表达阶段,每隔6h取样1次,分析酵母菌生长状态。甲醇诱导表达60h后结束发酵。
1.6 菌体光密度值分析
发酵液适当稀释后于可见光波长600nm,以去离子水为对照进行比色测定,A600=读值×稀释倍数。
1.7 菌体湿重分析
取发酵不同时期的发酵液1mL,13 000r·min-1离心5min,去上清,称量质量。
1.8 hOSM分析
取发酵不同时期的发酵液0.5mL进行SDS-PAGE分析,采用Band Scan软件对凝胶图片进行光密度分析,显示其纯度,并用Bradford法对蛋白进行精确定量。
2 结 果
2.1 试管水平表达hOSM的最佳pH值
在相对分子质量约为28 000处可见hOSM表达,pH在5.5~6.0时表达效果最好,而pH值低于3.0时几乎无hOSM的表达(图1)。
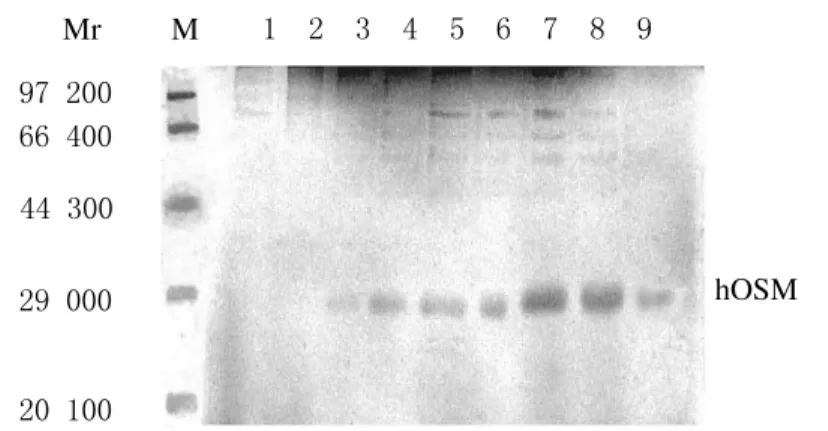
图1 不同pH条件下rhOSM发酵上清SDS-PAGE分析Fig.1 SDS-PAGE analysis of rhOSM fermentation supernatant at different pH values
2.2 hOSM发酵条件优化
2.2.1 hOSM发酵液pH值和甲醇诱导时间的确定 pH值5.5时,添加甲醇即有hOSM的表达,随着发酵时间的延长目的蛋白表达量逐渐升高,至甲醇诱导36h表达量达到高峰,此后继续发酵则发酵液中hOSM表达量不仅未增加,反而明显下降;pH值4.5时,甲醇诱导42h表达量才达到高峰,比pH 5.5条件下高峰出现延迟,且高峰时hOSM表达量也没有pH 5.5条件下甲醇诱导36h时多;pH值6.5时,hOSM表达量明显低于其他pH条件,且杂蛋白增加明显。据此,确定hOSM发酵最佳pH条件为5.5,甲醇诱导时间为36h,hOSM表达量占总蛋白量28%,产量可达280mg·L-1。见图2~4。
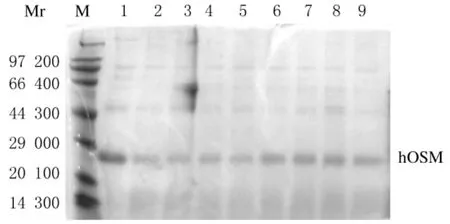
图2 pH 4.5条件下rhOSM发酵上清SDS-PAGE分析Fig.2 SDS-PAGE analysis of rhOSM fermentation supernatant at pH 4.5

图3 pH 5.5条件下rhOSM发酵上清SDS-PAGE分析Fig.3 SDS-PAGE analysis of rhOSM fermentation supernatant at pH 5.5
2.2.2 hOSM发酵过程中A600和菌体湿重监测结果 甲醇诱导阶段,每隔6h取样监测A600和酵母细胞湿重。从图5可以看出菌体湿重和A600在整个发酵过程当中持续增长,18h之前酵母细胞生长相对缓慢。
2.2.3 温度对hOSM发酵产量的影响 巴斯德毕赤酵母的适宜生长温度为30℃,若温度高于32℃对毕赤酵母是致命的。本次研究发酵温度控制在28℃进行发酵取得了很好的效果。
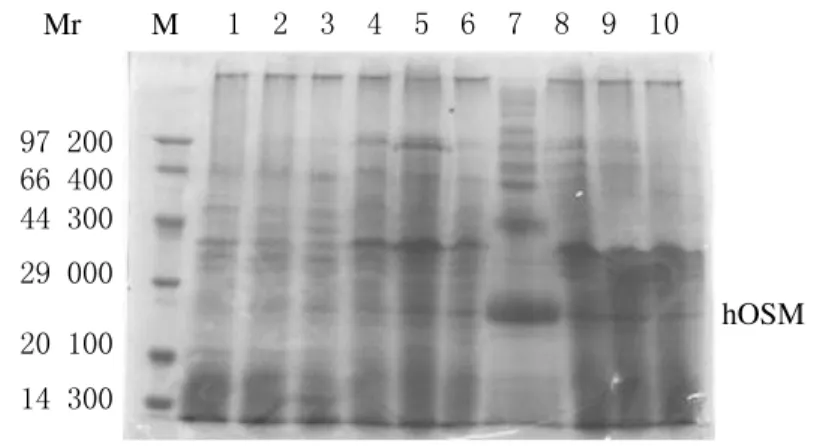
图4 pH 6.5条件下rhOSM发酵上清SDS-PAGE分析Fig.4 SDS-PAGE analysis of rhOSM fermentation supernatant at pH 6.5

图5 pH 5.5条件下rhOSM中试发酵酵母菌发酵液A600、菌体湿重和发酵上清中rhOSM表达产量的经时变化Fig.5 Profile of A600,wet weight,rhOSM production and time course during the methanol induction phase at pH 5.5
2.2.4 甲醇流加速度对hOSM发酵产量的影响对发酵表达hOSM而言,在甲醇流加速度为3.6mL·h-1·L-1时目的蛋白的表达量很少,当甲醇的流加速度增加至7.2mL·h-1·L-1时,目的蛋白的表达量仍旧很低,本研究保持发酵液中甲醇浓度在0.5%~1.0%,甲醇最终的流加速度达到9.3mL·h-1·L-1初始发酵液体积时,hOSM的表达量达到280mg·L-1。
3 讨 论
毕赤酵母在分泌表达外源蛋白的时候,培养基的pH条件对外源基因的表达至关重要,尤其在大规模发酵菌体高密度培养时更加突出。培养基pH值不同往往引起酵母菌代谢过程的改变,使表达产物的比例和质量发生改变。确定适合的pH条件,既能提高目的蛋白的产量,又能抑制蛋白水解酶的活性,保持目的蛋白的稳定。本研究所用的培养基为无机盐类,pH过高易产生沉淀,同时为防止杂菌污染,在甘油扩增阶段培养基pH值设定为5.0,而在甲醇诱导表达阶段pH值恒定在5.5。
在诱导阶段,甲醇既作为毕赤酵母的碳源被摄取,又能作为诱导物诱导外源基因的表达。尽管在一定范围内外源蛋白的产量与甲醇的饲给量呈正相关,但是甲醇的添加速度并非越快越好,速度过慢,达到目的蛋白产量高峰所需的诱导时间长,表达量低;速度过快,同样会出现表达量减少,杂蛋白增加[9]。在诱导的早期,一般应从低浓度甲醇逐渐增加至高浓度来进行,甲醇过量会导致毕赤酵母的中毒,其在发酵液中的浓度不应高于2%。对发酵表达hOSM而言,采用补料批式发酵的方法,在菌体湿重达到190g·L-1时进行甲醇诱导,甲醇终流加速度设置为9.3mL·h-1·L-1初始发酵液体积,诱导36h,其表达量可达280mg·L-1。发酵过程中可同时监测A600和菌体湿重,这2个指标能良好地反映酵母菌的生长情况。酵母的培养温度一般为28~30℃,本室已先后利用该发酵罐表达了10余种重组蛋白[10-12],其最佳发酵温度均在28℃,而本研究对hOSM发酵温度设置为28℃,同样取得了理想结果。
本研究除对发酵液pH值、甲醇诱导时间、温度、甲醇流加速度等主要影响rhOSM发酵产量的因素进行优化之外,还对DO、培养基成分、消泡剂的使用等因素进行了实验,确定了在使用FM21培养基,转速为650r·min-1,通入空气的流量为2vvm,纯氧浓度为22%~30% (V/V),罐内压力为10P,DO值保持在25%左右,发酵后期适当使用消泡剂的条件下,即可维持hOSM工程菌的代谢需要。
据报道,OSM已在大肠杆菌、哺乳动物细胞、重组腺病毒载体[13]中进行表达,其中大肠杆菌中OSM 的表达量为2.3mg·L-1[5],COS-7细胞中OSM 的表达量约为0.2mg·L-1[6],其表达量远远低于本研究应用的毕赤酵母表达系统,通过40L规模的发酵而获得的280mg·L-1的产量,是其他表达体系产量的上百倍。这将为rhOSM产业化生产及进一步研究其生物学活性提供充足的物质基础。
[1]Heinrich PC,Behrmann I,Haan S,et al.Principles of interleukin (IL )-6-type cytokine signaling and its regulation [J].Biochem J,2003,374(Pt 1):1-20.
[2]Tanaka M,Miyajima A.Oncostatin M,a multifunctional cytokine [J].Rev Physiol Biochem Pharmacol,2003,149 (1):39-52.
[3]Brounais B,David E,Chipoy C,et al.Long term oncostatin M treatment induces an osteocyte-like differentiation on osteosarcoma and calvaria cells [J].Bone,2009,44 (5):830-839.
[4]Yamashita T,Honda M,Nio K,et al.Oncostatin M renders epithelial cell adhesion molecule-positive liver cancer stem cells sensitive to 5-fluorouracil by inducing hepatocytic differentiation [J].Cancer Res,2010,70 (11):4687-4697.
[5]Sporeno E,Barbato G,Graziani R,et al.Production and structural characterization of amino terminally histidine tagged human oncostatin M inE.coli[J].Cytokine,1994,6 (3):255-264.
[6]叶建新,盛伟华,马丽丽,等.hOSM在COS-7细胞中表达及对人375黑色素瘤细胞的生长抑制作用 [J].临床肿瘤学杂志,2006,11 (2):128-132.
[7]Krainer FW,Dietzsch C,Hajek T,et al.Recombinant protein expression in Pichia pastoris strains with an engineered methanol utilization pathway [J].Microb Cell Fact,2012,11 (1):22-35.
[8]孔 宁,牟旭鹏,韩 冬,等.人抑瘤素M在毕赤酵母中的高效分泌表达 [J].吉林大学学报:医学版,2008,34 (1):42-45.
[9]Dietzsch C,Spadiut O,Herwig C.A fast approach to determine a fed batch feeding profile for recombinantPichiapastorisstrains[J].Microbial cell factories,2011,10(1):85-94.
[10]Shen M,Wang Q,Mu X,et al.Expression,purification and characterization of recombinant human beta-amyloid 1-42inPichia pastoris[J].Protein Expr Purif,2009,63 (2):84-88.
[11]Su M,Xu T,Wang D,et al.Expression and purification of recombinant human apolipoprotein C-I inPichiapastoris[J].Protein Expr Purif,2011,78 (1):22-26.
[12]Mu X,Kong N,Chen W,et al.High-level expression,purification,and characterization of recombinant human basic fibroblast growth factor inPichiapastoris[J].Protein Expr Purif,2008,59 (2):282-288.
[13]胡朝全,孙诚谊,孙连生,等.重组腺病毒载体介导HOSM基因对肝癌细胞体外增殖的抑制作用 [J].世界华人消化杂志,2007,15 (7):737-740.
Fermentation conditions of human oncostatin M expressed inPichiapastorisand analysis of fermentation products
KONG Ning1,GAO Hai-cheng2,LIU Guo-min3,CHEN Yue1,ZHOU Yu-lai1,YAN Wei-qun1
(1.Department of Biomedical Materials,School of Pharmacy,Jilin University,Changchun 130021,China;2.Department of Clinical Pharmacy and Pharmacy Administration,School of Pharmacy,Jilin University,Changchun 130021,China;3.Department of Orthopedics,Second Hospital,Jilin University,Changchun 130021,China)
Objective To optimize the fermentation condition of large scale fermentation of human oncostatin M(hOSM)with engineering strain ofPichiapastoris.Methods The optimal pH condition of hOSM expressed in the methylotrophic yeastPichiapastorisX-33in tube-scale was determined and fermentation of hOSM was performed in an 80Lfermentor in a fed-batch mode for three times.The pH value,culture medium,dissolved oxygen,temperature,methanol feeding speed,initial biomass and etc were focused mainly.hOSM was analyzed by SDS-PAGE.Results In the FM21medium of pH 5.0,when a cell yield of 190g·L-1wet weight was achieved,methanol induction phase began.In the fermentation broth of pH 5.5,the temperature was controlled at 28℃,a stirring speed of up to 650r·min-1,the pressure of fermentor was 10P,dissolved oxygen above 25%and the supply speed of methanol was 9.3mL·h-1·L-1initial fermentation volume,after methanol induction for about 36h,the expression level of hOSM reached 280mg·L-1.Conclusion OSM is successfully obtained through genetic engineering for large scale production of hOSM for following biological functions.
oncostatin M;Pichiapastoris;fermentation
Q78
A
1671-587Ⅹ(2012)05-0943-05
2012-04-10
吉林省卫生厅科研基金资助课题 (3D511AJ83432)
孔 宁 (1979-),女,吉林省吉林市人,讲师,医学博士,主要从事医学生物工程研究。
颜炜群 (Tel:0431-85619715,E-mail:weiqunyan@jlu.edu.cn)
