脂肪干细胞源性神经干细胞克隆球的电镜观察
2012-06-14刘永明胡晓晴唐颖馨唐洲平
刘永明 胡晓晴 张 誉 唐颖馨 唐洲平
脂肪组织中存在多能干细胞,在体外可长期增殖,这类细胞被称为脂肪间充质干细胞,简称脂肪干细胞(adipose derived stem cells,ADSCs)。ADSCs以其获取容易、创伤小、具有多分化潜能及避免伦理学问题等优势逐渐获得研究者的青睐[1,2]。ADSCs具备向脂肪细胞、成骨细胞、软骨细胞、成肌细胞分化的潜能[3~6],最近有报道ADSCs还可诱导分化为神经干细胞,进而向神经细胞分化[7~10]。ADSCs向神经干细胞诱导分化的相关研究较多,神经干细胞的超微结构已有学者观察[11],但对ADSCs诱导分化而来的神经干细胞超微结构的观察却不多。本研究旨在采用透射电镜观察ADSCs源性神经干细胞克隆球的超微结构。
1 材料与方法
1.1 ADSCs体外分离、培养和鉴定[12]
雄性健康SD大鼠,2只/次,体重120~150 g,由同济医学院实验动物中心提供,许可证号为SYXK(鄂)2004-0007;实验过程中对动物的处置符合动物伦理学标准。将大鼠麻醉后断颈处死,置于75%乙醇中浸泡10 min后移入超净台。剪开腹股沟处的皮肤,暴露皮下脂肪组织,尽量避开血管,钝性分离脂肪组织,将所获得的脂肪组织用眼科剪反复剪碎,将剪碎后的脂肪组织移入离心管中,加入和剪碎的脂肪组织体积相等的0.1% Ⅰ型胶原酶(Gibco公司),在37℃恒温摇床振荡消化40 min,加入等体积基础培养液[含10%胎牛血清(Hyclone公司)的DMEM培养液(Hyclone公司)],中和消化液并稀释细胞,用吸管反复吹打混匀,室温下1100 r/min离心10 min,获得下层细胞沉淀物。加入基础培养液重悬细胞,室温下1100 r/min离心4 min,去上清,加入基础培养液重悬细胞,经200目滤网过滤细胞悬液后,接种至25 cm2培养瓶内,在饱和湿度、5%CO2、37℃标准环境下培养。以后每3 d全量换液1次,当细胞长满培养瓶底达到70%~80%时进行传代。
1.2 ADSCs分化成神经干细胞克隆球、鉴定及超微结构观察
1.2.1 ADSCs向神经干细胞克隆球的诱导培养[8]原代培养的ADSCs细胞,按5×105/L细胞浓度接种于25 cm2规格的培养瓶中,加入Neurobasal培养基(Gibco公司)、20 ng/ml碱性成纤维细胞生长因子(basic fibroblast growth factor,b FGF)(sigma公司),20 ng/ml表皮生长因子(epidermal growth factor,EGF)(sigma公司)、2%B27添加剂(Gibco公司),置于37℃、5%CO2培养箱中继续培养,每3~4 d添加上述3种因子,每7 d换液1次。培养5~7 d后可见细胞在培养液中增殖形成悬浮的神经球样细胞。当形成的神经球达到15~20个时,吸除一半培养基,机械法轻柔吹打神经球使之离散,再以Neurobasal培养基重悬细胞,按1∶3传代。
1.2.2 克隆球鉴定 取诱导培养第10 d的神经球,采用免疫荧光法鉴定。将培养着神经球的培养液室温下1500 r/min离心2 min,弃上液,加入2 ml neurobasal培养液重悬细胞,吹散,滴加到经多聚赖氨酸包被的6孔板中,沿侧壁向孔内加入1 ml neurobasal培养液,37℃、5%CO2培养箱中孵育24 h,让神经球贴壁。去掉6孔板中的培养液,PBS洗5 min×3次;4%多聚甲醛固定30 min,PBS洗5 min×3次;0.25%Trixton X-100(Biosharp公司)500 μl破膜20 min,PBS洗5 min×3次;胎牛血清白蛋白(Hyclone公司)封闭非特异性抗原,室温孵育1 h,PBS洗5 min×3次;吸掉残液,滴加兔抗大鼠nestin一抗(Sigma公司,1∶150稀释),4℃孵育过夜,PBS洗5 min×3次;滴加花青素3(Cyanine 3,Cy3)标记的羊抗兔二抗(Sigma公司,1∶50稀释),室温避光孵育1 h,PBS洗5 min×3次;50%甘油封片;荧光显微镜观察并拍照。
1.2.3 透射电镜观察 将悬浮的神经干细胞克隆球转入到大试管中,室温800 r/min离心10 min,将浓缩的细胞悬液转入1.5 ml EP管中,室温1500 r/min离心10 min,去除上清液,沿管壁缓慢加入1%戊二醛固定液(避免将细胞团打散),透射电子显微镜观察(同济医学院超微病理研究室)。
2 结 果
2.1 光镜下ADSCs及神经球形态
光学倒置显微镜下可观察到,培养24 h后大部分ADSCs开始贴壁生长,呈成纤维样细胞形态,见图1A。ADSCs经诱导培养5 d即见神经球样细胞出现,并逐渐增多,至10 d左右神经球样细胞数量达到稳定,继续培养至14 d左右开始出现变黑的神经球样细胞团,见图1B。

图1 在光学显微镜下ADSCs及ADSCs经诱导分化后形成的神经球样细胞团的形态 A为培养6 d后的ADSCs(×100倍);B为ADSCs经诱导培养10 d后出现的神经球样细胞团(×400倍)
2.2 神经球样细胞团鉴定
对ADSCs经诱导分化后形成的神经球样细胞团的免疫荧光鉴定显示,其Nestin染色阳性,见图2A-2C。

图2 荧光显微镜下免疫荧光染色显示神经球样细胞团Nestin表达阳性(×400倍)
2.3 电镜下神经球样细胞团形态
透射电镜下观察ADSCs经诱导分化后形成的神经干细胞克隆球,可见细胞间有增厚的细胞膜相连(图3A箭头所指),或通过一些连接结构相连(图3B箭头所指);单个细胞的胞体较小,细胞核较大,胞质较少,有多种细胞器(图3C)。
3 讨 论
ADSCs经Zuk等[12]报道后,近年来其研究获得了迅速的发展。ADSCs是从脂肪组织中分离出来的、具有多向分化潜能的成体干细胞。以往研究发现,ADSCs与临床上已广泛应用的骨髓间充质干细胞无论在形态、生长特性、分子表型及多向分化能力方面都具有很高的相似性。二者相比,ADSCs来源充足、取材容易、分离培养步骤简便、体外增殖能力强、没有伦理学问题,比骨髓间充质干细胞有更多的优点。这些特点决定了ADSCs在临床应用中拥有更广阔的前景。
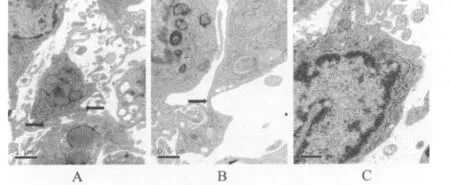
图3 透射电镜下ADSCs经诱导分化后形成的神经干细胞克隆球内细胞的形态(A为标尺=1μm;B和C为标尺=0.5 μm)
ADSCs向神经干细胞的诱导分化是目前相当前沿的一个研究领域,是对传统的神经细胞不可再生理论的挑战。传统观点认为,神经细胞不可再生,神经损害性疾病基本上无法修复。但近些年的研究却显 示,神 经 细 胞 并 非 不 可 再 生[10]。2000 年Woodbury等报道在含有二甲基亚砜(DMSO)和丁酸酯羟基茴香醚(BHA)或β-巯基乙醇的DMEM培养液中可将成年大鼠和成人的骨髓基质细胞定向诱导分化为神经细胞[13]。随后大量的研究也证实骨髓基质细胞可定向分化为神经元和神经胶质细胞[14~20]。因ADSCs和骨髓基质干细胞具有高度的相似性,研究者们推测ADSCs也具有分化为神经细胞的可能。Safford等2002年报道在一定的诱导条件下和一定的时间内人和大鼠的ADSCs分化的细胞具有神经细胞形态,免疫细胞化学检测证实分化的细胞分别表达巢蛋白(nestin)、胶质纤维酸性蛋白(glia fibrillary acidic protein,GFAP)、神经元核蛋白(vimentin)和神经元特异性烯醇化酶(neuron specific enolase,NSE),提示ADSCs经诱导分化可以表达神经细胞的表型[21]。本研究所采用的诱导方法源自Kang等的诱导方法[8],采用在Neurobasal培养基中加入20 ng/ml b FGF、20 ng/ml EGF、2%B27,经过5 d左右的诱导分化即可出现神经球样细胞团,10 d左右神经球细胞团数量达到稳定,经免疫荧光染色鉴定显示Nestin阳性,提示ADSCs经过诱导分化后可以表达神经干细胞的表型。
关于ADSCs向神经干细胞的诱导分化目前已有一些研究报道[22,23],但对于 ADSCs诱导分化后形成的神经球样细胞团的超微结构的研究却很少,本研究即采用透射电镜,对其超微结构进行研究。本研究结果显示,由ADSCs诱导分化而来的神经球样细胞团的超微结构和原代培养的神经球的超微电镜结构相似[11],都表现为大部分细胞的胞体较小,胞核较大,胞质少且透明,有微管、微丝、线粒体、高尔基体、糖原等细胞器;部分神经球内的细胞之间可看到多种形态的连接样结构。就单一神经球而言,未观察到突触形成,推测突触一般只在神经组织中存在,而单一的细胞团之间很难出现典型的突触结构。另外,神经干细胞本身的突触结构也不明显。
本研究结果进一步证实ADSCs有向神经干细胞诱导分化的可能。此外,本研究创新性地采用透射电镜,对ADSCs源性的神经干细胞团的超微结构形态特征进行了观察,并与原代培养获得的神经干细胞形态进行比较,发现二者具有相当程度的相似性。ADSCs研究的迅猛发展无疑会推动神经内科疾病治疗方法多样性的发展,为临床工作提供更多的帮助。
1 Gottlieb DI.Large-scale sources of neural stem cells.Annu Rev Neurosci,2002,25(期):381-407.
2 Lenoir N.Europe confronts the embryonic stem cell research challenge.Science,2000,287(5457):1425-1427.
3 Sen A,Lea-Currie YR,Sujkowska D,et al.Adipogenic potential of human adipose derived stromal cells from multiple donors is heterogeneous.J Cell Biochem,2001,81(2):312-319.
4 Cowan CM,Shi YY,Aalami OO,et al.Adipose-derived adult stromal cells heal critical-size mouse calvarial detects.Nat Biotechnol,2004,22(5):560-567.
5 Award HA,Halvorsen YD,Gimble JM,et al.Effects of transforming growth factor betal and dexamethasone on the growth and chondrogenic differentiation of adipose-derived stromal cells.Tissue Eng,2003,9(6):1301-1312.
6 Bacou F,Andalousi RB,Daussin PA,et al.Transplantation of adipose tissue-derived stromal cells increases mass and functional capacity of damaged skeletal muscle.Cell Transplant,2004,13(2):103-111.
7 Fujimura J,Ogawa R,Mizuno H,et al.Neural differentiation of adipose-derived stem cells isolated from GFP transgenix mice.Biochem Biophys Res Commun,2005,333(1):116-121.
8 Kang SK,Putnam LA,Ylostalo J,et al.Neurogenesis of rhesus adipose stromal cells.J Cell Sci,2004,117(18):4289-4299.
9 Bunnell BA,Iostalo JY,Kang SK.Common transcriptional gene profile in neurospheres-derived from p ATSCs,pBMSCs,and p NSCs.Biochem Biophys Res Commun,2006,343(3):762-771.
10 周虎田,徐如祥,姜晓丹.脂肪干细胞向神经细胞分化的研究现状.中华神经医学杂志,2005,4(3):309-311.
11 徐汉鹏,卢春荣,苟 琳,等.体外神经干细胞克隆球的超微结构-透射电镜观察.细胞生物学杂志,2002,24(4):251-253.
12 Zuk PA,Zhu M,Ashjian P,et al.Human adipose tissue is a source of muhipotent stem cells.Mol Biol Cell,2002,13(12):4279-4295.
13 Woodbury D,Schwarz EJ,Prockop DJ,et al.Adult rat and human bone marrow stromal cells differentiate into neurons.J Neurosci Res,2000,61(4):364-370.
14 Wislet-Gendebjen S,Leprince P,Moonen G,et al.Regulation of neural markers nestin and GFAP expression by cultivated bone marrow stromal cells.J Cell Sci,2003,116(pt16):3295-3302.
15 Alberti-Amador E,Garcia-Miniet R.Bone marrow stromal cells.An alternative source of restorative therapy in degenerative diseases of the central nervous system.Rev Neurol,2003,37(8):752-758.
16 Chen JR,Xu RX,Jiang XD,et al.Induced differentiation of rabbit bone marrow stromal cells into neuron-like cells.Di Yi Jun Yi Da Xue Xue Bao,2004,24(4):367-370.
17 Dezawa M,Kanno H,Hoshino M,et al.Specific Induction of neuronal cells from bone marrow stromal cells and application for autologous transplantation.J Clin invest,2004,113(12):1701-1710.
18 Hermann A,Gastl R,Liebau S,et al.Efficient generation of neural stem cell-like cells from adult human bone marrow stromal cells.J Cell Sci,2004,117(pt19):4411-4422.
19 Huang W,Zhang C,Chen SL,et al.Brain derived neurotrophic factor induces rat bone marrow stromal cells to differentiatiate into neuron-like cells in vitro.Di YI Jun Yi Da Xue Xue Bao,2004,24(8):854-858.
20 Scintu F,Reali C,Pillai R,et al.Differentiation of human bone marrow stem cells into cells with a neural phenotype:diverse effects of two specific treatments.BMC Neurosci,2006,16(7):14
21 Safford KM,Hicok KC,Safford SD,et al.Neurogenic differentiation of murine and human adipose-derived stromal cells.Biochem Biophys Res Commun,2002,294(2):371-379.
22 Yang LY,Liu XM,Sun B,et al.Adipose tissue-derived stromal cells express neuronal phenotypes.Chin Med J(Engl),2004,117(3):425-429.
23 Fang Z,Yang Q,Xiong W,et al.Neurogenic differentiation of murine adipose derived stem cells transfected with EGFP in vitro.J HuaZhong Univ Sci Technog Med Sci,2010,30(1):75-80.
24 Zuk PA,Zhu M,Mizuno H,et al.Multilineage cells from human adipose tissue:Implication for cell-based therapies.Tissue Eng,2001,7(2):211-218.
