溶血磷脂酸对小胶质细胞炎性分泌的影响
2012-06-14付佩彩喻志源唐荣华
付佩彩 喻志源 刘 淼 唐荣华 王 伟 骆 翔
小胶质细胞约占成年中枢神经系统细胞总量的10%-20%[1]。它是CNS原位免疫细胞,属于单核细胞系,介导中枢神经系统对感染、损伤等疾病的先天性免疫反应[2]。在CNS受损后小胶质细胞迅速激活,迁移至受损部位,并发生一系列特征性反应,如细胞增殖、形态改变、炎性因子分泌等[3]。LPA为类生长因子的脂类信号分子,与CNS损伤密切相关,它即是反应CNS受损程度的预警因子,也可作为致病因子促进CNS进一步损伤[4,5]。本研究采用LPA对小胶质细胞系BV2细胞进行干预,检测BV2细胞活化分泌IL-1β和TNF-α的浓度变化,以探讨LPA在CNS损伤中对小胶质细胞活化以及炎性因子分泌中的作用。
1 方法与材料
1.1 材料与试剂
BV2细胞系来自华中科技大同济医学院。DMEM/高糖培养基、胎牛血清均购自美国Hyclone公司;胰蛋白酶购自美国GIBCO公司;多聚赖氨酸、LPA(溶血磷脂酸)和DAPI均购自美国sigma公司;LDH试剂盒购自南京建成生物研究所;ELISA试剂盒购自深圳达科为生物技术有限公司;小鼠抗Iba1购自美国Wako公司;CY3标记羊抗兔IgG购自美国Jackson公司。
1.2 BV2细胞复苏及传代培养
液氮冻存的BV2细胞,37°C迅速复苏后用含10%胎牛血清的DMEM/高糖培养基进行培养,当细胞达到90%融合时用0.25%胰酶消化细胞,进行传代。
1.3 实验分组
调整BV2细胞悬液中细胞密度为1×106/ml,接种于多聚懒氨酸(0.1 mg/ml)包被过的6孔板中,于37°C 5%CO2培养箱中进行培养,24 h应用于实验。其中对照组在实验开始时换用新鲜培养基,LPA组换用含10μM LPA的新鲜培养基。
1.4 LDH法检测细胞培养基中LDH浓度
LDH法检测10μM LPA作用于BV2细胞后培养基内LDH含量,以检测LPA对BV2细胞毒性作用。严格按照试剂盒说明书要求操作,反应结束室温5 min后用450 nm波长测定各孔吸光度。绘制标准曲线,依据标准曲线计算各孔相应的LDH浓度。
1.5 ELISA法检测细胞培养基中IL-1β和TNF-α浓度
ELISA法测定IL-1β和TNF-α浓度,操作严格按照试剂盒说明书要求进行。终止反应10分钟内用检测波长450 nm,参考610 nm波长测定各孔吸光度。绘制标准曲线,依据标准曲线计算各孔相应的IL-1β和 TNF-α浓度。
1.6 统计学处理
所得数据用均数±标准差表示,组间比较采用t检验,应用SPSS软件,P<0.05认为差异有统计学意义。用sigma plot作图软件作图。
2 结 果
2.1 BV2细胞Iba1免疫荧光染色鉴定
传代培养的BV2在培养24 h后贴壁细胞呈梭形,至第2~3 d BV2细胞生长呈90%融合,突起明显增多延长。将BV2细胞做Iba1免疫荧光染色,证明传代培养的BV2细胞表达小胶质细胞特异性抗原Iba1(图1)。
2.2 BV2细胞分泌LDH的浓度变化
对照组和LPA组在各时间点(30min、1、3和6 h)的LDH分泌均无明显差异(图2)。
2.3 BV2细胞分泌IL-1β和TNF-α的浓度变化
LPA干预BV2细胞后1 hIL-1β和TNF-α较对照组显著增加(P<0.01)。IL-1β分泌在3 h达到峰值,而TNF-α分泌在6 h内持续增高。与对照组比较,IL-1β和TNF-α均在3 h增加最显著(P<0.01)(图3、4)。

图1 BV2细胞的小胶质细胞特性鉴定 培养的BV2细胞100%表达小胶质细胞特异性抗原Iba1;红色为Iba1染色阳性,蓝色为细胞核DAPI染色
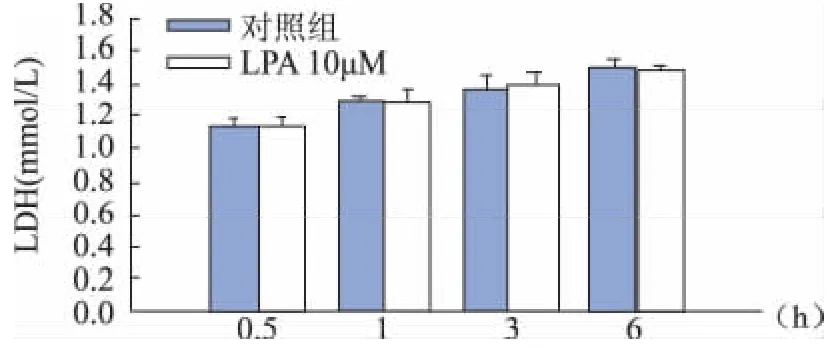
图2 各组分泌LDH浓度
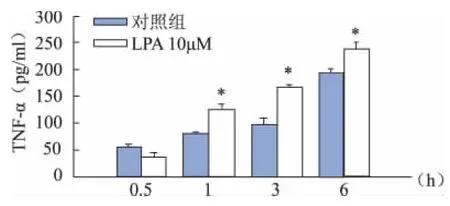
图3 各组BV2细胞培养液中TNF-α的浓度(与同时间点对照组比较,*P<0.01)
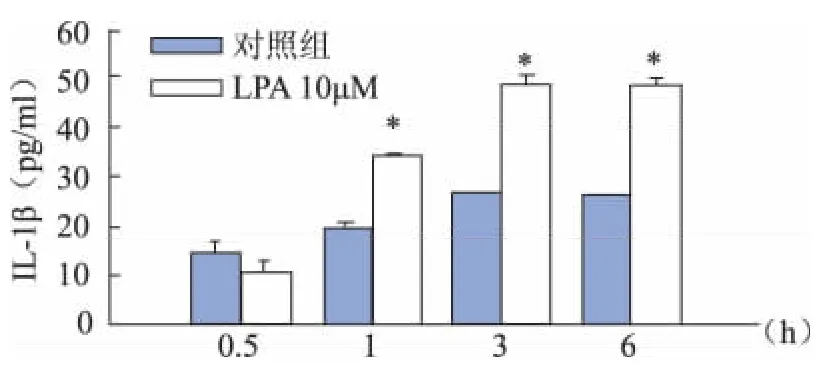
图4 各组BV2细胞培养液中IL-1β的浓度(与同时间点对照组比较,*P<0.01)
3 讨 论
小胶质细胞为CNS定居的免疫细胞,是CNS损伤后最早发生反应的细胞类型[6]。活化的小胶质细胞可通过吞噬死亡细胞碎片、限制炎症病灶扩大[7]、形成胞突包绕神经轴突末梢、分泌小胶质细胞源性神经营养因子等作用对CNS损伤起到保护作用。但过度活化的小胶质细胞亦可导致神经损伤,CNS缺血区域的神经细胞可通过 ATP、CCL2/CCR2趋化因子受体途径以及组织蛋白酶S/CX3CL1途径激活小胶质细胞,诱导小胶质细胞产生炎性反应,分泌各种炎症因子(TNF-α,IL-6,IL-1β)进而加重受损神经元的损伤[8~10]。虽然关于小胶质细胞炎性因子释放的研究众多,但其炎性释放机制仍未明确。
LPA是血清中的正常组分之一,血小板、炎症细胞、神经细胞、损伤细胞和内皮细胞受到各种刺激后均可生成,通过内分泌和旁/自分泌的方式释放。在CNS受损后LPA的分泌增加并可促进CNS系统进一步损伤,但其机制未明确[4,5]。本研究结果发现LPA可显著促进小胶质细胞系BV2细胞的活化,并促进其分泌IL-1β和TNF-α(P<0.01),在3 h其促进作用最为显著。已知的LPA可通过G12/13蛋白激活Rho/ROCK信号通路[11],LPA可通过激活Rho后发挥细胞骨架重建、肌动蛋白应力纤维重建、细胞分化等作用。并有研究显示抑制Rho/ROCK通路、可明显抑制小胶质细胞炎性因子(TNF-α、IL-6、IL-1β)释放[12]。因此,本研究推测LPA促进小胶质细胞炎性分泌可能为激活Rho/ROCK通路所致。
综上所述,本研究结果提示LPA在小胶质细胞活化及其炎性分泌中发挥了重要作用;LPA促进小胶质细胞炎性因子分泌可能为其促进CNS损伤的原因之一,也为进一步了解CNS损伤后LPA的作用、小胶质细胞的活化机制及其调控方法提供了实验依据。
1 Lawson LJ,Perry VH,Dri P,et al.Heterogeneity in the distribution and morphology of microglia in the normal adult mouse brain.Neuroscience,1990,39(1):151-170.
2 Streit WJ,Conde JR,Fendrick SE,et al.Role of microglia in the central nervous system's immune response.Neurol Res,2005,27(7):685-691.
3 Haynes SE.The P2Y12 receptor regulates microglia activation by extracellular nucleotides.Nature Neurosci,2006,9(12):1512-1519.
4 Siess W.Athero-and thrombogenic actions of lysophosphatidic acid and sphingosine-1-Phospate.Biochim Biophys Aeta,2002,1582(13):204-215.
5 Siess W,Tigyi G.Thrombogenic and atherogenie activities of lysophosphatidic acid.J Cell Bioehem,2004,92(6):1086-1094.
6 Hanisch UK,Kettenmann H.Microglia:active sensor and versatile effector cells in the normal and pathologic brain.Nat Neurosci,2007,10(11):1387-1394.
7 Davalos D.ATP mediates rapid microglia response to local brain injury in vivo.Nature Neurosci,2005,8(6):752-758.
8 Gonzalez R,Glaser J,Liu MT,et al.Reducing inflammation decreases secondary degeneration and functional deficit after spinal cord injury.Exp Neurol,2003,184(1):456-463.
9 Pan W,Kastin AJ.Cytokine transport across the injured bloodspinal cord barrier.Curr Pharm Des,2008,14(16):1620-1624.
10 Sharma HS.Pathophysiology of blood-spinal cord barrier in traumatic injury and repair.Curr Pharm Des,2005,11 (11):1353-1389.
11 Kyoko Noguchi,Deron Herr,Tetsuji Mutoh.Lysophosphatidic acid(LPA)and its receptors.Neurosciences,2009,9(1):15-23.
12 Jing Ding,Qin-Ying Li,Xin Wang,et al.Fasudil protects hippocampal neurons against hypoxia-reoxygenation injury by suppressing microglial inflammatory responses in mice.Journal of Neurochemistry,2010,114(6):1619-1629.
