降解多聚半乳糖醛酸菌株的诱变
2012-06-11朱雄伟苏腾甲
朱雄伟,熊 瑶,苏腾甲
(武汉工程大学化工与制药学院,绿色化工过程省部共建教育部重点实验室,湖北 武汉 430074)
0 引 言
半乳糖醛酸是植物细胞间质中纤维素、半纤维素、木质素和多聚半乳糖醛酸的组成成分,是多糖类的物质,以多聚体的形式存在于纤维素、半纤维素木质素和多聚半乳糖醛酸中.而纤维素、半纤维素、木质素、多聚半乳糖醛酸是难降解的物质[1-2].在造纸废水和食品工业废水中,它们的存在对废水的处理增加了很大的难度,如果降解了它们组成中的多聚半乳糖醛酸,对降解废水中这些难降解物质就非常有利.
笔者从含纤维素、半纤维素、木质素的废水池和食品工业的废水池中筛选分离得到一株能有效降解多聚半乳糖醛酸的菌株.经过前期研究,在食品工业废水中筛选的菌株降解能力强,并在以上两种废水环境生存能力强,以此菌株为研究菌株,通过16S rRNA的鉴定,此菌株属细菌类,初步命名为HDYM-02.为了进一步提高菌株降解多聚半乳糖醛酸的能力,我们对其作进一步诱变处理,虽然诱变育种方法产生的是不定向变异,但诱变结果相对于单纯的纯培养选育均有较大的突变率.菌株通过合适的诱变,能更好地选育出产降解能力更强、菌株性质更稳定、针对性更强的新菌株[3].本研究通过三种诱变剂(硫酸二乙酯、叠氮钠、马来酰肼)和紫外线对此菌株进行诱变,从诱变菌株中进行筛选,选育出更好的菌株.
1 实验部分
1.1 材 料
1.1.1 菌株及保存条件 以从食品工业废水池中筛选的具有降解多聚半乳糖醛酸菌株HDYM-02为研究菌株,在琼脂斜面保藏培养基上传代,4 ℃保存备用.
1.1.2 试剂与仪器 0.1%的刚果红染色试剂;DNS试剂; 0.85%生理盐水;pH 7.0磷酸缓冲液;多聚半乳糖醛酸(美国Sigma公司生产);硫酸二乙酯;叠氮钠;马来酰肼;紫外灯;红外灯;电子天平;2001 型振荡愠温培养箱;水平离心机;立式压力蒸汽灭菌锅;岛津紫外UV-1800分光光度计.
1.1.3 培养基 固体培养基:多聚半乳糖醛酸0.5%(为质量分数,下同),蛋白胨1%,氯化钠0.5%,琼脂2%;液体培养基:多聚半乳糖醛酸0.5%,蛋白胨1%,氯化钠0.5%;多聚半乳糖醛酸琼脂培养基:多聚半乳糖醛酸0.2%,琼脂2%.
1.2 方 法
1.2.1 菌体收集 将多聚半乳糖醛酸酶生产菌株HDYM-02,在固体培养基上于35 ℃培养12 h,待菌落长出后接入液体培养基,35 ℃下 120 r/min摇床培养48 h.将菌体培养液3 500 r/min离心15 min收集菌体,pH 7.0的磷酸缓冲溶液洗涤离心三次,备用.
1.2.2 诱变方法[4]a. 硫酸二乙酯诱变:取3份菌悬液分别标记I、II、III,各加入质量分数1%硫酸二乙酯溶液0.2 mL,I号诱变处理60 min,II号诱变处理30 min,III号诱变处理10 min.诱变结束后立即使用pH 7.0磷酸缓冲溶液稀释、并离心洗涤三次.稀释后涂布到固体培养基上,35 ℃恒温培养48 h.
b. 叠氮钠诱变:取3份菌悬液分别编号为IV、V、VI,各加入质量分数0.3%叠氮钠溶液0.2 mL,IV号诱变处理60 min,V号诱变处理30 min,VI号诱变处理10 min.诱变结束后立即使用pH 7.0磷酸缓冲溶液稀释、并离心洗涤三次.稀释后涂布到固体培养基上,35 ℃恒温培养48 h.
c. 马来酰肼诱变:取3份菌悬液分别编号为VII、VIII、IX,各加入质量分数0.6%马来酰肼溶液0.2 mL,VII号诱变处理60 min,VIII号诱变处理30 min,IX号诱变处理10 min.诱变结束后立即使用pH 7.0磷酸缓冲溶液稀释、并离心洗涤三次.稀释后涂布到固体培养基上,35 ℃恒温培养48 h.
d. 紫外诱变[5]:取3份菌悬液分别编号为X、XI、XII,将菌悬液置于培养皿中培养,X、XI、XII号培养皿放置在磁力搅拌器载物台上,先开启紫外灯(18 W,距离24 cm)预热30 min,然后开启搅拌器,打开皿盖开启紫外灯照射,X号处理0 s,XI号处理30 s,XII号处理60 s.稀释后涂布到固体培养基上,35 ℃恒温培养48 h,整个操作需要红光下进行.
1.2.3 突变菌株的筛选a. 刚果红染色法筛选:多聚半乳糖醛酸酶产生菌诱变育种的筛选方法很多,报道较多的是透明区带法.本研究使用的是刚果红染色法.将经过紫外及三种化学诱变剂(硫酸二乙酯、叠氮钠、马来酰肼)诱变得到的菌株分别置于固体培养基中培养,并将培养皿编号I、II、III、IV、V、VI、VII、VIII、IX、X、XI、XII,35 ℃恒温培养12 h,待菌落长出后,于其上铺多聚半乳糖醛酸琼脂培养基,继续培养6 h,然后用质量分数0.1%的刚果红染色15 min,用生理盐水冲洗至无红色水流出,放于冰箱中过夜.次日观察,有多聚半乳糖醛酸分解能力的菌落周围出现清晰的透明圈.用游标卡尺测量透明圈直径(H)以及菌落的直径(C),计算H/C值.计算出上述12个平板中的H/C值,比值大的说明多聚半乳糖醛酸分解能力强.
b. 降解能力的测定:本研究测定降解半乳糖醛酸能力的方法是DNS比色法,是一种比较简单易行的方法.多聚半乳糖醛酸彻底水解后变为半乳糖醛酸;半乳糖醛酸可与DNS试剂在一定条件下发生颜色反应.反应的结果可以用分光光度计在540 nm波长处检测出来,据此可得出菌株降解多聚半乳糖醛酸的能力.取适量发酵液置于15 mL离心管中,5 000 r/min离心15 min,提取上清液.质量分数1%多聚半乳糖醛酸溶液1.0 mL,50 ℃预热3 min,加上清液0.2 mL混合,50 ℃水解10 min,加DNS试剂3 mL,混合后于沸水浴中10 min,冷却定溶15 mL.并用等量的煮沸过的上清液0.2 mL空白调零,540 nm下测定吸光度值[6].
2 结果与分析
2.1 硫酸二乙酯诱变处理
2.1.1 刚果红染色法筛选[7]将硫酸二乙酯诱变得的菌株I、II、III,对菌株进行刚果红染色,得到菌株I、II、III的H/C.如表1所示.
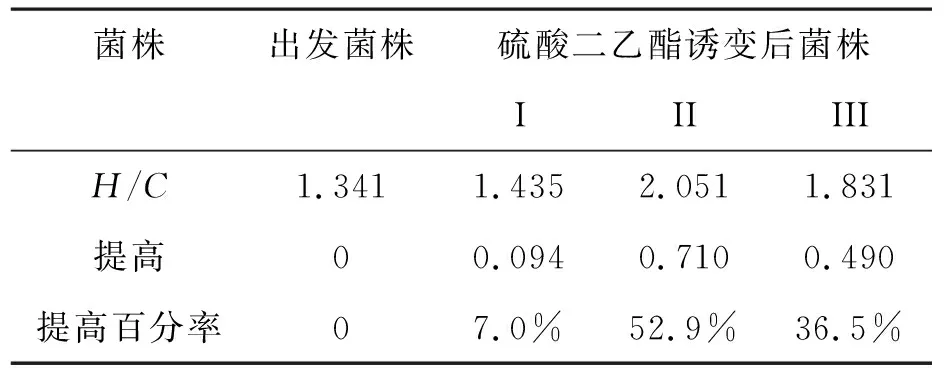
表1 硫酸二乙酯诱变菌株的H/C值Table 1 H/C value of strains by ethyl methanessulfonate mutation
由表1可知,菌株I、II、III的H/C值都有所增加,提高最大的是菌株II,提高百分率可达52.9%.
2.1.2 硫酸二乙酯诱变菌株降解能力的测定 将硫酸二乙酯诱变得的菌株I、II、III[8],分别测定菌株I、II、III降解能力的相对值.如表2所示.

表2 硫酸二乙酯诱变菌株降解能力Table 2 Degradation ability of strains by ethyl methanessulfonate mutation
由表2可知,菌株II、III的酶活力都有所增加,提高最大的是菌株II,此菌株的降解能力是出发菌株的1.39倍.
2.2 叠氮钠诱变处理
2.2.1 刚果红染色法筛选 将叠氮钠诱变得的菌株IV、V、VI,对菌株进行刚果红染色[9],得到菌株IV、V、VI的H/C.如表3所示.
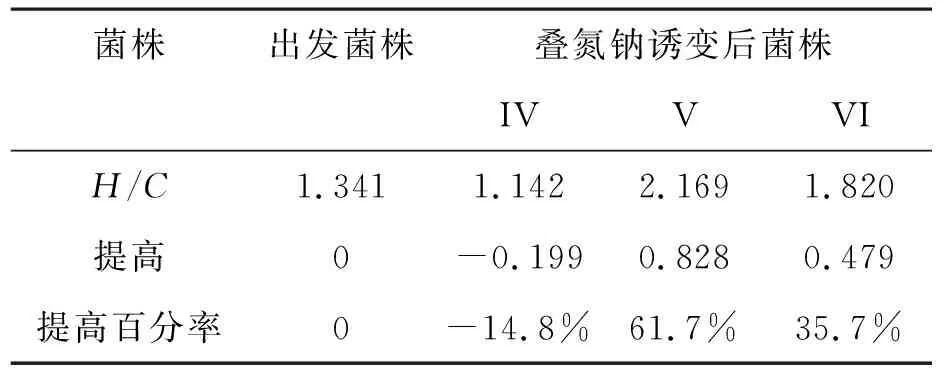
表3 叠氮钠诱变菌株的H/C值Table 3 H/C value of strains by sodium azide mutation
由表3可知,菌株V、VI的H/C值都有所增加,提高最大的是菌株V,提高百分率可达61.7%.
2.2.2 叠氮钠诱变菌株降解能力的测定 将叠氮钠诱变得的菌株IV、V、VI[10],分别测定菌株IV、V、VI降解能力的相对值.如表4所示.

表4 叠氮钠诱变菌株降解能力Table 4 Degradation ability of strains by sodium azide mutation
由表4可知,菌株V、VI的降解能力都有所增加,提高最大的是菌株V,此菌株的降解能力是出发菌株的1.60倍.
2.3 马来酰肼诱变处理
2.3.1 刚果红染色法筛选 将马来酰肼诱变得的菌株VII、VIII、IX[11],对菌株进行刚果红染色,得到菌株VII、VIII、IX的H/C.如表5所示.
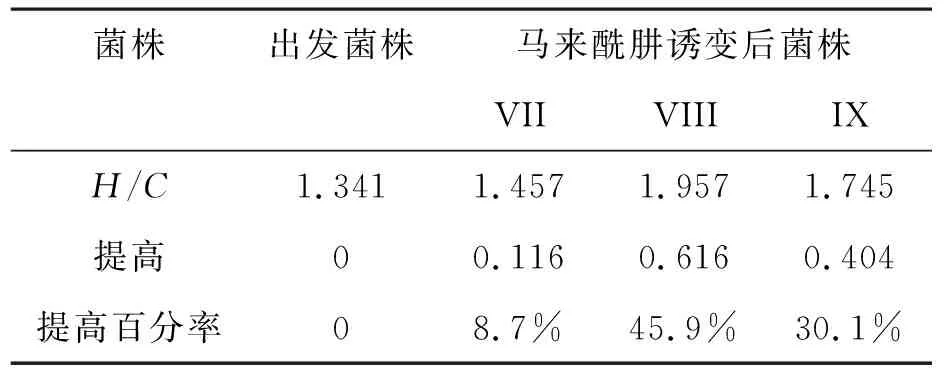
表5 马来酰肼诱变菌株的H/C值Table 5 H/C value of strains by maleic hydrazide mutation
由表5可知,菌株VII、VIII、IX的H/C值都有所增加,提高最大的是菌株VIII,提高百分率可达45.9%.
2.3.2 马来酰肼诱变菌株降解能力的测定 将马来酰肼诱变得的菌株VII、VIII、IX[12],分别测定菌株VII、VIII、IX降解能力的相对值.如表6所示.

表6 马来酰肼诱变菌株降解能力Table 6 Degradation ability of strains by maleic hydrazide mutation
由表6可知,菌株VIII、IX的降解能力都有所增加,提高最大的是菌株VIII,此菌株的降解能力是出发菌株的1.24倍.
2.4 紫外诱变处理
2.4.1 刚果红染色法筛选 紫外诱变得的菌X、XI、XII[13],对菌株进行刚果红染色,得到菌株X、XI、XII的H/C.如表7所示.
由表7可知,由于菌株X紫外诱变的时间为0 s,相当于没有诱变,故其与出发菌株相同.菌株XI、XII的H/C值都有所增加,提高最大的是菌株XII,提高百分率可达37.7%.
2.4.2 紫外诱变菌株降解能力的测定 将紫外诱变得的菌株X、XI、XII,分别测定菌株X、XI、XII降解能力的相对值.如表8所示.

表8 紫外诱变菌株降解能力Table 8 Degradation ability of strains by ultraviolet light mutation
由表8可知,菌株XI、XII的降解能力都有所增加,提高最大的是菌株XII,此菌株的降解能力是出发菌株的1.33倍.
3 结 语
本研究使用三种化学诱变剂(硫酸二乙酯、叠氮钠、马来酰肼)及紫外对分离筛选得到的降解多聚半乳糖醛酸生产菌株HDYM-02进行诱变,得到多个诱变菌株,并使用刚果红染色法筛选诱变菌株,测定它们的降解能力[14-15].结果表明,出发菌株经过叠氮钠诱变30 min时,诱变得到的菌株降解能力最高,是出发菌株酶活力的1.66倍,诱变得到的菌株降解效率高,符合人们的生产需要.
参考文献:
[1] 张树政.酶制剂工业[M]. 下册.北京:科学出版社,1984:233-236.
[2] 李拖平,李苏红.山楂果胶中多聚半乳糖醛酸多糖的化学构造特征[J].食品科学,2008,29(10): 37-40.
[3] 董章勇,王振中.真菌多聚半乳糖醛酸酶的研究进展[J].广东农业科学,2011,38(18): 125-127.
[4] 施巧琴.工业微生物育种学[M]. 3版.北京:科学出版社,2003:35-60.
[5] 杜国军,刘晓兰.产果胶酶黑曲霉的筛选及诱变育种[J].农业与技术,2008,28(2):68-70.
[6] 苏腾甲,朱雄伟,张佑红,等.果胶酶生产菌株的分离及其产酶条件优化[J].武汉工程大学学报,2012,34(4):15-18.
[7] 张智维,杨辉.He-Ne激光诱变选育果胶酶高产菌[J].食品工业科技,2006,27(10):156-157.
[8] 由田,宋刚.果胶酶高产菌株的紫外线及硫酸二乙酯的诱变育种[J]. 微生物学杂志,2011,31(5):69-72.
[9] Jayani R S, Saxena S, Guptar R. Microbial pectinolytlc enzymes:a review [J]. Process Biochemistry, 2005,40: 2931-2944.
[10] Xu W, Jameson D, Tang B. The relationshipbetween the rate of motecular evolution and the rate of genome rearrangement in animal mitochondrial genomes [J]. Journal of molecular evolution, 2006, 63(3): 375-392.
[11] Chiara V, Michela J, Vincenzo L.The Ectopic Expression of a Pectin Methyl Esterase Inhibitor Increases Pectin Methyl Esterification and Limits Fungal Diseases in Wheat[J]. Molecular Plant-Microbe Interactions,2011,24(9):1012-1019.
[12] Cascales I R, García J M, Roca J M. The effect of a commercial pectolytic enzyme on grape skin cell wall degradation and colour evolution during the maceration process[J]. Food Chemistry,2012,130(3):626-631.
[13] Wilde H D, Chen Y H, Jiang P. Anjanabha Bhatt-acharya.Targeted mutation breeding of horticultural plants[J]. Emirates Journal of Food and Agriculture,2012,24(1):31-41.
[14] Shahab S, Hoveize M S. Mutation induction using ethyl methanessulfonate(EMS) in regenerated plantlets of two verieties of sugarcane CP48-103 and CP57-614[J]. African Journal of Agricultural Research, 2012,7(8):1282-1288.
[15] Sridevi A , Mullainathan L. Effect of gamma rays and ethyl methane sulphonate(EMS) in M3 generation of blackgram (Vigna mungo L. Hepper) [J]. African Journal of Biotechnology,2012,11(15):3548-3252.
