虫瘿多样性及其与寄主植物和环境间关系
2012-06-09王义平
郭 瑞,王义平,吴 鸿
(浙江农林大学林业与生物技术学院,浙江临安 311300)
虫瘿是自然界极常见的生物现象。虫瘿是由造瘿生物产卵于寄主表面组织,诱导寄主植物细胞分裂加速而产生的一种形态多样、结构复杂的异常组织 (Stone&Schonrogge,2003;马双敏等,2008;王光钺等,2010)。形态各异的虫瘿凝聚着昆虫与植物间显著、复杂而密切的相互关系,是探讨多物种间协同进化的最佳模式材料。致瘿生物学也是生态学研究的新方向 (George,2002)。在所有造瘿生物中,昆虫是最主要的类群,包括膜翅目Hymenoptera、鳞翅目Lepidoptera、鞘翅目Coleoptera和半翅目Hemiptera等,但最为常见的主要有瘿蜂科 Cynipidae、瘿蚊科 Cecidomyiidae、瘿绵蚜科Pemphigidae和蓟马科Thripidae等 (刘世彪等,2008)。致瘿昆虫的寄主植物较为专一,如虫瘿的寄主与形态是鉴定致瘿昆虫物种的重要依据之一 (Stone&Schonrogge,2003)。同时虫瘿的分布随着寄主植物的分布、植物种类、土壤肥力等条件的变化而变化,所以致瘿昆虫物种丰富度与自然环境具有一定相关性。而虫瘿和寄主植物间的相互作用,也直接影响着致瘿生物的寄主选择、致瘿部位以及虫瘿的形态结构等。目前,虫瘿与寄主植物间的关系还不明确,致瘿昆虫的致瘿机理众说纷纭,尚无定论 (Price et al.,1987;Stone and Schonrogge,2003),更多的虫瘿资源有待进一步的调查和挖掘。因此,了解虫瘿基础生物特性、致瘿昆虫与寄主植物的关系以及明确影响虫瘿分布的因素,以期为虫瘿的致瘿机理、有害虫瘿的控制和有益虫瘿资源的开发和利用奠定理论基础。
1 虫瘿及其寄主植物的多样性
致瘿昆虫的种类多,据不完全统计,世界上致瘿昆虫主要隶属于7目20科,大约有132000多种,仅膜翅目瘿蜂科就有1300多种 (Espirito-Santo& Fernandes,2007;Chen& Qiao,2012)。其中在瘿蜂所形成的虫瘿中,寄生在壳斗科栎属Quercus植物的占86%,寄生蔷薇科蔷薇属Rose的占7%,寄生菊科Compositae的占7%(贾春枫等,2004;王光钺等,2010;Yoshihisa et al.,2007)。不同地理条件下寄主植物和致瘿昆虫的种类、致瘿部位及其所形成的虫瘿形态和颜色各异。根据虫瘿的形态特征分为:球状瘿、叶斑瘿、囊状瘿和花状瘿,依据寄生部位分为:芽瘿、花瘿、叶瘿、枝条瘿和根瘿等 (Blanche,1995;Rosalind&John,2001;Dorchin,2006;Rennan et al.,2007;Paulo et al.,2011)。表1所示的为不同生境条件下的虫瘿的多样性及其寄主植物的种类。
虫瘿的形态、颜色、瘿壁厚度与硬度、瘿室的大小等均对瘿内生物的发育产生重要影响,如处于瘿室直径较大和瘿壁较厚虫瘿内的瘿蜂,其个体具更高的生殖力,被天敌昆虫寄生的程度也相对较小;相反状况下的虫瘿更易受寄生天敌的攻击。虫瘿的颜色在一定程度上决定了虫瘿被寄生程度的大小。相关研究表明,虫瘿的颜色越鲜艳,其毒素越高,更有利于保护致瘿昆虫 (Inbar et al.,2010)。另外,虫瘿的寄生部位与虫瘿获取营养量具有密切关系。实验表明,移除由瘿蜂属在栎属植物叶片次脉叶缘形成的虫瘿后,处于叶中脉的虫瘿体积增大、重量增加,致瘿昆虫的重量也有所增加,其天敌危害率下降;但移除叶中脉的虫瘿后,则没有相似结果出现 (Rennan et al.,2007)。这可能与虫瘿养分的获取多少有关,即处于叶中脉的虫瘿可拦截次脉末梢的营养,使其获得更充足的营养供其生长。
2 虫瘿发育及其内部结构
以山柳菊和玫瑰上形成的瘿蜂虫瘿为例,虫瘿生长发育经历了3个阶段:初始、生长和成熟(Shorthouse & Leggo,2002;Sliva& Shorthouse,2006)。初始阶段始自幼虫瘿室的形成和营养细胞的分化,主要是致瘿昆虫通过产卵和取食等活动诱导寄主植物产生次生代谢物。在初始阶段,瘿蜂卵的裂解对周围细胞产生重要影响,并在植物的表面产生各种形状的卵室和死亡组织 (George,2006;Sliva&Shorthouse,2006)。这些组织联系产卵通道的疤痕组织的邻近细胞激发卵室增厚并发育成密集的细胞质,接着具有增大细胞核的细胞与卵室开始裂解退化,引起卵室进一步增大,经过十天后,卵开始孵化。然而孵化出来的幼虫并不立即取食,而是在卵室内保持静止状态,分生组织进一步膨大,卵室下面的细胞进一步增大裂解,在卵室下方的髓质内形成幼虫的孔洞 (Shorthouse&Leggo,2002)。15~20天,幼虫开始进入孔洞,并刺激周围细胞扩散,首次形成了虫瘿组织。受到幼虫影响的细胞变小,细胞核变大,细胞质稠密度增加,幼虫孔洞也刺激髓质周围的细胞环绕着幼虫的孔洞,分化成前形成层,并且虫瘿组织继续分化,形成不同的幼虫虫室,进而产生封闭的幼虫室 (图2.1-4)(George,2006)。
成长阶段是指瘿室内的营养细胞分化为多层营养层,表现为致瘿昆虫刺激植物产生环绕卵或幼虫的虫瘿组织,致瘿昆虫从寄主植物中取食营养细胞和吸收养分 (Ozaki et al.,2005;George,2006)。经过起始阶段后经过15~20天后,虫瘿通常停止发育,随着细胞核的增大和细胞质稠密度的增加,营养组织环绕幼虫虫室。正在发育的幼虫取食营养组织中的营养细胞。营养层薄壁组织(PNT)层的最内层转变为营养组织 (NT),维管营养组织 (VT)环绕着幼虫虫室,保持着未分化状态(图3)(George,2006;Sliva& Shorthouse,2006)。
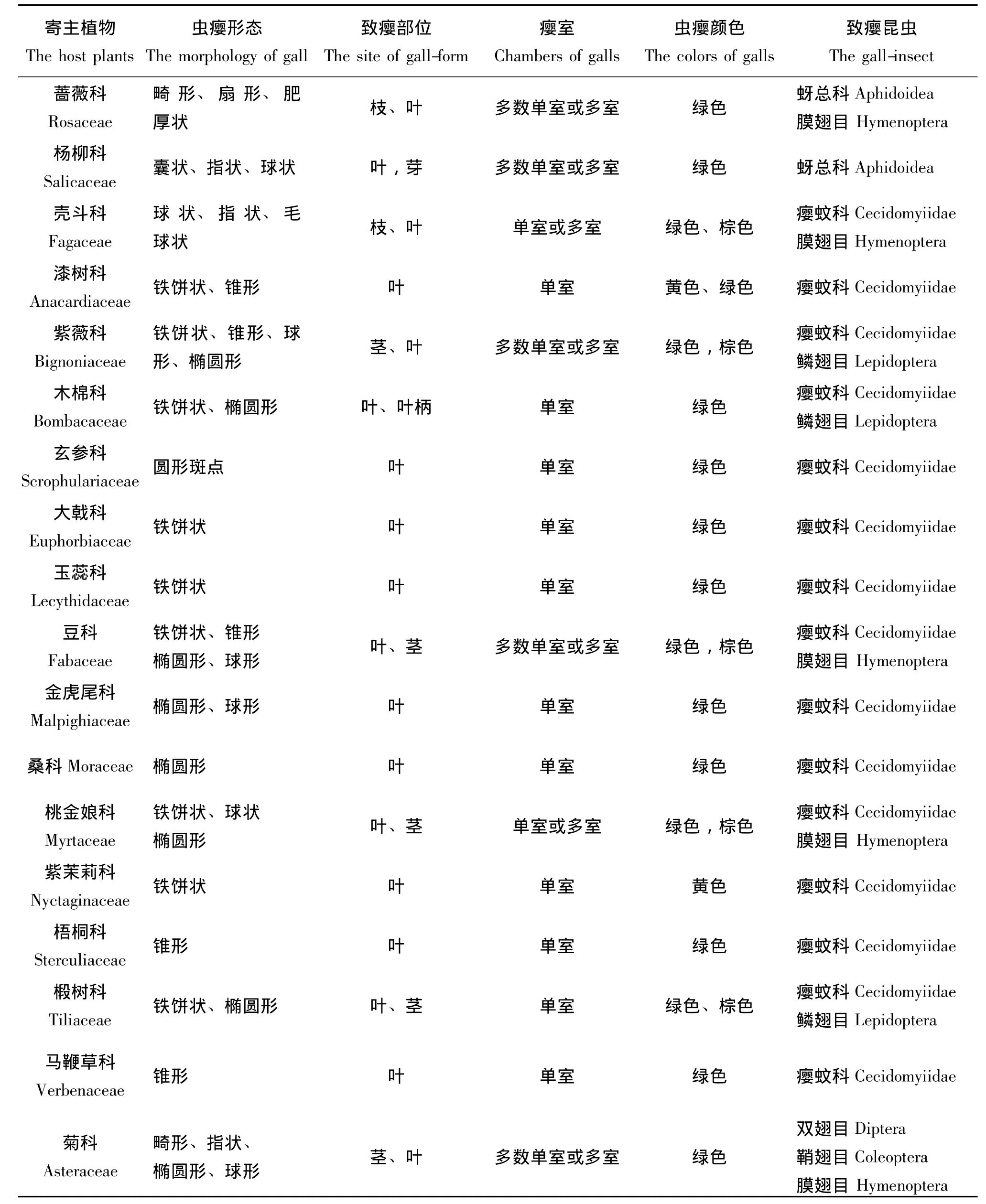
表1 虫瘿形态结构及其寄主多样性Table 1 The insect galls morphology and its diversity of hosts
成熟阶段以虫瘿细胞的分散和虫瘿成长的结束为标志,在这一阶段中,虫瘿内幼虫瘿室的木质细胞开始分化,一部分虫瘿皮质细胞增厚,这些细胞环绕着幼虫虫室,形成坚硬的细胞组织;另一部分细胞变簿,形成海绵状的组织结构(Ozaki et al.,2005;Sliva& Shorthouse,2006)。环绕着幼虫虫室的营养细胞在幼虫瘿室周围增大,最终积累为坚硬的细胞组织,从而使虫瘿进一步增厚形成韧皮部和形成层细胞。当所有的营养组织并被幼虫取食后,成熟的虫瘿中央内发育为标准瘿室,此时幼虫的瘿室不曾完全被愈伤组织所填充 (图2.5)(Shorthouse& Leggo,2002;Sliva&Shorthouse,2006)。成熟后的瘿室内昆虫停止吸收寄主植物营养并停止发育。
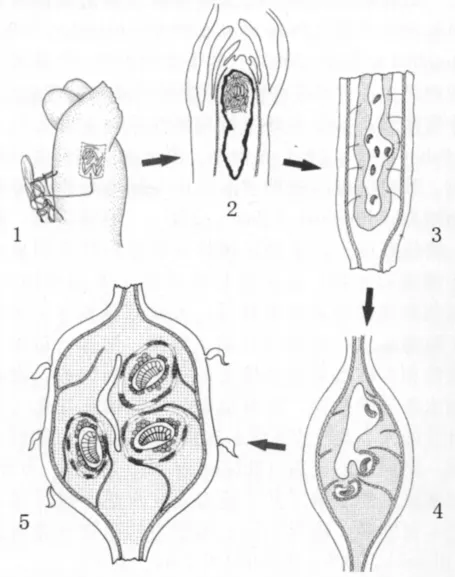
图2 图示瘿蜂在山柳菊上形成虫瘿的各个生长阶段 (Sliva&Shorthouse,2006)Fig.2 The stages in the development of galls of Aulacidea hieracii on Hieracium umbellatum
3 虫瘿与寄主植物间关系
近年来,诸多学者认为虫瘿是植物产生防御性反应的产物 (Stone&Schonrogge,2003)。而目前普遍认为,致瘿昆虫可以操纵寄主植物形成虫瘿,但是其机制尚不清楚。有关研究表明,致瘿昆虫可根据寄主植物产生的特定化学挥发物在寄主植物上造瘿,且不同浓度的挥发物的诱导作用各不相同 (Allison&Schultz,2005)。不同致瘿昆虫对寄主植物的选择还取决于寄主本身,如大多数致瘿昆虫选择生长旺盛的植物及其部位致瘿。然而,瘿蜂的个别种类则选择树势较弱的植物作为寄主 (Williams&Cronin,2004)。

图3 成长阶段虫瘿的瘿室内部结构 (瘿蜂在玫瑰上形成的虫瘿)(Sliva&Shorthouse,2006)Fig.3 larval Chambers of galls of Diplolepis spinosa on Rosa rugosa
致瘿昆虫与寄主植物间的直接相互作用主要表现为致瘿昆虫的产卵和取食。产卵发生在虫瘿形成前,在这个过程中,寄主植物的物理或化学作用影响致瘿昆虫的产卵;而产卵反过来又会决定致瘿昆虫的发育及存活 (Stone&Schonrogge,2003;Kollár,2011)。因此,寄主植物防御致瘿昆虫的主要策略是抑制致瘿昆虫的产卵行为,或降低其产卵效率。致瘿昆虫在产卵阶段,寄主是如何实现这一保护机制?已有研究表明:致瘿昆虫产卵器能否成功突破寄主植物的表皮障碍是致瘿的关键,因此,坚硬而厚实的表皮是寄主植物保护自身防御致瘿昆虫的生态策略之一 (Hartley,1998)。致瘿昆虫在取食阶段,寄主植物必定也会产生一定的防御体系来应对致瘿昆虫,但致瘿昆虫能够克服寄主植物的防御体系,成功取食植物组织。实验表明,部分膜翅目致瘿昆虫为了避免植物自身所产生的化学物质毒害,它们利用自身的酶化系统,使其具有毒性的组织处于最外层,而新生内层组织立即环绕幼虫来减少毒素水平,利于其生长 (Allison&Schultz,2005)。这样就使得寄主防御所产生高浓度的次生代谢产物变成自身有利的营养组织,同时减少了寄生天敌的攻击(Stone & Schonrogge,2003;Tooker& Hanks,2004;Allison & Schultz,2005)。Hartley(1998)的实验表明,由于致瘿昆虫天敌主要以致瘿昆虫幼虫为食,而在被寄生过程中,天敌难以通过虫瘿外部毒素进入瘿室而达到寄生的目的,因此,致瘿昆虫就不会受到影响。另外,虫瘿的外部形态结构也是致瘿昆虫保护其幼虫不受天敌危害的一种形式。研究表明,虫瘿结构和颜色是限制寄生蜂寄生致瘿昆虫的主要因子之一 (Inbar et al.,2010),如在虫瘿形成初期,因虫瘿表面软而导致致瘿昆虫被寄生的几率较大;而在发育末期,虫瘿壁较厚、外壳变得坚硬,此时被寄生几率较小。
4 虫瘿多样性与寄主植物及其环境间关系
致瘿昆虫与寄主植物之间具有高度的特异性,对生境的变化具有较好的指示作用。寄主植物的分布、寄主植物栖境的空间结构以及土壤肥力的变化等因素均能影响到虫瘿的多样性。因此,明确影响致瘿昆虫寻找寄主植物的因素,对充分利用虫瘿资源,提高防治效果极为重要。
4.1 寄主植物
植物种类的多样性及其分布决定了虫瘿的丰富度。相关实验表明,致瘿昆虫的分布主要受植物种类和数量的影响,随着植物种类和数量的增加,致瘿昆虫的寄主植物就越多,致瘿的机会就会越多,反之,致瘿昆虫的种类可能会受寄主植物物种的减少而下降 (Wright&Samways,1996,1998;Pablo et al.,2003)。但是,不同生境下也可能会表现相反的现象,如单一的的植物群落具有着最丰富的致瘿昆虫群落,而最多样化的植物群落具有最少的致瘿昆虫群落。这可能与天敌数量、生境等因素有关。如在巴西进行的致瘿昆虫多样性研究结果表明,由于植物不同种类之间的他感作用,导致原始森林中虫瘿的种类多样性最低,而人工林和次生林,其多样性指数较高(Rennan et al.,2007)。因此,植物物种丰富度是影响致瘿昆虫多样化的主要因素。
致瘿昆虫的物种丰富度还可能与植物类型(如乔木,灌木,草本和藤本植物)和一些植物种类的生命形式相联系,这就使得植物群落改变了致瘿昆虫物种丰富度 (Pablo et al.,2003;Silmary et al.,2001;Mohammed et al.,2012)。广泛分布的植物比分布范围较小的植物更容易受到致瘿昆虫的攻击。如Egan和Ott(2007)的实验结果表明,广泛分布的植物,虫瘿的发生率较高。通过比较同类植物不同地理分布之间的实验表明,广泛分布的植物比分布范围小的植物的更易致瘿,致瘿昆虫物种更丰富 (Blanche&Westoby,1996)。这样的结论是否与两种分布不同物种的化学防御体系有关,还是与广泛分布的物种具更强的引诱作用有关,还有待进一步调查研究。
4.2 海拔高度、温度与湿度
海拔和纬度梯度与虫瘿及其致瘿昆虫多样性具有密切关系 (Price et al.,1998;Blanche,2000;Rosalind&John,2001)。相关实验表明,虫瘿及其致瘿昆虫在中海拔高度和干燥的环境中分布较广、丰富度较高,而在高海拔和低海拔高度分布较少(Pablo et al.,2003)。但是,由于温度和湿度的影响,致瘿昆虫的物种丰富度也会随着海拔的降低而增加 (Rosalind&John,2001)。研究发现,同一海拔高度下,干燥区域的致瘿昆虫数量明显多于潮湿的区域。这主要是在炎热干燥的环境中,真菌和细菌的发生率较低,天敌数量较少,更利于致瘿昆虫在这样的环境下致瘿。然而,对被水淹没和未被水淹没环境下的植物进行研究,发现被水淹没的植物,随着植物叶片的特征变化 (如叶片的大小及较快的增长速度),致瘿的可能性会有一定程度的提高 (Ribeiro et al.,1998)。另外,致瘿昆虫的丰富度并不绝对是在炎热干燥环境下的丰富度高,还与不同土壤肥力的植物种类有关(Blanche,2000;Rosalind& John,2001)。
4.3 土壤肥力
贫瘠土地上的植物会产生较高浓度的次生代谢产物,如油和酚,而这两类次生代谢产物为致瘿昆虫与自然天敌的斗争提供了保护 (Pablo et al.,2003,2011)。以磷作为土壤肥力指标,在相对肥沃的土壤中,虫瘿及其致瘿昆虫的数最和种类较少。相比之下,贫瘠土壤上的植被具虫瘿较多 (Pablo et al.,2003)。这些结果表明土壤肥力越低,虫瘿及其致瘿昆虫丰富度越高。但Blanche(1996)的研究发现,虫瘿及其致瘿昆虫物种多样性与土壤肥力没有直接联系,但可以通过植物类群产生间接的联系。因此,土壤肥力的大小是否是形成虫瘿的主要因素还有待于进一步研究。
5 讨论
虫瘿是致瘿昆虫与寄主植物相互作用的结果,而致瘿昆虫能够依据化学物质选择特定的寄主植物,并表现为相对的专一性。目前对虫瘿形成的机制已有探索性研究,得到了诸多初步结论。如影响瘿蜂科虫瘿形成的主要因素是,外在的空间资源的局限性及其寄主植物的专一性,以及内在的寄生天敌。由于瘿蜂科致瘿昆虫对寄主的特异性,影响了瘿蜂种群数量的大小。另外,某些瘿蜂对寄主植物的选择主要决定于植物活性的大小,其多寄生于生长旺盛且未成熟部位的寄主植物。但致瘿昆虫是如何定位寄主和致瘿部位,以及致瘿昆虫对致瘿植物部位组织的要求所知甚少。目前仅知致瘿昆虫在产卵过程中产生的化学物质引起了虫瘿的产生,但这些化学物质的成分及量与虫瘿形成的关系还在进一步验证中。
致瘿昆虫的基因决定形成的虫瘿的形态和结构,但控制虫瘿形态和结构的基因及其表达过程并不确定。致瘿昆虫与寄主植物间的协同进化机制,以及致瘿昆虫物种分化机制也是虫瘿的研究的热点之一。另外,虫瘿具有零星分布的习性,且目前对致瘿昆虫与寄主植物的对应关系还不确定,更多致瘿昆虫的种类及其生活史、生物学和寄生天敌等基础研究仍然十分薄弱,而本文综述可对虫瘿的发生、防治及其阐明多物种的协同适应关系奠定基础。多数情况下,虫瘿对寄主植物是有害的,但在虫瘿与寄主植物的相互适应过程中,虫瘿的形成限制了致瘿昆虫的进一步危害。甚至有的虫瘿对寄主植物的生长具有决定作用,如榕小蜂类昆虫形成的虫瘿利于榕属植物的传粉(刘世彪等,2008)。另外,虫瘿组织的复杂性决定其化学成分的多样化,且化学组成和含量因致瘿生物种类的不同而各异,虫瘿组织的化学成分主要包括氮、糖类、酚类、淀粉、各种酸、单宁和单萜类化合物等,这些化学物质均是较好的工业原料,具有较大应用价值。另外,虫瘿的典型代表之一,即五倍子Galla chinensis是世界名贵中药材。因此,对主要致瘿昆虫的种类资源、生活史、生物学等研究既具有重要的理论与实践应用价值。
6 未来研究方向
鉴于致瘿生物学研究发展时间短、基础弱、虫瘿生物学的复杂性和特殊性,因此,对致瘿生物学的研究势在必行。以下几方面将是未来主要的研究方向:(1)致瘿生物物种的野外调查与鉴定。致瘿生物物种种类繁多,但目前所知种类甚少,特别是特殊生境中的虫瘿 (如植物根部和树冠部位的虫瘿)以及具有较高经济价值的虫瘿有待于挖掘;(2)瘿室内物种群落结构组成及其相互关系。尽管瘿室复杂 (单室或多室)而微小,但常有不同物种共栖 (如致瘿昆虫-寄瘿昆虫-寄生天敌)。因此,瘿室内物种组成以及彼此间的竞争关系值得进一步研究;(3)影响致瘿生物的选择及定位寄主植物的主要因素。鉴于致瘿生物与寄主植物的专一性对,致瘿生物是如何搜寻寄主植物,特别是对特殊生境致瘿部位的定位 (如寄主植物根部)值得深入研究;(4)虫瘿的化学组成及其含量。虫瘿内的某些化学物质比正常叶片高出多倍,且大多具有较高经济价值。因此,更多的未知虫瘿及其化学物质有待进一步挖掘和开发;(5)致瘿生物的致瘿机理。尽管三种假说(即天敌假说、微环境假说和营养假说)都能够解释致瘿昆虫的成因,但均缺少充足而可信的支持证据。因此,寻找更多的证据阐明致瘿生物的致瘿机理将会是研究的重点和热点。
References)
Allison SD,Schultz JC,2005.Biochemical responses of chestnut oak to a galling cynipid.Journal of Chemical Ecology,31:151-166.
Blanche KR,1995.Gall-forming insect diversity is linked to soil fertility via host plant taxon.Ecology,76:2334-2337.
Blanche KR,Westoby M,1996.The effect of the taxon and geographic range size of host eucalypt species on the species richness of gallforming insects.Australian Journal of Ecology,21:332-335.
Blanche KR,2000.Diversity of insect-induced galls along a temperature-rainfall gradient in the tropicalsavanna region of the Northern territory,Australia.Australian Ecology,25:311-318.
Dorchin N,Cramer MD,Hoffmann JH,2006.Photosynithesis and sink activity of wasp-induced galls in Acacia Pycnantha.Canada Journal of Botany,87:1781-1791.
Egan SP,Ott JR,2007.Host plant quality and local adaptation determine the distribution of a gall-forming herbivore.Ecology,88:2868-2879.
Espirito-Santo MM,Fernandes GW,2007.How many species of gallinducing insects are there on earth,and where are they?Annals of Entomological Society of America,100:95-99.
George M,Thuroczy C,2002.Parasitic Wasps:Evolution,Systematics,Biodiversity and Biological Control.Budapest:Agroinform Press.296-322.
George M,2006.Gall wasps of Ukraine.Cynipidae.Vestnik Zoologii(Suppl):1-67.
Hartley SE,1998.The chemical composition of plant galls:are levels of nutrients and secondary compounds controlled by the gall-former?Oecologia,113:492-501.
Inbar M,Izhaki I,Koplovich A,Lupo I,Silanikove N,Glasser T,Gerchman Y,Perevolotsky A,Lev-Yadun S,2010.Why do many galls have conspicuous colors?A new hypothesis.Arthropod-Plant Interactions,4:1-6.
Jia CF,Liu ZQ,2004.The peculiar insect galls.Chinese Bulletin of Entomology,41(6):603-607.[贾春枫,刘志琦,2004.奇特的虫瘿.昆虫知识,41(6):603-607]
Kollár J,2011.Gall-inducing arthropods associated with ornamental woody plants in a city park of Nitra(SW Slovakia).Acta Entomologica Serbica,16:115-126.
Liu SB,Zhang DG,Gong SJ,2008.Insect gall and gall-making Insect.Bulletin of Biology,43(6):17-21.[刘世彪,张代贵,龚双姣,2008.植物的虫瘿与成瘿昆虫.生物学通报,43(6):17-21]
Ma SM,Yu H,Li CC,2008.Insects galls of plants.Chinese Bulletin of Entomology,45(2):330-335.[马双敏,虞泓,李晨程.2008.植物虫瘿.昆虫知识,45(2):330-335]
Mohammed RZ,Nadir E,Youbert G,2012.Changes in oak gall wasps species diversity(Hymenoptera:Cynipidae)in relation to the presence of oak powdery mildew(Erysiphe alphitoides).Zoological Studies,51(2):175-184
Ozaki K,Yukawa J,Ohgushi T,2005.Galling Arthropods and Their Associates.Tokyo:Springer Verlag Press,1-308.
Pablo CR,Cristina S,Miguel MRamos,Ken O,2003.Species richness of gall-forming insects in a tropical rain forest:correlations with plant diversity and soil fertility.Biodiversity and Conservation,12:411-422.
Pablo CR,Fabricio T,Geraldo WF,Mercedes B,2011.Abundance of gall-inducing insect species in sclerophyllous savanna:understanding the importance of soil fertility using an experimental approach.Journal of Tropical Ecology,27:631-640.
Paulo SD,Braulio AS,Marcelo T,Jarcilene SA,2011.Occurrence of gall complexes along a topographic gradient in an undisturbed lowland forest of central Amazonia.Revista Brasileira de Biociências,9(2):133-138.
Price PW,Fernandes GW,Lara AC,Brawn J,Barrios H,George M,Ribeiro SP,Rothcliff N,1998.Global patterns in local number of insect galling species.Journal of Biogeography,25:581-591.
Qiao GX,Chen J,2012.Galling aphids(Hemiptera:Aphidoidea)in China:Diversity and host specificity.Hindawi Publishing Corporation,10:1-11.
Rennan GM,Geraldo WF,Emmanuel DA,Jean CS,2007.Galling insects as bioindicators of land restoration in an area of Brazilian Atlantic Forest.Instituto de Ciências Biologicas-UFMG,8(2):107-112.
Richard B,Karsten S,James MC,George M,György C,Csaba T,Graham NS,2009.Host niches and defensive extended phenotypes structure parasitoid wasp communities.POLS Biology,7(8):1-12.
Ribeiro KT,Madeira JA,Monteiro RF,1998.Does flooding favor galling insects?Ecological Entomology,23:491-494.
Rosalind B,John AL,2001.Species richness of gall-inducing insects and host plants along an altitudinal gradient in Big Bend National Park,Texas.The American Midland Naturalist,145:219-233.
Shorthouse JD,Leggo JJ,2002.Immature stages of the galler Diplolepis triforma(Hymenoptera:Cynipidae)with comments on the role of its prepupa.The Canadian Entomologist,134:433-446.
Silmary J,Gonçalves A,Fernandes GW,2001.Biodiversity of galling insects:historical,community and habitat effects in four neotropical savannas.Biodiversity and Conservation,10:79-98.
Sitch TA,Grewcock DA,Gilbert FS,1988.Factors affecting components of fitness in a gall-making wasp(Cynips divisa).Oecologia,76:371-375.
Sliva MD,Shorthouse JD,2006.Comparison of the development of stem galls induced by Aulacidea hieracii(Hymenoptera:Cynipidae)on hawkweed and by Diplolepis spinosa(Hymenoptera:Cynipidae)on rose.Canadian Journal of Botany,84(7):1052-1074.
Stone GN,Schonrogge K,2003.The adaptive significance of insect gall morphology.Trends in Ecology & Evolution,18(10):512-514.Tooker JF,Hanks LM,2004.Stereochemistry of host plant monoterpenes as mate location cues for the gall wasp Antistrophus rufus.Journal of Chemical Ecology,30:473-477.
Wang GY,Wang YP,Wu H,2010.Gall and gall-former insects.Chinese Bulletin of Entomology,47(2):414-424.[王光钺,王义平,吴鸿,2010.虫瘿与致瘿昆虫.昆虫知识,47(2):414-424]
Williams MA,Cronin JT,2004.Response of a gall-forming guild(Hymenoptera:Cynipidae)to stressed and vigorous prairie roses.Environmental Entomology,33:1052-1061.
Wright MG,Samways MJ,1996.Gall-insect species richness in African Fynbos and Karoo vegetation:the importance of plant species richness.Biodiversity Letters,3:151-155.
Wright MG,Samways MJ,1998.Insect species richness tracking plant species richness in a diverse flora:gall-insects in the Cape Floristic Region,South Africa.Oecologia,115:427-433.
Yoshihisa A,George M,Graham NS,2007.The diversity and phylogeography of cynipid gall-wasps(Hymenoptera,Cynipidae)of the Oriental and Eastern Palaearctic regions,and their associated communities.Oriental Insects,41:169-212.
